Если бы молекулы только притягивались друг к другу, это привело бы к их слиянию. Но на очень малых расстояниях их электронные оболочки начинают отталкиваться. Энергия отталкивания дается выражением
E = + k / rn,
где k - постоянная отталкивания, n принимает различные целые значения (5-15). Силы межмолекулярного отталкивания действуют на очень малых расстояниях.
Общее уравнение межмолекулярного взаимодействия при постоянной температуре (уравнение Леннарда-Джонсона) в большинстве случаев имеет вид
E M = − a / r 6 + b / r 12
и носит название "потенциала 6-12", поскольку энергия притяжения пропорциональна 1 / r 6, а энергия отталкивания - 1 / r 12.
Донорно-акцепторное взаимодействие — перенос заряда между молекулами донора и акцептора без образования между ними химической связи (обменный механизм); или передача неподеленной электронной пары от донора к акцептору, приводящей к образованию связи (донорно-акцепторный механизм).
Свойства ковалентной химической связи, образованной по донорно-акцепторному механизму, ничем не отличаются от свойств связей, образованных по обменному механизму (например, связи N—H в аммонии (NH4+) или связи B—F в (BF4-)). Донорами обычно выступают атомы азота, кислорода, фосфора, серы и др., имеющие неподелённые электронные пары на валентных орбиталях малого размера. Роль акцептора могут выполнять ионизированный атом водорода H+, некоторые p-металлы (напр., алюминий, бор при образовании иона AlH4-,BF4- соответственно) и, в особенности, d-элементы, имеющие незаполненные энергетические ячейки в валентном электронном слое.
Обменный механизм
Обменный механизм образования ковалентной связи реализуется за счет перекрывания электронных облаков электронов, принадлежащих различным атомам. Например, при сближении двух атомов водорода происходит перекрывание 1s электронных орбиталей. В результате возникает общая пара электронов, одновременно принадлежащая обоим атомам. При этом химическая связь образуется электронами, имеющими антипараллельные спины.
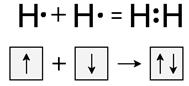
Донорно-акцепторный механизм
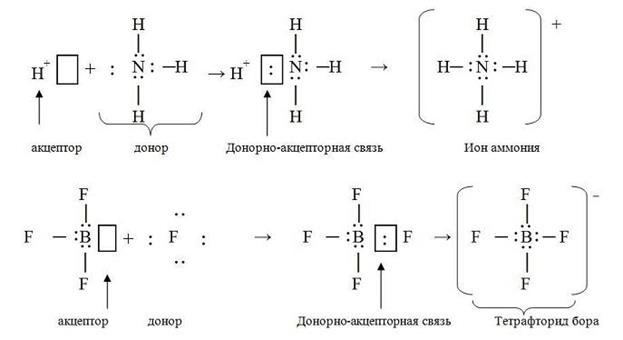
При донорно – акцепторном механизме образования ковалентной связи связь также образуется с помощью электронных пар. Однако в этом случае однин атом (донор) предоставляет свою электронную пару, а другой атом (акцептор) участвует в образовании связи своей свободной орбиталью. Примером реализации донорно-акцепторной связи является образование иона аммония NH4+ и иона тетрафторида бора BF4- .
В молекуле NH3 три электронные пары образуют три связи N – H, четвертая, принадлежащая атому азота электронная пара является неподеленной. Эта электронная пара может дать связь с ионом водорода, который имеет свободную орбиталь. В результате получается ион аммония NH4+. Необходимо отметить, что существующие в ионе NH4+ четыре ковалентных связи N – H равноценны. В ионе аммония невозможно выделить связь, образованную по донорно-акцепторному механизму.
Вакантная р-АО в атоме бора в молекуле BF3 акцептирует пару электронов от фторид-иона (донор). В образовавшемся анионе четыре ковалентные связи В-F равноценны по длине и энергии. В исходной молекуле все три связи В-F образовались по обменному механизму.
Комплексные (координационные) соединения, строение, роль в биологии.
Силы притяжения действуют не только между атомами, но и молекулами. Это подтверждается тем что, взаимодействие молекул часто приводит к образованию более сложных молекул. При соответствующих условиях возможны даже переходы из одного агрегатного состояния в другое. Вещества в той или иной степени растворимы в друг друге. Комплексообразование - взаимная координация взаимодействующих частиц. Например, взаимодействие молекул с ионами, противоположно заряженных ионов и молекул друг с другом и т.п. Образующиеся при растворении солей в воде ионы – гидратированы, т.е. вокруг них координированы молекулы растворителя. Взаимная координация наблюдается при переходе из одного состояния в другое.
Причины комплексообразования:
· Электростатическое взаимодействие;
· Донорно-акцепторное взаимодействие, осуществляемое между ионами и молекулами, между молекулами.
Основополагающие представления о комплекных соединениях ввел А.Вернер (1892). В дальнейшем большую роль в развитии химии комплексных соединений сыграли труды:
· Чугаев Л.А.;
· Черняев И.И.;
· Гринберг В.В.;
· Лебединский В.В. и др.
По Вернеру, в большинстве комплексных соединений различают:
· Внутреннюю;
· Внешнюю сферу.
Например, в комплексных соединениях К2[BeF4], [Zn(NH3)4]Cl2 внутреннюю сферу составляют группировки атомов (комплексы) [BeF4]2- и [Zn(NH3)4]2+, а внешнюю сферу – соответственно ионы К+, Cl-. Центральный атом (ион) внутренней сферы является комплексообразователем, а координационные вокруг него молекулы (ионы) – лигандами. В формулах комплексных соединений внутреннюю сферу (комплекс) часто заключают в квадратные скобки.
Координационными называют соединения, содержащие в одном из агрегатных состояний группу ионов или нейтральных молекул (лигандов), в определенном порядке размещенных (координированных) вокруг атома (иона) – комплексообразователя.
Формула координационного иона или молекулы записывается, как правило, слева направо в следующей последовательности: центральный атом (ион), анионные, затем нейтральные лиганды с указанием их числа в виде правого нижнего индекса: [ML m X n ] q.
Комплексные соединения часто имеют довольно сложный состав и строение; к настоящему времени разработаны специальные системы составления их химического названия (номенклатуры).
Существуют три основных подхода к номенклатуре комплексных соединений металлов:
1. Традиционные специфические вненоменклатурные названия, по которым различным комплексным соединениям присваивались те или иные наименования (например, K4[Fe(CN)6] – желтая кровяная соль, ферроцианид калия; K3[Fe(CN)6] – красная кровяная соль, феррицианид калия; [Pt(NH3)4](OH)2 – первое основание Рейзе; транс-[Pt(OH)2(NH3)2] – второе основание Рейзе; цис-[PtCl2(NH3)2] – хлорид Пейроне; K[Co(NO2)4(NH3)2] – соль Эрдмана и т.д.).
2. Номенклатура, предложенная основателем координационной теории швейцарским химиком Альфредом Вернером, принятая в несколько измененном виде его последователями.
3. Номенклатура, рекомендованная в 1960 г. комиссией по номенклатуре неорганических соединений Международного союза по чистой и прикладной химии (ИЮПАК). В современной научной, учебной, медицинской литературе используются все три подхода, хотя можно отметить тенденции к преимущественному применению номенклатуры, рекомендованной ИЮПАК, как наиболее логически обоснованной. В русском языке эта номенклатура несколько модифицирована, адаптирована к правилам русского языка.
Номенклатура, предложенная А. Вернером
Комплексные катионы. Вначале называют отри-цательно заряженные лиганды внутренней сферы с окончанием “о” (хлоро-, бромо-, нитро-, родано- и т.д.). Если их число больше одного, то перед названиями лигандов добавляют числительные ди-, три-, тетра-, пента-, гекса- и т.д. Затем называют нейтральные лиганды, причем молекулу воды называют “акво”, молекулу аммиака – “аммин”. Если число нейтральных лигандов больше одного, то добавляют числительные ди-, три-, тетра- и т.д. После нейтральных лигандов называют атом металла-комплексообразователя и в последнюю очередь – внешнесферные анионы. При этом наименование атома металла составляют из корня его латинского названия с характерным окончанием, зависящим от степени окисления центрального атома металла-комплексообразователя. Окончания эти следующие: Примеры (для наглядности здесь и далее указана степень (состояние) окисления центрального металла, хотя обычно это не делается): [Pt(NH3)4]Cl2 – тетрамминплатохлорид; [Pt(NH3)4Cl2]Cl2 – дихлоротетрамминплатехлорид; [Co(NH3)5Cl]SO4 – хлоропентамминкобальтисульфат.
Комплексные анионы. Вначале называют отрица- тельно заряженные лиганды с соответствующими числительными (ди-, три-, тетра-, и т.д.). Затем на- зывают нейтральные молекулы, после чего идет на- звание металла с соответствующим окончанием, ха- рактеризующим его степень окисления, к которому добавляют еще суффикс “ат”. В заключение в роди- тельном падеже называют внешнесферные катионы. Примеры K[Ag(CN)2] – дицианоаргентаат калия; K2[PtCl6] – гексахлороплатеат калия; K4[Fe(CN)6] – гексацианоферроат калия;
Степень окисления I II III IV V VI VII VIII
Окончание а о н у ан он ин ен
Na3[Fe(CN)6] – гексацианоферриат натрия.
Нейтральные комплексы. Названия строят аналогично предыдущему, за исключением того, что к наименованию металла-комплексообразователя не прибавляют никаких окончаний. Примеры [Pt(NH3)2Cl2] – дихлородиамминплатина; [Co(NH3)3(NO2)3] – тринитротриамминкобальт; [Cr(NH3)3(SCN)3] – трироданотриамминхром; [RhPy3(C2O4)Cl] – хлорооксалатотрипиридинродий.
Классификация комплексов
- по характеру электрического заряда
· Катионные
Можно рассматривать как образованный в результате координации вокруг положительного иона нейтральных молекул (H2O, NH3 и др.).
[[Al(OH2)6]Cl3 – трихлорид гексаакваалюминия, или хлорид гексаакваалюминия (III)
[[Zn(NH3)4]Cl2 – дихлорид тетрааминцинка, или хлорид тетрааминцинка (II)
Соединения, содержащие амминокомплексы, называются аммиакатами, содержащие аквакомплексы – гидратами.
· Анионные
В роли комплексообразователя выступает атом с положительной степенью окисления (положительный ион), а лигандами являются атомы с отрицательной степенью окисления (анионы).
К2[BeF4] – тетрафторобериллат (II) калия
К[Аl(OH)4] – тетрагидрооксоалюминат (III) калия
Na2[SO4] – тетраоксосульфат (VI) натрия
К2[Be(SO4)2] – дисульфатобериллат (II) калия
· Нейтральные комплексы образуются при координации вокруг атома молекул, а также при одновременной кординации вокруг положительного иона-комплексообразователя отрицательных ионов и молекул.
Например:
[Pt(NH3)2Cl2] – дихлородиамминплатина (II)
[Ni(CO)4)] – тетракарбонил никеля
[Cr(C6H6)2] – дибензолхром
Электронейтральные комплексы, следовательно, являются комплексными соединениями без внешней сферы.
Среди комплексных соединений имеются кислоты, основания и соли; есть также и вещества, недиссоциирующие на ионы, т.е. неэлектролиты. Примеры: кислоты - H[AuCl4], основания - Ag[(NH3)2]OH, соли - Na3[AlF6] и неэлектролиты - [Ni(CO)4].
Роль комплексообразователя может играть любой элемент периодической системы. В соответствии со своей химической природой неметаллические элементы обычно дают анионные комплексы, в которых роль лигандов играют атомы наиболее электроотрицательных элементов, например K[PF6] (гексафторофосфат калия), K3[PO4], K3[PS4].У металлических элементов (щелочных и щелочно-земельных Ме) способность образовывать комплексные соединения с неорганическими лигандами выражена слабо. Имеющиеся немногочисленные комплексные ионы являются катионными, например [Sr(OH2)6]Cl2, [Ca(NH3)8]Cl2. Амфотерные элементы, которые занимают промежуточное положение между типичными металлическими и неметаллическими элементами, образуют как катионные, так и анионные комплексы, например [Al(OH2)6]Cl3 и K[Al(OH)4].
Важнейшим параметром комплексообразователя и всего координационного соединения является координационное число (кч), которое наряду со степенью окисления в комплексных соединений служит еще одной его характеристикой.
Координационным числом называют число атомов лигандов, непосредственно присоединенных к центральному атому. Лиганды характеризуются дентатностью (от английского «dent» – зуб). К лигандам, способным занимать только одно координационное место (монодентатным), относятся H2O, NH3, C5H5N – пиридин (py), другие полярные молекулы (PPh3), однозарядные анионы CN–, Hal–, OH– и т. п. Некоторые лиганды могут занимать более одного координационного места, если содержат два и более донорных (со свободной электронной парой) атома. Такие лиганды называют полидентными: NH2–CH2–CH2–NH2 (en) – этилендиамин (бидентантный), NH2–CH2–COO– (gly) – глицинат (бидентантный). Комплексы с полидентными лигандами называются хелатными.
Нехелатный и хелатный комплексы меди (II):

С учетом дентатности координационное число атома-комплексообразователя равно произведению числа лигандов во внутренней координационной сфере комплекса на их дентатность.
Многие лиганды могут выступать также в качестве мостиковых атомов (групп атомов) в многоядерных (полимерных) комплексах.
Например, центральные атомы октаэдрических комплексов могут быть соединены посредством одного, двух или трех мостиковых атомов (групп атомов). Структурные формулы соединений кобальта (III):

Изомерия комплексных соединений
Среди комплексных соединений широко распространено явление изомерии. Изучение изомерии комплексов позволило установить их пространственное строение.
Основные типы изомерии комплексных соединений:
Ионизационная изомерия связана с различным распределением ионов между внешней и внутренней сферами комплексного соединения, например [Co(NH3)5Br]SO4 и[Co(NH3)5SO4]Br; [Co(En)2(NO2)Cl]Cl и [Co(En)2Cl2]NO2 (En — молекула этилендиамина NH2 — СН2—CH2 — NH2).
Координационная изомерия присуща тем соединениям, в которых как катион, так и анион являются комплексными; она обусловлена различным распределением лигандов между комплексообразователями. Примерами таких изомеров служат: [Cu(NH3)4][PtCl4] и [Pt(NH3)4][CuCl4]; [Сo(NН3)6] [Сг(СN)6] и [Cr(NH3)6] [Co(CN)6].
Изомерия лигандов возможна в тех случаях, когда молекулы или ионы лиганда могут существовать в нескольких изомерных формах. Такой вид изомерин наблюдается, например, когда лигандами являются соединения NH2(CH3)2CCH2NH2 и NH2(CH3)CHCH2CH2NH2 или NH2CH2CH2CH2CH2NH2 и CH3NHCH2CH2NHCH3.
Так же, как и для органических веществ, для комплексов характерны виды изомерии, связанные с различным пространственным расположением частиц, цис-транс-изомерия изеркальная изомерия.
Для комплексов с координационным числом 4 цис-транс-изомерия возможна, если четыре лиганда находятся в одной плоскости. Примером являются

При тетраэдрическом расположении лигандов цис-транс-изомерия невозможна.
Примером зеркальных изомеров являются комплексы хрома (III) содержащие две молекулы этилендиамина. Координационное число Сr+3 равно 6; лиганды располагаются по вершинам октаэдра, в центре которого находится ион Сr+3. Молекула этилендиамина, имеющая изогнутую форму, присоединяется к Сг+3 двумя группами NH2 (как уже указывалось, она занимает два координационных места). При наличии в октаэдрическом комплексе двух молекул этилендиамина возможны два варианта структуры,
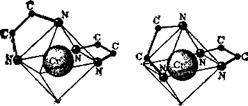
эти формы относятся друг кдругу, как предмет к своему зеркальному изображению.
Как и изомеры органических соединений, зеркальные изомеры комплексов имеют совершенно одинаковые химические и физические свойства. Они различаются лишь асимметрией кристаллов и в различных направлениях вращают плоскость поляризации света.
Описание комплексных соединений с позиций теории валентных связей
Теория строения комплексных соединений возникла из попыток ответить на вопрос, почему многие устойчивые молекулы способны присоединяться к комплексообразователю.
Для объяснения образования и свойств комплексных соединений в настоящее время например применяют теорию валентных связей. Образование комплексов теория валентных связей относит за счет донорно-акцепторного взаимодействия комплексообразователя и лигандов. Так, образование тетраэдрического иона [BeF4]2- можно объяснить следующим образом.

Ион Ве2+, имеющий свободные 2s- и 2р-орбитали, является акцептором четырех электронных пар, предоставляемых фторид-ионами:
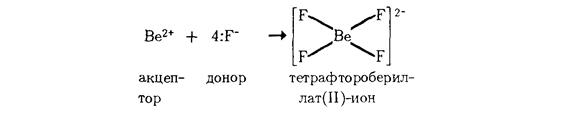
Тетраэдрическое строение комплексного иона [BeF4]2- обусловлено «sр3-гибридизацией валентных орбиталей бериллия.
Таким же образом можно показать, что при взаимодействии иона Сг3+

с молекулами воды образуется октаэдрический комплексный ион [Сг(ОН2)6]3+:

Октаэдрическое строение этого иона определяется d2sp3-гибридизацией орбиталей хрома.
Октаэдрические комплексы образуются также при взаимодействии иона Сr3+ с фторид-, гидроксид- и другими лигандами:

О роли в природе
Комплексные соединения широко распространены в природе, играют важную роль в биологических процессах. Достаточно упомянуть хелатные комплексы – гемоглобин крови (комплексообразователь Fe2+) и хлорофилл зеленых растений (комплексообразователь Mg2+). Комплексные соединения находят самое разнообразное практическое применение. Так, образование хелатных комплексов используется при умягчении жесткой воды и растворении камней в почках; важнейшую роль играют комплексные соединения в аналитической практике, производстве металлов и т.д.
Водородная связь
Атом водорода способен соединяться с сильно электроотрицательным элементом, образовывая при этом дополнительную водородную связь, правда, значительно менее прочную, чем обычная валентная связь. Способность атома водорода связывать в ряде случаев два атома впервые была установлена в 80-х годах прошлого столетия М.А. Ильинским и Н.Н. Бекетовым. Хотя энергия водородной связи мала (8-40 кДж/моль), эту связь следует считать разновидностью ковалентной, так как она обладает свойствами направленности и насыщаемости.
Механизм образования водородной связи в значительной степени сводится к донорно-акцепторному взаимодействию (донор электронной пары – атом электроотрицательного элемента, акцептор – протон).
Одним из признаков водородной связи может служить расстояние между атомом водорода и другим атомом, ее образующим. Оно должно быть меньше, чем сумма радиусов этих атомов. Чаще встречаются несимметричные водородные связи, в которых расстояние Н ... В больше, чем А−В. Однако в редких случаях (фтороводород, некоторые карбоновые кислоты) водородная связь является симметричной. Угол между атомами во фрагменте А−Н ... В обычно близок к 180o.
Водородная связь проявляется тем сильнее, чем больше электроотрицательность атома-партнера и чем меньше его размеры.

Она характерна прежде всего для соединения фтора, а также кислорода, в меньшей степени азота, в еще меньшей степени для хлора и серы. Соответственно меняется энергия водородной связи. Так энергия водородной связи H···F (эту связь обозначают точками) составляет примерно 40, связи H···О примерно 20, H···N примерно 8 кДж. Соседство электроотрицательных атомов может активировать образование водородной связи у атомов СH-групп (хотя электроотрицательность углерода и водорода практически одинаковы). Этим объясняется возникновение водородных связей между молекулами в жидких HCN, CF3H и т.д.
Процесс образования водородной связи при взаимодействии двух молекул HF выглядит:

Здесь пунктиром обозначена водородная связь, а знаки «+» и «-» относятся к эффективным зарядам атомов.
Водородная связь слабее, чем связь в ковалентных и ионных кристаллах, но сильнее, чем межмолекулярное взаимодействие в молекулярных кристаллах, состоящих из неполярных и малополярных молекул.
По своим свойствам водородная связь насыщенна и направлена. Первое свойство (насыщенность) объясняется способностью атома водорода образовывать с атомом электроотрицательного элемента лишь одну водородную связь. Во втором свойстве (направленность) водородная связь носит преимущественно электростатический характер (обязательно направлена к атому водорода). Вследствие этого второе свойство оказывает сильное влияние на структуру многочисленных веществ в различных агрегатных состояниях. Благодаря водородным связям молекулы объединяются в димеры и более сложные ассоциаты. Последние могут иметь линейное, разветвленное или кольцевое строение. Например, муравьиная кислота, как в жидкой, так и в газообразной фазе существует главным образом в виде димера; его структура установлена методом электронографии.

В парах фтористого водорода находятся полимерные молекулы (HF)n. При температуре кипения HF среднее значение n близко к 4. Способность к ассоциации отличает воду, аммиак, спирты и многие другие жидкости от неассоциированных жидкостей. Ассоциация приводит к повышению температуры плавления, температуры кипения и теплоты парообразования, изменению растворяющей способности и т.д.
Наиболе удобным индикатором водородной связи является температура кипения спиртов ROH больше, чем соответствующих меркаптанов RSH. Простые эфиры даже с большой молекулярной массой более летучи, чем спирты, так как в отличие от спиртов, в эфирах все атомы водорода связаны с углеродом и не способны образовывать водородные связи. Если бы вода не была ассоциированной жидкостью, то она имела бы температуру плавления около 100°С и температуру кипения 80°С.
В рядах сходных соединений температуры кипения и теплоты парообразования обычно увеличиваются с ростом молекулярной массы. Однако при переходе от HF к HCl и от H2O к H2S температура кипения и теплота парообразования, наоборот значительно уменьшаются. Это объясняется тем, что молекулам HF и между молекулами H2O образуются сильные водородные связи.
Благодаря водородным связям фтористоводородная кислота, в отличие от ее аналогов HCl, HBr, HI, е является сильной кислотой и образует соли типа NaHF2, KHF2, в которых имеется ион (FHF)-, энергия водородной связи F-H···F- равна 113 кДж/моль.
Все рассмотренные примеры относились к межмолекулярной водородной связи. Нередко водородная связь объединяет части одной и той же молекулы, т.е. является внутримолекулярной. Это характерно для многих органическихвеществ. Обычно атом водорода во внутримолекулярной водородной связи входит в плоское пяти- или шестичленное кольцо. Примеры образования внутримолекулярной водородной связи:

Примеры расстановки заряда:


Если у о-нитрофенола водородная связь водородная связь внутримолекулярная, то у п-нитрофенола она межмолекулярная, так как в последнем веществе водород удален от кислорода нитрогруппы.
Степень диссоциации 2,6-диоксибензойной кислоты в водном растворе при 25°С приблизительно в 70 раз больше, чем у 3,5-диоксибензойной.

Это объясняется тем, что в последней внутримолекулярная водородная связь практически не проявляется, что услиливает связь O-H в карбоксильной группе.
Молекула о-этинилфенола интересна тем, что в ней водородная связь образуется за счет π-электронов тройной связи.
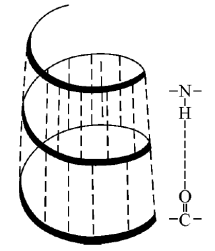
Важное значение в жизнедеятельности (синтез белков, передача генетической информации при делении клеток от исходных к новым) имеет дезоксирибонуклеиновая кислота (ДНК). Она представляет собой полимер нуклеиновых кислот, построенный из двух спиралевидных цепей, связанных водородными связями. В результате образуется двойная спираль строго опреленного состава.


Возникновение внутримолекулярных водородных связей серьезно сказывается на строении многих полимеров. Например, ее образованию обязана спиральная структура полимерных молекул белков. В белках – это водородные связи

между отдельными витками спирали. При нагревании белка водородные связи рвутся и полипептидная цепь раскручивается, теряя упорядоченное строение. Белок денатурирует, превращаясь в нерастворимый коагулянт.
Водородная связь также играет важную роль в процессах растворения, поскольку растворимость зависит и от способности соединения давать водородные связи с растворителем. В результате содержащие ОН-группы такие вещества, как сахар, глюкоза, спирты, карбоновые кислоты, как правило, хорошо растворимы в воде.
Важную роль водородная связь играет в структуре жидкой воды и льда. Молекула воды может образовывать четыре водородные связи, так как она имеет два атома водорода и две несвязывающие электронные пары.

При этом образуется разветвленная полимерная структура.Эта координация сохраняется и в трехмерной структуре льда, в которой каждый атом кислорода полярной молекулы воды тетраэдричски окружен 4 атомами водорода. Эта способность молекулы воды обуславливает строение воды и льда.
Наиболее удобным индикатором существования межмолекулярной водородной связи является температура кипения вещества. Более высокая температура кипения воды (100oC по сравнению с водородными соединениями элементов подгруппы кислорода (H2S, H2Se, H2Te) объясняется наличием водородных связей: на разрушение межмолекулярных водородных связей в воде необходимо затратить дополнительную энергию.
Сильные водородные связи между молекулами воды препятствуют ее плавлению и испарению.
Водородные связи являются причиной и другого уникального свойства воды - при плавлении ее плотность возрастает. В структуре льда каждый атом кислорода связан через атомы водорода с четырьмя другими атомами кислорода - из других молекул воды. В результате образуется очень рыхлая "ажурная" структура. Вот почему лед такой легкий.
При плавлении льда около 10% водородных связей разрушается, и молекулы воды немного сближаются. Поэтому плотность жидкой воды при температуре плавления выше, чем плотность льда. Дальнейшее нагревание, с одной стороны, должно вызывать увеличение объема воды. Это происходит со всеми веществами.
Но, с другой стороны, водородные связи продолжают разрушаться, а это должно приводить к уменьшению объема воды. В результате плотность воды изменяется неравномерно. Наибольшее значение (1,00 г/мл) она имеет при температуре 4 oС. Такова зимняя температура вблизи дна пресноводных водоемов, где скапливается вода с максимальной плотностью.
При замерзании вода расширяется и занимает больший объем. Плотность льда (0,92 г/мл) - меньше, чем плотность жидкой воды. Поэтому лед плавает на поверхности воды. Если бы у льда была более высокая плотность, по мере замерзания он опускался бы на дно, что сделало бы жизнь в водоемах зимой невозможной.