I. Эту тему можно бы было назвать: «Основы коллоидной химии». Что изучает коллоидная химия? Во многих странах ее называют «химия поверхностей», т.е. она изучает процессы, происходящие в гетерогенных системах на границе раздела фаз. К таким процессам относятся адсорбция, адгезия и когезия, электрофорез, капиллярные явления и т.д. Все поверхностные явления определяются величиной поверхностной энергии. Что же это за энергия?
Рассмотрим систему, которая состоит из жидкости и газа. Свойства молекул в поверхностном слое и в объеме системы сильно отличаются между собой. Молекулы, находящиеся внутри жидкости, испытывают одинаковое воздействие со всех сторон, в результате равнодействующая этих сил равна нулю. Молекулы, которые находятся на границе раздела, испытывают неодинаковое притяжение со стороны жидкой и газообразной фазы. Поэтому они обладают особой энергией – поверхностной. Эта энергия будет направлена внутрь жидкой фазы, перпендикулярно ее поверхности. Т.е. на каждую молекулу на поверхности жидкость/газ действует сила, направленная внутрь жидкой фазы, частица стремится уйти с поверхности в середину фазы, и поверхность жидкости всегда стремится сократиться. Наименьшую площадь поверхности (при одинаковом объеме) имеет сфера. Поэтому в невесомости любое жидкое тело принимает форму сферы. Но на Земле на тела действует сила тяжести и молекулы жидкости не могут не считаться с ней, капля имеет неправильную форму. Такие процессы протекают и на поверхности твердого тела, но она не может изменить свою форму из-за большой силы взаимодействия между частицами вещества в кристаллической решетке.
Итак, всякая поверхность обладает поверхностной энергией. Для гетерогенной системы общая энергия системы будет определяться не только величиной тепловой, электрической и т.д. энергий, но и величиной поверхностной энергии.
Различные физические и химические явления, происходящие на поверхности раздела фаз, сопровождаются превращением поверхностной энергии в другую. Например, вы надуваете мыльный пузырь, и работа, затрачиваемая на образование поверхности раздела, превращается в поверхностную энергию.
Величину поверхностной энергии определяют формулой 
Это значит, что величина поверхностной энергии зависит от площади поверхности (т.е. от того, сколько частиц находится на границе раздела и испытывают тот «дискомфорт», о котором мы говорили). Коэффициент пропорциональности -  (сигма) - это удельная поверхностная энергия, потому что
(сигма) - это удельная поверхностная энергия, потому что  =
=  , т.е. поверхностная энергия единицы площади. Измеряется она в Н/м. Она зависит от природы веществ, которые образовали границу раздела, т.е. от того, с какой силой частицу «тянут в разные стороны» и температуры. Максимальное значение удельная поверхностная энергия имеет при контакте вещества с воздухом (или любым другим газом), т.е. когда на частицу действуют силы притяжения только, с одной стороны. Значение удельной поверхностной энергии чистой жидкости, измеренной при определенной температуре, называют поверхностным натяжением. Чем сильнее взаимодействуют частицы жидкости между собой, тем больше поверхностное натяжение. Например: бензол (неполярная жидкость) – 29 кН/м, вода (полярные молекулы) – 73 кН/м, а у ртути (металлическая связь) – 473·10-3. У растворов величина поверхностного натяжения на границе раздела фаз зависит от природы растворенных веществ, их концентрации и др. факторов. Для твердых тел удельная поверхностная энергия значительно больше, чем у жидкостей, но она не поддается непосредственному измерению и рассчитать ее тоже очень сложно.
, т.е. поверхностная энергия единицы площади. Измеряется она в Н/м. Она зависит от природы веществ, которые образовали границу раздела, т.е. от того, с какой силой частицу «тянут в разные стороны» и температуры. Максимальное значение удельная поверхностная энергия имеет при контакте вещества с воздухом (или любым другим газом), т.е. когда на частицу действуют силы притяжения только, с одной стороны. Значение удельной поверхностной энергии чистой жидкости, измеренной при определенной температуре, называют поверхностным натяжением. Чем сильнее взаимодействуют частицы жидкости между собой, тем больше поверхностное натяжение. Например: бензол (неполярная жидкость) – 29 кН/м, вода (полярные молекулы) – 73 кН/м, а у ртути (металлическая связь) – 473·10-3. У растворов величина поверхностного натяжения на границе раздела фаз зависит от природы растворенных веществ, их концентрации и др. факторов. Для твердых тел удельная поверхностная энергия значительно больше, чем у жидкостей, но она не поддается непосредственному измерению и рассчитать ее тоже очень сложно.
Согласно законам термодинамики, любая система стремится иметь минимальную энергию, а значит и минимальную поверхностную энергию. Уменьшение свободной поверхностной энергии может происходить или за счет сокращения поверхности, или за счет уменьшения поверхностного натяжения.
Для чистых веществ возможен только первый вариант, поэтому такие гетерогенные системы термодинамически неустойчивы, в них самопроизвольно протекают процессы, в которых площадь  границы раздела фаз уменьшается за счет слияния маленьких частиц в крупные. Именно по этой причине туман, эмульсии, насыщенные растворы с мелкими кристаллами и т.п. – системы неустойчивые, мелкие капли стремятся слиться друг с другом и т.д.
границы раздела фаз уменьшается за счет слияния маленьких частиц в крупные. Именно по этой причине туман, эмульсии, насыщенные растворы с мелкими кристаллами и т.п. – системы неустойчивые, мелкие капли стремятся слиться друг с другом и т.д.
В растворах уменьшение поверхностной энергии может происходить не только за счет уменьшения площади, но и за счет уменьшения поверхностного натяжения. Это уменьшение поверхностного натяжения на поверхности растворов может происходить за счет адсорбции. Адсорбция – самопроизвольный процесс перехода растворенного вещества из объема фазы на границу раздела и увеличение концентрации растворенного вещества на границе раздела фаз. Вещества, адсорбция которых уменьшает поверхностное натяжение, называются поверхностно-активными (ПАВ). Вещества, которые не изменяют или увеличивают поверхностное натяжение, называются поверхностно-инактивными.
Равновесие в растворе ПАВ определяется двумя процессами: тепловым движением частиц, стремящимся восстановить равенство концентрации по всему объему раствора и стремлением молекул ПАВ оказаться на границе раздела фаз. Зависимость поверхностного натяжения растворов от концентрации веществ описывается кривой σ = f(c). Если кривая поверхностного натяжения идет вниз – это ПАВ. Чем круче падает кривая, тем большей поверхностной активностью обладает ПАВ.
Характерной особенностью строения ПАВ является дифильность молекулы. Молекулы ПАВ состоят из двух частей – полярной группы (-ОН, NH2-, -СООН и т.д.) и неполярного углеводородного радикала. Изображаются ПАВ обычно в виде «головастика», где «хвостик» - углеводородный радикал, а кружочек – полярная группа. 
Полярная группа хорошо взаимодействует с водой, она и обусловливает гидрофильность молекулы ПАВ, т.е. ее способность к растворению в воде. У неполярного радикала сродство к неполярной фазе. Это может быть и воздух, и неполярная жидкость, и неполярное твердое вещество. Молекула, которая имеет дифильное строение, стремиться находиться на границе раздела фаз, т.е. так чтобы полярная часть молекулы была в полярной фазе, а неполярная часть молекулы – в неполярной фазе. Поэтому молекулы ПАВ выталкиваются из объема раствора на границу раздела фаз, происходит процесс адсорбции. Поверхностная активность ПАВ (стремление ПАВ взаимодействовать с этой неполярной фазой) сильно зависит от длины углеводородного радикала (поверхностная активность ПАВ с увеличением углеродного радикала на группу СН2 повышается в 2-4 раза).
Электролиты взаимодействуют с молекулами воды хорошо, поэтому в результате диффузии они уходят в глубь раствора, адсорбция не происходит. Такие вещества называются инактивными.

Рассмотрим кривую зависимости величины адсорбции от концентрации ПАВ в растворе. Обратите внимание: при малых концентрациях ПАВ адсорбция прямо пропорциональна С, а при высоких достигает предельного значения и дальше не меняется. Для всех веществ одного гомологического ряда органических веществ Г
 - величина постоянная, это означает, что на 1 см2 площади поверхностного слоя помещается одно и то же число молекул, независимо от длины радикала, значит молекулы не «лежат», а «стоят» на границе раздела фаз. Ленгмюр назвал этот феномен «принцип независимости поверхностного действия», т.е. при адсорбции дифильных молекул полярные группы втягиваются в воду (полярную фазу), а неполярные выталкиваются в неполярную фазу. При малых концентрациях ориентация молекул произвольна, а при высокой – молекулы приобретают вертикальное положение, и поверхность воды оказывается сплошь покрытой мономолекулярным слоем ПАВ - частокол Ленгмюра.
- величина постоянная, это означает, что на 1 см2 площади поверхностного слоя помещается одно и то же число молекул, независимо от длины радикала, значит молекулы не «лежат», а «стоят» на границе раздела фаз. Ленгмюр назвал этот феномен «принцип независимости поверхностного действия», т.е. при адсорбции дифильных молекул полярные группы втягиваются в воду (полярную фазу), а неполярные выталкиваются в неполярную фазу. При малых концентрациях ориентация молекул произвольна, а при высокой – молекулы приобретают вертикальное положение, и поверхность воды оказывается сплошь покрытой мономолекулярным слоем ПАВ - частокол Ленгмюра.
Процесс адсорбции находится в динамическом равновесии с процессом десорбции. Процесс адсорбции экзотермический, при повышении температуры ускоряется обратный процесс –  десорбция.
десорбция.
 А как ведут себя молекулы ПАВ, которые не поместились на поверхности? Молекулы ПАВ поворачиваются друг к другу неполярными радикалами и образуют так называемые мицеллы. Мицеллы - это крупные частицы, состоящие из множества молекул ПАВ, ориентированных определенным образом. В водных растворах на поверхности мицеллы находятся полярные группы с большим сродством к воде. В результате растворимость ПАВ значительно увеличивается. Только это уже не идеальные растворы, а коллоидные. Интересно, что в лиофобной (неполярной) части этих мицелл могут растворяться неполярные вещества, которые в воде вообще не растворяются. Этот процесс называется солюбилизация.
А как ведут себя молекулы ПАВ, которые не поместились на поверхности? Молекулы ПАВ поворачиваются друг к другу неполярными радикалами и образуют так называемые мицеллы. Мицеллы - это крупные частицы, состоящие из множества молекул ПАВ, ориентированных определенным образом. В водных растворах на поверхности мицеллы находятся полярные группы с большим сродством к воде. В результате растворимость ПАВ значительно увеличивается. Только это уже не идеальные растворы, а коллоидные. Интересно, что в лиофобной (неполярной) части этих мицелл могут растворяться неполярные вещества, которые в воде вообще не растворяются. Этот процесс называется солюбилизация.
К ПАВ относятся: карбоновые кислоты и их соли, сульфокислоты, высшие спирты, белки и т.д. Многие органических веществ, входящих в состав живого организма, относятся к ПАВ. Они принимают участие во многих физиологических процессах. Например, на усвоение жира влияют соли желчных кислот, потому что они способствуют эмульгации жира, а в виде эмульсии жир усваивается лучше. ПАВ широко используются в фармакологии при изготовлении свечей, мазей, для стабилизации эмульсий, суспензий и в качестве солюбилизаторов. Солюбилизаторы используют при изготовлении водных препаратов жирорастворимых витаминов, гормонов и т.д. Принцип независимости поверхностного действия лежит в основе представления о биологических мембранах. В мембране имеются два слоя молекул фосфолипидов, которые гидрофильными концами направлены наружу, а гидрофобными «хвостиками» к центру мембран. На полярных группах фосфолипидов адсорбированы слои белков. Адсорбированные молекулы белков развертываются и становятся объектами ферментной атаки. Скорость реакции при этом увеличивается на несколько порядков. Продукты реакции вытесняются из пленки, уступая место новым белкам. Знание свойств ПАВ помогает изучению процессов, проходящих в организме и синтезе лекарственных препаратов. ПАВы широко используются в фармакологии для приготовления эмульсий, суспензий, они обязательно входят в состав моющих и дезинфицирующих средств.
Среди процессов, происходящих на поверхности раздела фаз сорбционные явления имеют особое значение. Сорбция – это способность вещества поглощать (концентрировать) другое вещество. Если сорбция происходит лишь в поверхностном слое – она называется а д сорбцией. Именно о такой сорбции мы и говорили выше. Если сорбция идет по всему объему (а это часто бывает, когда процесс идет на поверхности жидкости) – то она называется а б сорбцией. То вещество, на поверхности которого происходит процесс адсорбции, называется адсорбентом (сорбентом). Вещество, которое адсорбируется называется – адсорбтивом. Если в процессе адсорбции образуются новые соединения, то процесс называется хемосорбцией. Но граница между адсорбцией и хемосорбцией весьма условна.
Адсорбция на твердом адсорбенте протекает лучше, чем на поверхности жидкости, потому что там больше удельная поверхностная энергия. Характер адсорбционных явлений на поверхности твердого тела тоже немного отличается. Например, адсорбция происходит не равномерно по всей поверхности, а на активных центрах (участки поверхности твердого вещества с повышенной энергией). Но нельзя непосредственно измерить удельную поверхностную энергию твердого тела и нельзя точно определить площадь поверхноститвердого вещества. Поэтому адсорбцию на твердых веществах выражают в молях адсорбтива на единицу массы адсорбента, а не на единицу площади поверхности, т.е. 
Адсорбция газов на твердом веществе существенно зависит от температуры. Чем выше температура, тем меньше величина адсорбции, и участок плато на изотерме адсорбции будет находиться ниже.
Если адсорбция происходит на границе твердое тело – раствор, то она осложнена наличием растворителя, который взаимодействует с растворенным веществом и тоже может адсорбироваться. Различают два вида адсорбции из раствора: молекулярную (неэлектролитов или слабых  электролитов) и ионную (сильные электролиты).
электролитов) и ионную (сильные электролиты).
Молекулярная адсорбция. Большое влияние на молекулярную адсорбцию оказывает взаимодействие растворителя и адсорбента. Различают гидрофильные поверхности твердых адсорбентов (взаимодействуют с растворителем, т.е. смачиваются водой: силикагели, глины) и гидрофобные (не смачиваются: уголь, тальк, парафин). П.А.Ребиндер сформулировал правило выравнивания полярности фаз: растворенное вещество тем лучше адсорбируется, чем больше разность полярностей между адсорбентом и растворителем. Т.е. чтобы ПАВ адсорбировалось хорошо, надо чтобы твердый адсорбент и раствор были разными по природе и на границе раздела была бы значительная удельная поверхностная энергия. Тогда дифильным молекулам есть смысл стремиться на границу раздела. Естественно, что при адсорбции молекулы ПАВ на границе фаз будут ориентироваться определенным образом (см. принцип независимости поверхностного действия Ленгмюра), т.е. дифильные молекулы будут адсорбироваться так, чтобы полярная часть была обращена к полярой фазе, а неполярная к неполярной. Поверхность твердой фазы становится по полярности такой же, как и жидкая, они «выравниваются». Отсюда следует, что ПАВ из водных растворов должны адсорбироваться на гидрофобных поверхностях, а ПАВ растворенные в неполярных растворителях адсорбируются на гидрофильных адсорбентах. Если же для водного раствора взять гидрофильный адсорбент, то адсорбироваться будет вода, а не растворенное вещество. Например: для очистки спирта от сивушных масел используют уголь, а для очистки нефти от электролитов – силикагель. Величина поверхностной энергии на границе адсорбент –раствор зависит не только от природы адсорбента и раствора, но и от площади поверхности, т.е. пористости и степени измельченности адсорбента. Такие адсорбенты имеют удельную поверхность порядка сотен квадратных метров на 1 г. Пористые адсорбенты применяют в виде гранул или таблеток. В качестве пористых адсорбентов наиболее часто применяются активированный уголь, силикагель, природные силикаты (глины), алюмогель, алюмосиликаты.
Кроме этого надо учитывать, что адсорбция очень сильно зависит от природы вещества-адсорбтива (дифильные молекулы (ПАВ) адсорбируются лучше, чем неполярные молекулы) и величина адсорбции возрастает с увеличением молекулярной массы вещества.

 Обычный древесный уголь обычно имеет небольшую адсорбционную способность, т.к. его удельная поверхность сравнительно невелика, Активирование угля заключается в его термической обработке перегретым водяным паром, в результате которой удельная поверхность угля резко увеличивается, т.к. продукты неполного сгорания (смолы) улетучиваются, остается твердое тело, все пронизанное мельчайшими порами. Активированный уголь как адсорбент применяется для очистки растворителей, воздуха, воды. В медицинской практике его назначают при отравлениях, для поглощения избытка газов в кишечнике, используют в гемодиализе.
Обычный древесный уголь обычно имеет небольшую адсорбционную способность, т.к. его удельная поверхность сравнительно невелика, Активирование угля заключается в его термической обработке перегретым водяным паром, в результате которой удельная поверхность угля резко увеличивается, т.к. продукты неполного сгорания (смолы) улетучиваются, остается твердое тело, все пронизанное мельчайшими порами. Активированный уголь как адсорбент применяется для очистки растворителей, воздуха, воды. В медицинской практике его назначают при отравлениях, для поглощения избытка газов в кишечнике, используют в гемодиализе.
Силикагель – гидратированный оксид кремния, приготовленный в виде пористого тела или порошка. Силикагель отличается от угля меньшей адсорбционной способностью при низком давлении и способностью избирательно поглощать пары воды. Поэтому его обычно применяют для осушки газов. Широко силикагели применяются в виде т.н. молекулярных сит. Они пропускают и задерживают в себе малые молекулы, а большие молекулы в рыхлую структуру такого молекулярного сита проникнуть не могут. На этом основано использование силикагелей для разделения смесей газов и жидких веществ.
Сильные электролиты в растворах полностью диссоциированы на заряженные частички – ионы, поэтому при ионной адсорбции надо учитывать не только адсорбционные, но и электростатические силы. Адсорбция ионов носит обменный характер. Обменный характер ионной адсорбции заключается в том, что, поглощая из раствора какие-то ионы, адсорбент отдает в раствор эквивалентное количество других ионов, потому что заряд раствора и адсорбента при адсорбции меняться не может. Неорганические и органические материалы, способные к обмену ионами с раствором,  получили название ионитов. Их делят на катиониты и аниониты. Иониты выпускают в виде зернистых порошков, волокон и мембран. Иониты не растворимы в воде, но в их состав входят группы атомов, несущие заряд (они называются потенциалопределяющими). С этими группами связаны электростатическими силами ионы противоположного знака, которые способны к обмену на другие ионы. Ионообменный процесс обратим.
получили название ионитов. Их делят на катиониты и аниониты. Иониты выпускают в виде зернистых порошков, волокон и мембран. Иониты не растворимы в воде, но в их состав входят группы атомов, несущие заряд (они называются потенциалопределяющими). С этими группами связаны электростатическими силами ионы противоположного знака, которые способны к обмену на другие ионы. Ионообменный процесс обратим.
R-H + NaCl  R-Na + HCl
R-Na + HCl
 Ионный обмен между раствором и адсорбентом носит избирательный характер, т.е. сильно зависит от природы адсорбента и адсорбируемых ионов. В чем-то этот процесс похож на реакции ионного обмена, но протекает исключительно на поверхности адсорбента.
Ионный обмен между раствором и адсорбентом носит избирательный характер, т.е. сильно зависит от природы адсорбента и адсорбируемых ионов. В чем-то этот процесс похож на реакции ионного обмена, но протекает исключительно на поверхности адсорбента.
Правило избирательной адсорбции: на поверхности твердого вещества преимущественно адсорбируются ионы способные достраивать его кристаллическую решетку (т.е. имеющиеся в составе решетки либо изоморфные им).
Например: в системе AgNO3+ KI = AgI↓ +KNO3 на кристаллах осадка AgI будут адсорбироваться из раствора в первую очередь ионы Ag+ и I-
Адсорбция увеличивается с увеличением заряда и радиуса иона, и уменьшается при увеличении гидратации иона. Например адсорбционная способность уменьшается в рядах: Ti4+> Fe3+> Ca2+> K+ и Ba2+> Sr2+> Ca2+> Mg2+
Понятие адсорбции тесно связано с понятиями когезии и адгезии. Когезия - это сцепление однородных частиц вещества под действием сил притяжения. Это силы межмолекулярного взаимодействия или химической связи. Они определяют совокупность таких свойств вещества как агрегатное состояние, летучесть, растворимость, твердость, механические свойства и т. д. Интенсивность межмолекулярного и межатомного взаимодействия (а, следовательно, силы когезии) резко убывает с расстоянием. Наиболее сильна когезия в твердых телах и жидкостях, то есть в конденсированных фазах, где расстояние между частицами малы. В газах средние расстояния между молекулами велики по сравнению с их размерами, и поэтому когезия в них незначительна.
Адгезия (от лат. adhaesio — прилипание) — сцепление разнородных твёрдых или жидких частиц. Адгезия обусловлена межмолекулярным взаимодействием, иногда — образованием химических связей или взаимной диффузией в поверхностном слое и характеризуется удельной работой, необходимой для разделения поверхностей. В некоторых случаях адгезия может оказаться сильнее, чем когезия, то есть сцепление частиц внутри одной фазы. В таких случаях происходит когезионный разрыв, то есть разрыв в объёме менее прочного из соприкасающихся материалов.
Адгезия существенно влияет на природу трения соприкасающихся поверхностей: так, при взаимодействии поверхностей с низкой адгезией трение минимально. В качестве примера можно привести тефлон, который в силу низкого значения адгезии обладает низким коэффициентом трения. Некоторые вещества со слоистой кристаллической решёткой (графит), характеризующиеся одновременно низкими значениями адгезии и когезии, применяются в качестве твёрдых смазок. Наиболее известные адгезионные эффекты: смачиваемость/несмачиваемость поверхности тела, поверхностное натяжение жидкости, форма мениска жидкости в узком капилляре, трение покоя двух абсолютно гладких поверхностей. Адгезия имеет место в процессах склеивания, пайки, сварки, нанесения покрытий. Адгезия матрицы и наполнителя пластмасс и композитов является также одним из важнейших факторов, влияющих на их прочность. В биологии клеточная адгезия — не просто соединение клеток между собой, а такое их соединение, которое приводит к формированию определённых типов ткани. Специфичность клеточной адгезии определяется наличием на поверхности клеток специальных белков клеточной адгезии — интегринов, кадгеринов и др.
Ионный обмен играет важную роль при переносе различных веществ через биологические мембраны,т.к. белки при определенных условиях проявляют различную селективность к ионам натрия, калия, кальция, хлора…Различные ткани живых организмов обладают катионообменными свойствами в физиологическом интервале рН. Переход к анионообменному механизму происходит в слабокислой среде. За катионообменные свойства биоструктур отвечает в основном карбоксильные и фосфатные группы белков, за анионообменные – аминогруппы белков. Например, известно, что ферменты работают при определенном значении рН. Это связано в частности и с тем, что содержащиеся в активном центре фермента катионы металлов могут обмениваться при определенных условиях на ионы водорода и фермент теряет свою биологическую активность.
Сорбционные процессы и различные адсорбенты часто применяются в разных областях человеческой деятельности. Например, ионную адсорбцию применяют для снижения жесткости и очистки питьевых, технических и сточных вод. В качестве адсорбента для этого можно использовать природные силикаты (глина) или синтетические полимеры (ионообменные смолы). Иониты, как и другие адсорбенты, могут подвергаться регенерации (при повышении температуры или использовании соответствующих растворов), поэтому их использование экономически выгодно. Широко используются ионообменные смолы в биологии, медицине, фармакологии для получения и очистки лекарств и БАВ, для анализа биологических жидкостей.Например:для декальцинирования крови перед консервацией; для пролонгации некоторых лекарственных соединений, при анализе растворов с помощью стеклянных электродов. Пролонгация – сохранение в течении длительного времени определенной концентрации веществ в жидких средах организма. В основе действия пролонгаторов лежит присоединение лекарственного вещества к матрице полимера по ионообменному механизму. Стеклянные электроды, которые широко используются для определения концентрации ионов, изготовлены из специального стекла, обладающего свойствами ионообменных смол. Их структуру составляет силикатный каркас и электростатически связанные с ним катионы, способные к обмену на ионы водорода из раствора (или других ионов и молекул).
В медицинской практике широко используются методы лечения, в основе которых лежат сорбционные процессы. Например,одним из наиболее широко встречающихся методов лекарственной терапии является аппликационное применение лекарственных препаратов, что обусловлено простотой и безболезненностью процедур (примочки, компрессы, тампоны, повязки и т.д. с лекарственными веществами, антисептиками и обезболивающими). При аппликационном применении предполагается создание терапевтической концентрации препарата в тканях в месте нанесения, при этом в общий кровоток поступает лишь незначительное количество вещества, что позволяет практически избежать системных побочных эффектов. Лекарственный препарат сорбируется в мягкие ткани сквозь выводные протоки потовых и сальных желез, волосяные фолликулы, межклеточные пространства.
Среди современных методов лечения видно место занимает эфферентная терапия (от латинского efferens — выводить), направленная на выведение из организма токсических и метаболитов. Она осуществляется главным образом с помощью медико-технических систем. С этой целью через слой адсорбента пропускают кровь, плазму или другую жидкость. Чаще всего это кровь, поэтому гемосорбция – важнейший метод очистки крови от токсических веществ и продуктов метаболизма. Для гемосорбции применяются активированные угли и ионнообменные смолы. Основные показания для проведения гемосорбции — тяжелые генерализованные формы инфекционных заболеваний; тяжелые токсикозы хирургического и терапевтического генеза. Недостаток гемосорбции – непосредственный контакт клеток крови с адсорбентом, в результате которого эти клетки могут травмироваться. Поэтому адсорбент обычно заключают в полупроницаемую мембрану (сочетание гемодиализа и гемосорбции). Существует также иммуносорбция - это один из наиболее современных и перспективных вариантов удаления из крови патологических молекул, при котором связывают и извлекают из крови определенные антитела или антигены с помощью иммуносорбентов.
К неинвазивным сорбционным методам относят методы детоксикации и метаболической и иммунологической коррекции, в процессе проведения которых не осуществляется прямой контакт сорбента с кровью.Большое практическое применение нашла энтеросорбция, колоносорбция и вульнеросорбция. Энтеросорбция чаще реализуется путем приема препаратов per os, реже — через зонды. Первый путь приема препарата предпочтителен при большинстве заболеваний, когда больной в состоянии осуществлять глотательный акт и нет опасности длительной задержки сорбента из-за динамической или механической непроходимости желудочно-кишечного тракта. Второй способ предусматривает введение зонда в желудок или тонкую кишку с фракционным введением и выведением сорбента. Т.е. энтеросорбция основана на связывании и выведении из организма через ЖКТ с лечебной или профилактической целью эндогенных или экзогенных веществ. В качестве энтеросорбентов используют активированные угли медицинского назначения (карболен, карбактин и т.д.), пористые полимеры растительного и природного происхождения (полисорб, полифепан, лигносорб, пектины и др.), ионообменные материалы (холестирамин, вазозан), синтетические полимеры (энтеродез, энтеросорб). Выбор сорбентов зависит от конкретных задач терапии, способа введения, переносимости. При инфекционной патологии наиболее эффективны сорбенты, способные связывать не только токсины, но и бактериальные клетки (активированные угли и препараты на основе лигнина). Энтеросорбция может назначаться до установления диагноза. При острых инфекционных заболеваниях эффективность энтеросорбции существенно повышается в случае применения ее в первые часы (дни) болезни. По степени детоксикации энтеросорбция в течение 1—2 дней сопоставима с однократной экстракорпоральной геморрекцией. Колоносорбция осуществляется через ректальные или толстокишечные зонды, введенные во время операции или через колонострому. Вульнеросорбция – метод  выведения токсичных компонентов через раневую поверхность или очаг воспаления при перевязках.
выведения токсичных компонентов через раневую поверхность или очаг воспаления при перевязках.
Явление адсорбции лежит в основе хроматографического метода разделения, очистки и анализа веществ, который широко применяются в медицине и фармакологии. Основоположником хроматографического анализа является русский ботаник Н.С. Цвет. В 1903 году он разделил раствор хлорофилла на отдельные компоненты, пропуская его через стеклянную трубку, заполненную мелом. При этом пигменты расположились в трубке с мелом отдельными зонами в зависимости от своей адсорбционной способности. С развитием теории адсорбции и ионного обмена, а также синтеза новых адсорбентов совершенствуется техника анализа, разрабатываются и создаются различные хроматографы, но общий принцип сохраняется.
Все хроматографические системы состоят из двух фаз. Одна из них – неподвижная, она может быть твёрдой или жидкой. Вторая фаза подвижная. Она обычно пропускается через неподвижную, она может быть жидкой или газообразной.
В зависимости от метода, которым проводится разделение веществ, различают колоночную, капиллярную, тонкослойную и бумажную хроматографии.
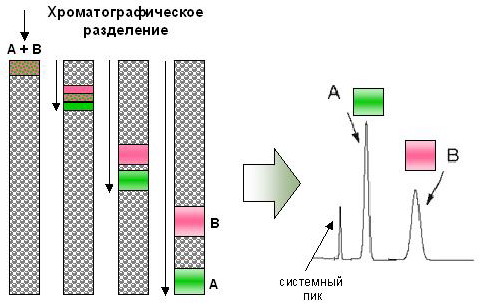 Рассмотрим самый простой колоночный вариант адсорбционной хроматографии. На адсорбент, заполняющий колону, наносят небольшой объём исследуемой жидкой смеси, которая проникает в поверхностный слой адсорбента. Затем колонку промывают соответствующим растворителем. При продвижении растворителя происходит разделение смеси на индивидуальные соединения, занимающие в колонке строго определённое положение. При дальнейшем пропускании растворителя индивидуальные соединения в виде раствора одно за другим выходят из колонки. Эту жидкость собирают отдельными порциями и определяют в них содержание анализируемых веществ.
Рассмотрим самый простой колоночный вариант адсорбционной хроматографии. На адсорбент, заполняющий колону, наносят небольшой объём исследуемой жидкой смеси, которая проникает в поверхностный слой адсорбента. Затем колонку промывают соответствующим растворителем. При продвижении растворителя происходит разделение смеси на индивидуальные соединения, занимающие в колонке строго определённое положение. При дальнейшем пропускании растворителя индивидуальные соединения в виде раствора одно за другим выходят из колонки. Эту жидкость собирают отдельными порциями и определяют в них содержание анализируемых веществ.
В биохимии и фармакологии часто применяют бумажную и тонкослойную хроматографию. В бумажной хроматографии неподвижной фазы служит фильтровальная бумага. В качестве подвижной фазы применяются различные органические растворители. Раствор исследуемой смеси наносят в виде капли на бумажную полоску. При этом на хроматограмме образуется целый ряд цветных пятен, расположенных в определённом порядке. В клинической практике метод хроматографии нашёл применение для быстрого анализа мочи и крови на содержание лекарств, продуктов метаболизма, различных белков, ферментов и гормонов. С помощью этого метода удаётся быстро и чётко разделять и идентифицировать очень малые количества веществ (10-6граммов). Особо следует выделить метод газовой хроматографии, который отличается быстротой проведения анализа и чёткостью разделения компонентов. Он используется для определения микро количеств органических веществ по продуктам их пиролиза. Сочетая метод газовой хроматографии с другими методами исследования можно определять и исследовать продукты метаболизма, изучать химический состав ткани, проводить контроль загрязненности окружающей среды. В фармацевтической промышленности хроматография помогает контролировать ход синтеза лекарственных препаратов, оценивать их чистоту, определять стабильность.
----------------------------------------------------------------------------------------------------------------------------
II. К коллоидным системам относятся гетерогенные дисперсные системы. Дисперсная, это значит, что одна из фаз этой гетерогенной системы измельчена. Дисперсность системы определяется как величина обратная размеру частицы. В истинных растворах (их обычно называют просто «растворы») размеры частиц примерно 10-10 м . Это максимальная степень дисперсности, в истинных растворах одна из фаз измельчена до молекул или ионов. Истинные растворы считаются системами гомогенными. В коллоидных системах размеры частиц сравнимы с длиной световой волны (λ= 10-7м), т.е. примерно 10-5 – 10-9 м. В таких система структурной единицей является не ион или молекула, а более крупная частица, состоящая из сотен тысяч молекул и ионов. С увеличением размеров частицы приобретают новые качества. Коллоидные системы являются гетерогенными, появляется граница раздела между фазами. Сплошная фаза называется дисперсная среда, а раздробленная – дисперсная фаза. Такие коллоидные системы термодинамически не устойчивы, потому что между частицами и средой существует очень большая по площади поверхность раздела, обладающая избытком поверхностной энергией. Для этих систем характеры самопроизвольные процессы, понижающие избыток энергии путём уменьшения степени дисперсности (объединения частиц). Можно выделить также грубодисперсные системы, в которых размеры частиц очень маленькие, не видимые невооруженным глазом, но все-таки больше чем 10-5. Они во многом похожи на коллоидные системы, но еще более неустойчивые, потому что из-за большого размера дисперсные частицы быстро отделяются от дисперсной среды.
Реальный окружающий нас мир – растения и животные, объекты не живой природы, продукты питания, строительные материалы – всё это дисперсные системы разной степени организации. Мышечные и нервные клетки, биологические жидкости, волокна, гены, вирусы – всё это коллоидные образования.
Коллоидные системы классифицируют по разным признакам.
1) По агрегатному состоянию фаз можно выделить 8 типов коллоидных систем (Оствальд):
тв/тв – минералы, сплавы, ситаллы, композиты
ж/тв – капиллярные системы, гели, жидкость в пористых телах, почва
г/тв – пенопласты, поролон, пористый шоколад, пористые адсорбенты)