Лабораторная диагностика повреждения миокарда.
Лабораторная диагностика ИМ имеет долгую историю. В 1950-х гг. был предложен первый биохимический маркер ИМ – активность аспартатаминотрансферазы (АСТ) в крови, позже – исследование активности лактатдегидрогеназы (ЛДГ), креатинкиназы (КК), ее изофермента КК-МВ.
Повышение активности МВ-фракции КК, содержащейся преимущественно в миокарде, наиболее специфично для острого инфаркта миокарда. КК-МВ не реагирует на повреждение скелетных мышц, головного мозга и щитовидной железы. При остром ИМ повышение активности КК-МВ начинается уже через 4-8 часов после приступа и достигает максимума через 12-24 часа, на третьи сутки активность этой фракции возвращается к норме. При расширении зоны ишемии миокарда, активность КК-МВ остается высокой гораздо дольше, что позволяет диагностировать ИМ в более отдаленные сроки наблюдения. Однако повышение КК-МВ фракции выявляется также и при нехирургических диагностических манипуляциях на сердце. В то же время аритмия, тахикардия и сердечная недостаточность практически не влияют на уровень КК-МВ.
Для определения активности КК-MB используется метод иммунного ингибирования специфическими антителами М-субъединицы с последующим ферментативным определением активности В-субъединицы. Однако, присутствие КK-BB, аденилатциклазы и атипичных форм креатинкиназы (макро-КK), которые нельзя нейтрализовать антителами к М-субъединице, может привести к получению завышенных результатов определения КК-MB. В настоящее время разработано большое количество иммуноферментных методов определения уровня концентрации КК-MB (нг/мл). Концентрация КК-MB, измеренная с помощью этих методов, хорошо коррелирует с активностью КK-MB. При этом удается избежать интерференции со стороны КK-BB, макро-КK и аденилатциклазы.
При дальнейшем накоплении научных и клинических данных оказалось, что ни активность, ни масса КК-МВ не выявляют всех степеней тяжести миокардиального некроза и с помощью измерения КК-МВ многие случаи ИМ оставались (и остаются) незамеченными. Дальнейшая эволюция биохимических кардиомаркеров, направленная на повышение их специфичности и чувствительности, привела к введению в клиническую практику определения в сыворотке (плазме) крови миокардиальных маркеров — тропонинов I и Т – абсолютно специфичных и высокочувствительных для ситуации с ОКС. Тропонины - структуры белковой природы, обеспечивающие сократительную функцию клеток поперечно-полосатой мускулатуры (миокард, скелетные мышцы).
Тропониновый комплекс включает три компонента:
•тропонин С - ответственный за связывание кальция
•тропонин Т - предназначен для связывания тропомиозина
•тропонин I - предназначен для ингибирования двух, указанных выше процессов
Аминокислотная последовательность кардиального и скелетного тропонина-С идентичны. Различие изоформ тропонина-I и тропонина-Т в миокарде и скелетных мышцах составляет около 40%. Благодаря этому, сердечный тропонин-I (cTnI) является высокочувствительным и высокоспецифичным маркером повреждения миокарда. Появление тропонина в плазме крови уже через 3-6 часов после повреждения сердечной мышцы объясняется тем, что около 5% тропонина-I внутри мышечных клеток находится в свободном виде в цитоплазме. Максимальная концентрация отмечается через 8-28 часов. Основное же количество тропонина-I в клетке связано с мышечными филаментами и при поражении сердечной клетки освобождается медленно, вследствие чего увеличенная концентрация тропонина в крови сохраняется в течение 1-2 недель после повреждения миокарда. Таким образом, динамика распределения выброса cTnI после инфаркта миокарда перекрывает временной диапазон значений других маркеров: креатинкиназы и ее МВ-фракции, образуя более длительное «диагностическое окно».
Концентрация тропонина I после ОИМ снижается быстрее по сравнению с тропонином Т, что делает возможным использование тропонина I при диагностике повторных (3-5 сутки) инфарктов миокарда (рис. 1).
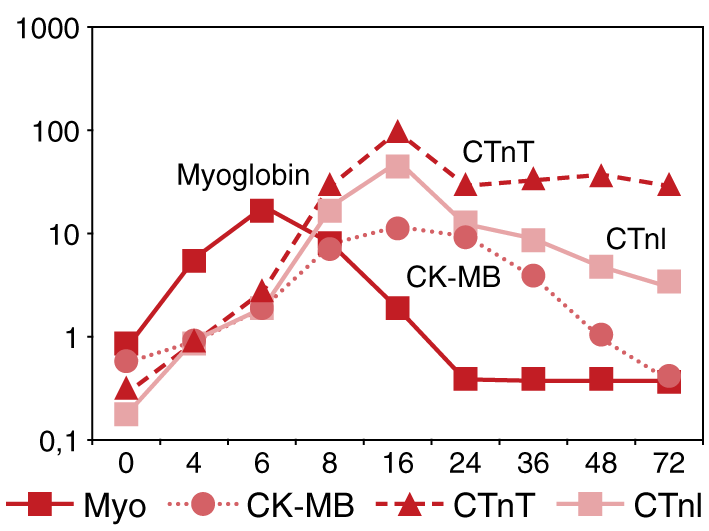
(Myo) — миоглобин, СК-МВ — креатинкиназа МВ, cTnT — тропонин Т, cTnI — тропонин I
Рис. 1. Динамика изменения концентрации кардиомаркеров при остром инфаркте миокарда (по Christenson R.H. al., 2006.).
Разработка тестов на кардиальные тропонины стала ключевым моментом в эволюции кардиомаркеров и критериев ИМ. Первые исследования показали, что повышенные циркулирующие уровни cTnT и cTnI действительно сильно связаны с повреждениями миокарда. В итоге клиницисты быстро пришли к выводу, что тропонины имеют практически 100%-ную специфичность по отношению к ИМ. Более того, оказалось, что от 12% до 39% пациентов, поступивших с подозрением на ИМ, являются «отрицательными по массе КК-МВ », но «положительными по тропонинам». Результаты многочисленных проспективных исследований показали, что «КК-МВ -отрицательные» и одновременно «cTn -положительные» пациенты имеют высокий риск неблагоприятных исходов даже в отсутствие повторных ишемических событий. Таким образом, стало очевидным, что повышенный тропонин это не только маркер ИМ, но и показатель риска будущих неблагоприятных сердечно-сосудистых событий.
В итоге, в 1999 г. американской Национальной Академией Клинической биохимии (National Academy of Clinical Biochemistry - NACB) были сформулированы рекомендации, в которых предлагалось измерять уровни тропонинов для выявления любого повреждения миокарда и устанавливались их пограничные уровни, оптимальные для диагностики острого коронарного синдрома (ОКС). В 2007 г Национальная Академия Клинической Биохимии США и Международная Федерация Клинической Химии рекомендуют пограничный уровень для cTnI, cTnT и КК-МВ (масса) для выявления повреждений миокарда, связанных с высоким риском острых коронарных событий. Этот уровень должен быть равен таковому для 99-ой процентили нормальной популяции.
Важным нововведением в документе 2007 г. было необходимое условие повышения или снижения уровней кардиомаркеров (предпочтительно тропонинов). Рекомендовано измерение тропонинов проводить при поступлении пациента, затем примерно через 6, 9, 12 и 24 ч. В тоже на этот период не было ни одного теста, чувствительность которого позволяла бы точно и надежно определять уровень тропонинов в нормальной популяции и устанавливать концентрации, характерные для 99-й процентили. Все здоровые люди были «тропонин-отрицательными». Разработка высокочувствительного метода измерения концентрации кардиальных тропонинов (hs cTn – high sensitive cardiac troponin –высокочувствительный кардиальный тропонин.) решила «проблему 99-й процентили», но, как это обычно бывает, создала новые и совершенно неожиданные проблемы. «Тропонин-отрицательных» пациентов не стало: оказалось, что средние нормальные уровни hs cTn составляют 2-5 нг/л, а уровни 99-й процентили - 14-20 нг/л (в зависимости от конкретного hs-теста).
Высокочувствительное определение тропонина основано на использовании моноклональных антител, «узнающих» его различные эпитопы. Исследования показали, что основной формой cTnI, присутствующей в крови пациентов, перенесших острый инфаркт миокарда, является двойной комплекс cTn-IC, в меньших количествах присутствуют тройной комплекс cTn-ITC, двойной комплекс cTn-IT и свободный cTnI. Во многих методах диагностики используется дифференциальное обнаружение комплексов тропонина и его свободной формы. В некоторых тестах данные, полученные при определении уровня различных форм cTnI, практически эквивалентны, в других тестах наблюдается существенное отличие. В последних случаях возможна неверная оценка истинной концентрации тропонина I в биологических средах. Эквимолярное связывание, определяемое как способность в равной степени связывать и комплексы тропонина и свободный тропонин, позволяет точно оценить общее количество cTnI, присутствующее в образцах пациента, перенесшего острый инфаркт миокарда.
На смену четкого четкого пограничного уровня тропонина, характерного для ИМ, появилась плавная шкала его повышенных концентраций, отражающая сначала субклиническую патологию миокарда, связанную с его структурными (неишемическими) повреждениями, затем стабильные заболевания коронарных артерий, потом нестабильную стенокардию и, наконец, ИМ без элевации ST-сегмента (ИМ Б ST). Более того, оказалось, что существует большое количество патологий, не связанных с ишемией миокарда, но ассоциированных с повышенными уровнями hs cTn. Первая международная согласованная рекомендация по высокочувствительному измерению тропонинов была предложена экспертами Европейского Кардиологического Общества в 2010 г. В результате, во многих европейских кардиологических центрах высокочувствительное измерение кардиальных тропонинов (параллельно с измерением «обычных») стало проводиться в рамках рутинной клинической практики. Все эти многоцентровые исследования привели к двум важнейшим результатам:
1. высокочувствительные тесты выявляют большее количество случаев ИМ Б ST, чем «обычные». В итоге, значительное количество пациентов, у которых на основании «обычных» cTn тестов диагностировалась нестабильная стенокардия, с помощью высокочувствительных были отнесены к группе с ИМ Б ST. При этом диагностика была более ранней - в течение первых 3 - 6 ч, что, при применении адекватных лечебных мероприятий давало значительное уменьшение числа неблагоприятных исходов по сравнению с предшествовавшей ситуацией (диагностика с помощью обычных тропонинов);
2. для диагностики ИМ с помощью высокочувствительных тропонинов следует принимать во внимание не только «одноразовые» абсолютные значения их концентрации, но и определять динамику их изменения, что, впрочем, было рекомендовано и для обычных тропонинов.
В случаях, когда измерение cTn недоступно, рекомендуется измерение массы КК-МВ. Другие биохимические кардиомаркеры (включая активность общей КК, активность КК-МВ, АЛТ, АСТ и др.) для диагностики ИМ не рекомендованы к применению и имеют в настоящее время только историческое значение.
Высокая специфичность сТн делает их особенно ценными в диагностике ИМ после электроимпульсной терапии, реанимационных мероприятий, хирургических вмешательств, поскольку КФК в подобных ситуациях существенно «реагирует» на повреждение скелетных мышц. Однако необходимо помнить, что специфичность сТн не абсолютна. Их уровни могут повышаться при целом ряде заболеваний и состояний в отсутствие ИБС.
Согласно данным независимых исследований, при длительных физических нагрузках может отмечаться кратковременный подъем концентрации тропонина. Этот подъем, предположительно, связан с увеличением напряжения миокарда, со спазмом периферических сосудов и возрастанием постнагрузки на миокард под действием катехоламинов. В результате происходит выход цитозольного пула тропонинов через неповрежденную мембрану кардиомиоцитов в кровь.
Установлено, что при сепсисе повышение содержания тропонина в крови отмечается у 12 -85 % пациентов. Такой разброс значений обусловлен многообразной этиологией септических состояний, использованием разных тропониновых тест-систем и различных пороговых значений маркера, наличием сопутствующей почечной недостаточности и особенностями отдельно взятых исследований и лабораторий. Одной из причин высвобождения тропонинов из кардиомиоцитов при сепсисе может быть глобальная ишемия миокарда, то есть несоответствие потребности миокарда в кислороде его доставке. Потребность в кислороде при сепсисе увеличивается в связи с лихорадкой и тахикардией, а его доставка снижается вследствие системной гипоксемии на фоне дыхательной недостаточности, микроциркуляторных нарушений, гипотонии и, иногда, анемии. Следовательно, создаются предпосылки для развития инфаркта миокарда. Пиковый уровень тропонина при сепсисе может помочь оценить риск развития миокардиальной дисфункции, но не риск смерти, так как миокардиальная дисфункция не является единственным механизмом летального исхода при данной нозологии. Необходимо подчеркнуть, что на настоящий момент не существует никаких рекомендаций и регламентирующих документов по использованию тропонина у пациентов с септическими состояниями. Но в каждом конкретном случае выявления повышенных концентраций этих маркеров необходимо в первую очередь исключить ИМ 1-го и 2-го типов.
При массивной ТЭЛА подъем уровня тропонинов отмечается в среднем в 50% случаев, при субмассивной – в 35 % случаев, а при немассивной ТЭЛА повышения тропонинов не происходит. Предполагается, что механизмом высвобождения тропонинов при ТЭЛА является некроз кардиомиоцитов правого желудочка из-за его перегрузки и резкой дилатации, а также из-за нарушения процессов перфузии и вентиляции.
Кардиальная дисфункция при острых неврологических заболеваниях может проявляться различными нарушениями сердечного ритма, изменениями на ЭКГ, вплоть до развития ОИМ, так называемый – цереброкардиальный синдром (ЦКС). К настоящему времени наиболее изученными являются проявления ЦКС при ишемических и геморрагических инсультах. Метаанализ исследований по определению уровня тропонина I и T у больных с острым инсультом (преимущественно ишемическим) показал, что концентрации биомаркеров превышают нормальные значения в среднем у каждого пятого больного. Кроме того, обнаружена тесная прямая корреляция уровней тропонинов с тяжестью инсульта.
Состояния, при которых уровни сердечных тропонинов хронически повышены:
1. Хроническая почечная недостаточность (ХПН)
Распространенность повышенного уровня сТн при терминальной стадии ХПН в отсутствие клинических признаков ишемии миокарда составляет от 12 до 82 % для тропонина Т и от 0,4 до55 % - для тропонина I. Причиной этого повышения, являются уремическая скелетная миопатия, постоянное токсическое повреждение миоцитов на фоне сопутствующей хронической сердечной недостаточности, гипертрофии левого желудочка, возрастающей постнагрузки или бессимптомные микроинфаркты из-за стеноза субэпикардиальных коронарных артерий и коронарной микроангиопатии. Повышение концентрации тропонинов у пациентов с термальной стадией ХПН сопровождается увеличением риска общей и сердечной смерти в 2-2,5 раза.
Национальная академия клинической биохимии (NACS) рекомендует выполнять измерение концентраций тропонинов у пациентов с почечной недостаточностью для диагностики ИМ в случае наличия клинических симптомов, ЭКГ или других признаков ишемии миокарда. Использование тропонинов Т и I также может быть рассмотренно для определения риска смерти пациентов с терминальной стадией ХПН и для фиксирования исходного уровня маркера, которое может оказаться полезным в острой клинической ситуации.
2.Сердечная недостаточность (СН)
С клинической точки зрения самой важной причиной повышения тропонинов у больных с СН является ишемия миокарда коронарного генеза, которая, в свою очередь, часто приводит к развитию инфаркта миокарда (ИМ) 1-го типа. Таким образом, при выявлении у пациента с остро возникшей декомпенсированной СН уровня тропонинов 99-го перцентиля верхней границы нормы (ВГН) необходимо в первую очередь исключить ИМ 1-го типа (т.е., событие, связанное с наличием в коронарной артерии нестабильной атеросклеротической бляшки и требующее лечения в соответствии с алгоритмами ведения пациентов с острым коронарным синдромом). Измерение концентраций тропонинов I и Т в крови наряду со снятием ЭКГ является обязательной частью обследования пациентов с острой сердечной недостаточностью. При наличии значимой динамики концентраций маркера в присутствии клинических симптомов ишемии миокарда по данным неинвазивных визуализирующих методик существует высокая вероятность того, что у пациента имеет место именно ИМ 1-го типа. У госпитализированных пациентов с ОСН, уровни сТн могут увеличиваться при декомпенсации заболевания и уменьшаться на фоне лечения СН. На основании анализа динамики концентраций сТн невозможно сделать вывод о механизме СН (коронарном или некоронарном) и о наличии или отсутствии у пациента ОКС. Уровни сТн более 99-го перцентиля (ВГН) при ОСН ассоциированы с высокой вероятностью неблагоприятных исходов независимо от наличия у пациента ИМ. Чем выше концентрации маркера, тем хуже прогноз.
3. Лечение кардиотоксичными химиопрепаратами
Связь химиотерапии с кардиотоксичностью впервые была описана в 1967 году. Кардиотоксичностью обладают такие группы лекарственных препаратов, как антрациклины, алкилирующие агенты, антиметаболиты и другие. Нежелательными последствиями химиотерапии для сердечно-сосудистой системы являются ишемия (при использовании антиметаболитов, алкилирующих средств), эндомиокардиальный фиброз и кардиомиопатии (антрациклины), перикардит и различные виды аритмий. Кардиотоксичность часто ограничивает использование этих препаратов в лечении. Повышение уровней сТн в крови наблюдается примерно у трети пациентов, получающих лечение кардиотоксическими химиопрепаратами. У некоторых пациентов (33-35%) повышение уровня сТн происходит сразу после введения химиопрепарата, у остальных – в течении последующих 72 часов. Пиковые концентрации маркера в большинстве случаев не превышают 99-й перцентиль ВГН более чем в 10 раз. Оптимальные сроки определения сТн для диагностики кардиотоксичности в действующих на сегодняшний день тематических рекомендациях не указаны, предлагается оценивать концентрацию биомаркеров до лечения, а также периодически во время и после терапии.
4. Тяжелая хроническая легочная гипертензия
Основной причиной смерти пациентов с тяжелой легочной гипертензией является правожелудочковая недостаточность и, соответственно, низкий минутный объем сердца. Предполагается, что важным звеном патогенеза при этом служит ишемическое повреждение миокарда правого желудочка, возникающее в результате общего снижения кровотока и нарушения перфузии миокарда. У 24-25% пациентов с выраженной легочной гипертензией концентрации сТн Т и I в крови хронически повышены.