Министерство обороны Российской Федерации
Заочная кадетская физико-математическая школа
ФИЗИКА
Класс
2013–2014 учебный год
Задание № 3
Молекулярная физика и термодинамика
Автор-составитель: В. И. Чивилёв, методист КФМШ
Москва, 2013
Основы молекулярно-кинетической теории
Под идеальным газом понимают газ, состоящий из молекул, удовлетворяющих двум условиям: 1) размеры молекул малы по сравнению со средним расстоянием между ними; 2) силы притяжения и отталкивания между молекулами проявляются только на расстояниях между ними, сравнимых с размерами молекул.
Молекулы идеального газа могут состоять из одного атома, двух и большего числа атомов.
Для простейшей модели одноатомного идеального газа, представляющей собой совокупность маленьких твердых шариков, упруго соударяющихся друг с другом и со стенками сосуда, можно вывести, используя законы механики Ньютона, основное уравнение молекулярно-кинетической теории идеального газа:
 (1.1)
(1.1)
Здесь P — давление газа, n — концентрация молекул (число молекул в единице объема),  средняя кинетическая энергия поступательного движения одной молекулы (сумма кинетических энергий поступательного движения всех молекул в сосуде, деленная на число молекул в сосуде). Вывод этого уравнения дан в школьном учебнике.
средняя кинетическая энергия поступательного движения одной молекулы (сумма кинетических энергий поступательного движения всех молекул в сосуде, деленная на число молекул в сосуде). Вывод этого уравнения дан в школьном учебнике.
Уравнение (1.1) оказывается справедливым и для многоатомного идеального газа, молекулы которого могут вращаться и обладать, поэтому, кинетической энергией вращения. Полная кинетическая энергия многоатомной молекулы складывается из кинетической энергии поступательного движения E = = m 0 v 2 =2 (m 0 — масса молекулы, v — скорость центра масс молекулы) и кинетической энергии вращения. В случае многоатомного идеального газа в (1.1) под  подразумевается только средняя кинетическая энергия поступательного движения молекулы:
подразумевается только средняя кинетическая энергия поступательного движения молекулы:  , где
, где 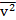 — среднее значение квадрата скорости молекулы (сумма квадратов скоростей всех молекул в сосуде, деленная на число молекул в сосуде).
— среднее значение квадрата скорости молекулы (сумма квадратов скоростей всех молекул в сосуде, деленная на число молекул в сосуде).
Температуру можно ввести разными способами. Не останавливаясь на них, отметим, что у идеального газа средняя кинетическая энергия поступательного движения молекул  связана с температурой Т соотношением:
связана с температурой Т соотношением:
 (1.2)
(1.2)
где k = 1;38 10 23 Дж=K — постоянная Больцмана. При этом мы считаем, что движение молекул описывается законами механики Ньютона. В системе СИ температура T измеряется в градусах Кельвина (К). В быту температуру часто измеряют в градусах Цельсия (0C). Температуры, измеряемые по шкале Кельвина T и по шкале Цельсия t, связаны численно соотношением: T = t + 273.
Итак, температура является мерой средней кинетической энергии поступательного движения молекул:  . Величина
. Величина  (1.3)
(1.3)
называется средней квадратичной скоростью. Она характеризует скорость хаотического движения молекул, называемого еще тепловым движением. Ясно,
что  . Интересно заметить, что средняя квадратичная скорость молекул идеального газа почти не отличается от средней арифметической скорости молекул
. Интересно заметить, что средняя квадратичная скорость молекул идеального газа почти не отличается от средней арифметической скорости молекул  (среднее значение модуля скорости):
(среднее значение модуля скорости):  . Поэтому под средней скоростью теплового движения молекул идеального газа можно понимать любую из этих скоростей.
. Поэтому под средней скоростью теплового движения молекул идеального газа можно понимать любую из этих скоростей.