Автономная некоммерческая профессиональная образовательная организация
«УРАЛЬСКИЙ ПРОМЫШЛЕННО-ЭКОНОМИЧЕСКИЙ ТЕХНИКУМ»
Сборник методических указаний
По выполнению заданий на практических занятиях
по дисциплине «Теоретические основы теплотехники и гидравлики»
по разделам 1 «Основы технической термодинамики»
и 2 «Основы теплопередачи»
по специальности 13.02.02
«Теплоснабжение и теплотехническое оборудование»
для студентов заочного отделения 1 курса
Рассмотрен и одобрен на Составлен в соответствии с
заседании цикловой комиссии рабочей программой к
теплотехнических дисциплин уровню подготовки выпуск- ников по специальности
13.02.02
«______»______________2014г.
Председатель_________Н.В.Панова
Утверждено
Методическим советом «УПЭТ»
Протокол №______от____________2014г.
Председатель_____________Н.Б.Чмель,зам. директора АН ПОО
«УПЭТ» по УР
Составитель:___________ Н.В.Барихина, преподаватель АН ПОО «УПЭТ»
Рецензент:______________Н.В.Панова, преподаватель АН ПОО «УПЭТ»
СОДЕРЖАНИЕ
Введение 4
ОБЩИЕ ТРЕБОВАНИЯ ПОВЫПОЛНЕНИЮ
ПРАКТИЧЕСКИХ ЗАДАНИЙ 7
1 ПрактическОЕ ЗАДАНИЕ
Тема: Параметры состояния тела 8
2 ПрактическОЕ ЗАДАНИЕ
Тема: Основные термодинамические процессы 13
3 ПрактическОЕ ЗАДАНИЕ
Тема: Нахождение параметров водяного пара по h-S диаграмме 26
4 ПрактическОЕ ЗАДАНИЕ
Тема: Теплопередача 32
5 ПрактическОЕ ЗАДАНИЕ
Тема: Теплообменные аппараты 47
Приложения 59
СПИСОК ЛитературЫ66
Введение
Целью методических указаний является оказание помощи студентам при подготовке и выполнении практических заданий по разделам 1 «Основы технической термодинамики» и 2 «Основы теплопередачи» по дисциплине «Теоретические основы теплотехники и гидравлики».
|
|
Данные методические указания предназначены для студентов 1 курса заочного отделения по специальности 13.02.02 «Теплоснабжение и теплотехническое оборудование» с целью научить студентов применять полученные на аудиторных занятиях знания по теории теплотехники при решении практических задач, включающие в себя пять практических заданий. В результате усвоения теоретического материала и проведения конкретных расчетов студенты получают определенные навыки для дальнейшего изучения общепрофессиональных дисциплин и профессиональных модулей.
Практические задания способствуют формированию общих компетенций:
ОК 1 Понимать сущность и социальную значимость своей будущей профессии, проявлять к ней устойчивый интерес;
ОК 2 Организовывать собственную деятельность, выбирать типовые методы и способы выполнения профессиональных задач, оценивать их эффективность и качество;
ОК 4 Осуществлять поиск и использование информации, необходимой для эффективного выполнения профессиональных задач, профессионального и личностного развития;
ОК 5 Использовать информационно-коммуникационные технологии в профессиональной деятельности;
ОК 6 Работать в коллективе и в команде, эффективно общаться с коллегами, руководством, потребителями;
ОК 7 Брать на себя ответственность за работу членов команды (подчиненных), за результат выполнения заданий.
Выполнение студентами практических заданий направлено на:
- обобщение, систематизацию, углубление, закрепление полученных теоретических знаний;
|
|
- формирование умений применять полученные знания на практике, реализацию единства интеллектуальной и практической деятельности;
- формирование профессионально значимых качеств, как самостоятельность, ответственность, точность, коллегиальность, творческая инициатива.
В ходе выполнения заданий на практических занятиях, студенты овладевают первоначальными профессиональными умениями:
- пользоваться справочной литературой;
- переводить единицы измерения давления в разные системы.
Формы организации студентов на практических занятиях: фронтальная и индивидуальная.
Формы и методы контроля и оценки - оценка результатов выполнения практического задания
Критерии оценки:
5 – «отлично» - задание выполнено в полном объёме с соблюдением необходимой последовательности. Студент работает самостоятельно: подбирает необходимые для выполнения задания источники знаний, показывает необходимые для выполнения практического задания теоретические знания и практические умения, расчёты произведены правильно, отчёт по практическому занятию сдан в соответствии с графиком учебного процесса;
4 – «хорошо» - задание выполняется студентом самостоятельно в полном объёме. Допускаются отклонения от необходимой последовательности выполнения, не влияющие на правильность конечного результата, использует указанные источники знаний, работа студента показывает знание им основного теоретического материала и овладение умениями, необходимыми для самостоятельного выполнения задания. Допускаются неточности и неаккуратность в оформлении результатов работы, не у всех искомых параметров правильно проставлены единицы измерения, имеются незначительные описки и орфографические ошибки;
|
|
3 – «удовлетворительно» - практическое задание выполняется и оформляется студентом при помощи преподавателя. На выполнение задания затрачивается много времени с учётом самостоятельной работы студента во внеаудиторной деятельности. Студент показывает знания теоретического материала, но испытывает затруднения при самостоятельной работе со справочной и учебно-методической литературой, в отчёте во множественном числе встречаются технические, математические и орфографические ошибки, отчёт по практическому занятию сдан не в соответствии с графиком учебного процесса;
2 – «неудовлетворительно» - студент не подготовлен к выполнению задания. Полученные результаты не соответствуют реальным показателям. Студент показывает плохое знание теоретического материала и отсутствие необходимых умений. Руководство и помощь со стороны преподавателя и хорошо подготовленных студентов неэффективны по причине неудовлетворительной подготовки студента.
ОБЩИЕ ТРЕБОВАНИЯ ПО выполнению практических Заданий
1. Исходные данные для выполнения задания берутся из приложения А в соответствии с номером своего варианта. Выбор номера варианта
производится по первоначальному списку в журнале при изучении данной темы.
2. Отчёт по выполненному заданию сдается в установленный срок.
3. При оформлении задания необходимо учесть следующие основные
требования:
· задания выполняются в печатном варианте на листах форматом А4;
· оформление задания производится 14 шрифтом полуторным интервалом;
· рассчитываемые формулы даются с пояснениями;
· расчёты к формулам не приравниваются;
· размерности рассчитываемых величин указываются в системе СИ;
· задания оформляются аккуратно, допускается при исправлениях пользоваться штрих - корректором;
· после выполнения задания приводится список используемой
литературы.
ПРАКТИЧЕСКОЕ ЗАДАНИЕ
Тема: Параметры состояния тела
Цель работы: Формирование уменийпо переводу единиц измерения
термодинамических параметров
Формируемые компетенции: ОК2, ОК4, ОК5
Ресурсы:
1. Барихина Н.В. Методические указания по выполнению заданий на практических занятиях [Текст]: - Екатеринбург: УПЭТ, 2013.-55с.
2. Бахшиева Л.Т., Кондрауров Б.П. [и др.] Техническая термодинамика и теплотехника: учебное пособие для вузов [Текст]: - М.: Изд. центр "Академия", 2008.-345с.
3. Прибытков И.А. Теоретические основы теплотехники: учеб. для студентов учреждений среднего профессионального образования[Текст]: – М.: Изд. центр "Академия", 2004.-276с.
Задание:
· ознакомиться с общими сведениями;
· выполнить задания №1,2 и 3;
· ответить на контрольные вопросы.
Общие сведения:
Величины, характеризующие тело в данном состоянии, называются параметрами состояния: удельным объёмом, давлением и температурой.
1. Удельный объём тела v представляет собой объём единицы его массы и измеряется в м3/кг. В технической термодинамике за единицу массы принимают килограмм (кг), за единицу объёма - кубический метр (м3).
v = V/m (1.1)
Величина, обратная удельному объему, называется плотностью ρ и измеряется в кг/м3 и представляет собой массу единицы объема.
ρ = 1/v (1.2)
Уравнение (1.2) позволяет определить плотность газа при любых условиях, если известно его значение для определённых условий.
Таблица 1.1 - Атомные массы химических элементов
| Элемент | Обозначение | Атомная масса |
| Водород | Н | |
| Гелий | Не | |
| Углерод | С | |
| Азот | N | |
| Кислород | О | |
| Сера | S | |
| Хлор | Сl |
Таблица 1.2 - Химическая формула газов
| Название | Химическая формула | Название | Химическая формула |
| Водород | Н2 | Водная пара | Н2О |
| Кислород | О2 | Аммиак | NН4 |
| Азот | N2 | Ацетилен | С2Н2 |
| Окись углерода | СО | Метан | СН4 |
| Углекислый газ | СО2 | Бензол | С6Н6 |
2. Давление Р измеряется силой, приходящейся на единицу поверхности. Во всех термодинамических уравнениях пользуются единицей измерения Паскаль
1Па=1 Н/м2,
1бар = 105Н/м2.
В технической системе за единицу силы принимают килограмм силы (кгс), который равен 9,80665 ньютона, а за единицу давления - килограмм силы на квадратный сантиметр (кгс/м2),т.е.
1 ат = 104 · 9,81 Н/м2 = 0,981 бар
Давление так же можно измерять высотой столба жидкости (ртути или воды).
· Техническая атмосфера соответствует 735,6 мм рт. ст. при температуре ртути 0° С или 10 м вод. ст.
· Физическая атмосфера (атм) соответствует 760 мм рт. ст. при температуре воды ОºС или 10332 мм вод. ст.
· 1 ат = 1 кгс/см2 = 10 00 кгс/м2 = 735,6 мм рт. ст. = 10 000 мм вод. ст. =
= 0,981бар
· 1 атм =1,0332 кгс/см2 =10 332 мм вод.ст.=760 мм рт.ст.=
=10332 вод.ст.=1,013 бар;
· 1 кГ/м2 = 1 мм вод. ст. = 9,81 Н/м2.
Манометры служат для измерения давления выше атмосферного. Их показания дают избыток давления измерения среды над атмосферой давлением - манометрическое (Рман ), или избыточное (Ризб) давление.
Абсолютное давление определяется из соотношения:
Рабс = Ризб + В, (1.3)
где В - атмосферное или барометрическое давление.
Вакуумметры служат для измерения давления ниже атмосферного,
которое называется вакуумом или разрежением. По их показаниям судят насколько давление рассматриваемой среды меньше атмосферного.
Абсолютное давление в этом случае определяется из равенства:
Рабс = В – Рвак (1.4)
При переводе давления, измеренного высотой ртутного столба, в другие единицы измерения давления вводится поправка на температуру:
Во = В (1 - 0,0001721), (1.5)
где Во - показания барометра, приведённые к 0° С,
В - действительная высота ртутного столба при температуре воздуха t°С,
0,000172 - коэффициент объёмного расширения ртути.
3. Третьей основной величиной, характеризующей состояние тела, является температура, которая выражается в зависимости от начала отчёта в градусах Кельвина (К) или в градусах Цельсия(ºС). В качестве единственной воспроизводимой опытом путём постоянной точки термодинамической температурной шкалы взята тройная точка воды, которой присвоены значения температуры 273,16 К (0,01°С), соответствующей температуре таянья льда. Тройная точка воды - это температура, при которой все три фазы (твёрдая, жидкая и газообразная) находятся в равновесии. Нижним пределом шкалы является абсолютный нуль. При этом температура кипения воды при нормальном атмосферном давлении соответствует 100°С. Температуру по международной практической температурной шкале, считываемую от 0° С, обозначают через t, а температуру по абсолютной шкале, отсчитываемую от температуры абсолютного нуля, обозначают Т и называют абсолютной температурой. Зависимость между ними имеет вид:
ТК = t°С + 273,15 (1.6)
В США и Англии для измерения температуры применяется шкала Фаренгейта (°F), по которой температура таянья льда и температура кипения воды соответственно равны 32°С и 212°С. Для перевода показания шкалы Фаренгейта в градусы Цельсияи обратно справедливы соотношения:
t°С = 5/9 (t°F - 32) (1.7)
t°F = 9/5 (t°С + 32) (1.8)
Пример:
Определить абсолютное давление пара в котле, если манометр показывает давление Рман= 1,3 бар, а атмосферное давление по ртутному барометру составляет Рбар =735 мм рт.ст. при температуре t =24 °С
Решение:
Абсолютное давление определяется по уравнению (1.3):
Рабс = Рман + Во
где Во - показания барометра, приведённые к 0° С, определяемые по формуле (1.5):
Во = В (1 - 0,000172 t),
где В - атмосферное давление, следовательно:
Во = 735 (1 - 0,000172·24)=731,96 мм рт. ст.= 731,96 ·1,33322·10-3=0,976 бар, Рабс = 1,3 + 0,976 = 2,276 бар
Ответ: абсолютное давление пара в котле равняется 2,276 бар
Практические задания
Задание № 1 Определить удельный объём и плотность газа при определённых условиях (при заданных массе и объеме)
| Вариант | |||||||||||
| CН4 | С2Ha | N2 | O2 | CO2 | CO | C3H8 | C4H10 | SO2 | SO3 | ||
| m | кг | 0,7 | 0,9 | 1,5 | 2,1 | 0,8 | 2,2 | 0,75 | 1,4 | 1,5 | 0,95 |
| v | м2 | 1,2 | 1,35 | 2,5 | 1,8 | 2,1 | 2,5 | 1,23 | 0,58 |
Задание № 2 Задано давление воздуха по ртутному барометру. Выразить это давление в барах, Паскалях, МПа, кгс/см2, м вод. с.
| Вариант | |||||||||||
| Велич. | Ед. изм. | ||||||||||
| Р | мм рт. ст. |
Задание № 3 Задана температура пара, выходящего из пароперегревателя, в °F. Перевести эту температуру в °С
| Вариант | |||||||||||
| t | 0F | ||||||||||
Контрольные вопросы
1. Какому физическому явлению соответствует 0°С?
2. Какой температуре в °С соответствует 0°F?
3. Какими приборами измеряется атмосферное давление?
4. Перевести 39 кПа в м вод. ст.
ПРАКТИЧЕСКОЕ ЗАДАНИЕ
Тема: Основные термодинамические процессы
Цель работы: Формирование уменийпо расчёту параметров процессов Формируемые компетенции: ОК2, ОК4, ОК5
Ресурсы:
1. Барихина Н.В. Методические указания по выполнению заданий на практических занятиях [Текст]: - Екатеринбург: УПЭТ, 2013.-55с.
2. Бахшиева Л.Т., Кондрауров Б.П. [и др.] Техническая термодинамика и теплотехника: учебное пособие для вузов [Текст]: - М.: Изд. центр "Академия", 2008.-345с.
3. Прибытков И.А. Теоретические основы теплотехники: учеб. для студентов учреждений среднего профессионального образования[Текст]: – М.: Изд. центр "Академия", 2004.-276с.
Задание:
· ознакомиться с общими сведениями;
· выполнить задания №1÷6;
· ответить на контрольные вопросы.
Общие сведения:
· Основными термодинамическими процессами являются:
1. изохорный процесс - процесс сообщения или отвода тепла при постоянном объеме газа (V =const);
2. изобарный процесс - процесс сообщения или отвода тепла при постоянном давлении (р = const);
3. изотермический процесс - процесс сообщения или отвода тепла при постоянной температуре (t = const);
4. адиабатный процесс -процесс без сообщения или отвода тепла извне (q = 0);
5. политропный процесс - процесс, в котором изменение параметров подчиняется уравнению pvn = const,
где n - величина, постоянная для данного процесса.
Изохорный процесс
В диаграмме Рv процесс изображается прямой 1-2, параллельной оси ординат. Уравнение прямой 1-2 (рисунок 2.1), называемой изохорой, v = const.

Рисунок 2.1 - PV и TS диаграммы изохорного процесса
Зависимость между начальными и конечными параметрами процесса:
 (2.1)
(2.1)
Изменение внутренней энергии в Дж/кг:
Δ u = Cvm (t2 - tl) (2.2)
Если в процессе участвует М (кг) или Vн (м3), то количество тепла или изменение внутренней энергии газа подсчитывается по формуле:
Qv = ΔUv = MСvm (t2 – t1) = VнС1vm (t2 - t1) (25.3)
где Vн — количество газа в м3 при нормальных условиях.
В изохорном процессе газ работы не совершает (L =0)
Задание № 1. В закрытом сосуде заключен газ при разряжении Рвак1и температуре t1. Показание барометра - 760 мм рт. ст. До какой температуры нужно охладить газ, чтобы разряжение стало равным Рвак2
| Вариант | |||||||||||
| Рвак1 | мм рт.ст. | ||||||||||
| tl | °С | ||||||||||
| Рвак2 | мм рт.ст. | ПО |
Изобарный процесс
В диаграмме Рv этот процесс изображается прямой 1-2, параллельной оси абсцесс. Уравнение прямой 1-2 (рисунок 2.2), называется изобарой, р = const.

Рисунок 2.2 - PV и TS диаграммы изобарного процесса
Зависимость между начальными и конечными параметрами процесса:
 (2.4)
(2.4)
Работа 1 кг газа:
l=p(v2-v1) (2.5)
или l=R(T2-T1) (2.6)
Для газа массой М кг:
L = MР (v2-v1) = Р(V2-V1) (2.7)
или L = MR(t2-t1) (2.8)
Если в процессе р = const участвует М (кг) или Vн (м3), то количество тепла подсчитывается по формуле:
Qр = MСрm (t2 – t1) = VнС1рm (t2 - t1) (2.10)
где Vн — количество газа в м3 при нормальных условиях.
Изменение внутренней энергии газа определяется по формуле:
Δu = Cvm(t2 – t1) (2.11)
или Δu =Cvm2 t2 – Cvm1 t1 (2.12)
Задание № 2. В цилиндре находится воздух при давлении Р и температуре tl. От воздуха отводится тепло при постоянном давлении таким образом, что в конце процесса устанавливается температура t2. Объем цилиндра, в котором находится воздух, V. Определить количество отведенного тепла, конечный объем, изменение внутренней энергии и совершенную работу сжатия. Зависимость теплоемкости от температуры считать нелинейной.
| Вариант | |||||||||||
| Р | бар | ||||||||||
| tl | °С | ||||||||||
| t2 | °С | ||||||||||
| V | л |
Изотермический процесс
Кривая изотермического процесса, называется изотермой, в диаграмме Pv изображается равнобокой гиперболой (рисунок 5.3). Уравнение изотермы в
координатах PV: PV = const

Рисунок 2.3 - PV и TS диаграммы изотермического процесса
Зависимость между начальными и конечными параметрами определяется по формулам:
 (2.13)
(2.13)
 (2.14)
(2.14)
Работа 1 кг идеального газа определяется из уравнений:
l=RT In  (2.15)
(2.15)
l=RT In  (2.16)
(2.16)
l=P1v1 In  (2.17)
(2.17)
l= P1v1 In  (5.18)
(5.18)
Если в процессе участвует газ массой М кг, то полученные из формул (2.15) ÷(2.18) значения нужно увеличить в М раз. Можно также для этого случая в формулах (2.17)и(2.18) заменить удельный объем v полным объемом V. Получим:
L = Р1V1In  (2.19)
(2.19)
L = Р1V1In  (2.20)
(2.20)
Т. к. в изотермическом процессе t = const, то для идеального газа:
Δu = Cvm (t2-t1) = 0
Количество тепла, сообщаемого газу или отнимаемого от него, равно:
qt=l (2.21)
или для газа массой М кг: Qt = L (2.22)
Натуральный логарифм, входящий в формулы, может быть заменен десятичным по соотношению InN = 2,303IgN.
Значение работы изотермического сжатия для 1 кг различных газов при одинаковых условиях выражаются следующими уравнениями:
l1 =R1T In  (2.23)
(2.23)
l2 = R2T In  (2.24)
(2.24)
l3 = R3T In  и т.д. (2.25)
и т.д. (2.25)
следовательно l1: l2: l3 = R1: R2: R3, (2.26)
т.е работа изотермического сжатия пропорциональна газовой постоянной.
Задание № 3. 1кг воздуха при температуре tl и начальном давлении Р1 сжимается изотермически до конечного давления Р2. Определить конечный объем, затрачиваемую работу и количество тепла, отводимого от газа.
| Вариант | |||||||||||
| tl | ºС | ||||||||||
| Р1 | бар | ||||||||||
| Р2 | бар |
Адиабатный процесс
Уравнение адиабаты в системе координат Рv (рисунок 2.4) при постоянной теплоемкости (Cv = const) для идеального газа pvк = const,
где к - показатель адиабаты, к=Ср /Сv

Рисунок 2.4 - PV и TS диаграммы адиабатного процесса
Зависимость между начальными и конечными параметрами процесса:
- между Р и v:
 (2.27)
(2.27)
- между Т и v:
 (2.28)
(2.28)
- между Т и Р:
 (2.29)
(2.29)
Работа 1 кг газа определяется по следующим формулам:
1=  (P1 v1-Р2v2) (2.30)
(P1 v1-Р2v2) (2.30)
1=  [1-
[1-  ] (2.31)
] (2.31)
1=  (Т1 -Т2) (2.32)
(Т1 -Т2) (2.32)
1=  [1 -
[1 - 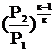 ] (2.33)
] (2.33)
Для определения работы газа массой М кг нужно в формулах (2.30), (2.31) и (2.33) заметить удельный объем v общим объемом газа:
L =  (P1 V1-Р2V2) (2.34)
(P1 V1-Р2V2) (2.34)
L = 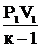 [1-
[1-  ] (2.35)
] (2.35)
L = 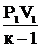 [1 -
[1 - 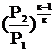 ] (2.36)
] (2.36)
Формула (2.32) для газа массой M кг примет следующий вид:
L=  (Т1 -Т2) (2.37)
(Т1 -Т2) (2.37)
Уравнение первого закона для адиабатного процесса имеет следующий
вид: Δu= - l (2.38)
т.е. изменение внутренней энергии газа и работа адиабатного процесса равна по величине и противоположна по закону.
Изменение внутренней энергии идеального газа а адиабатном процессе может быть также выражено уравнением:
Δu = Cvm (t2 –t1) (2.39)
Задание № 4. В баллоне емкостью V находится воздух при давлении Р1 и температуре tl. Давление окружающей среды Р2. Определить работу, которая может быть произведена содержащимся в баллоне воздухом при расширении его до давления окружающей среды по изотерме и по адиабате. Определить также минимальную температуру, которую будет иметь воздух в баллоне, если открыть вентиль и выпускать воздух из баллона до тех пор, пока давление в нем не станет равным давлению окружающей среды и при условии, что теплообмен воздуха с окружающей средой будет отсутствовать.
| Вариант | |||||||||||
| V | м3 | ||||||||||
| P1 | бар | ||||||||||
| t1 | °C | ||||||||||
| P2 | бар | 0,5 | 0,8 | 0,9 | 1,2 | 1,3 | 1,5 | 1,7 | 1,9 |
Задание № 5. В газовом двигателе смесь газа и воздуха адиабатно сжимается так, что к концу сжатия ее температура оказывается на 200°С ниже температуры воспламенения газа. В начале сжатия давление Р1 и температура tl. Показатель адиабаты к=1,36; R=314 Дж/(кг К), температура воспламенения t всп.
Определить величину работы сжатия и степень сжатия.
| Вариант | |||||||||||
| P1 | МПа | 0,07 | 0,08 | 0,09 | 0,1 | 0,2 | 0,3 | 0,4 | 0,5 | 0,6 | 0,7 |
| tl | °С | ||||||||||
| tвcn | °С |
Политропный процесс
Уравнение политропы в системе координат Рv (рисунок 2.5) при постоянной теплоёмкости Рvn =const,
где n — показатель политропы.

Рисунок 2.5 - PV диаграмма политропного процесса
Характеристикой политропного процесса является величина
φ =  (2.40)
(2.40)
где к показатель адиабаты, к = 

Рисунок 2.6 - PV диаграмма политропных процессов
По рисунку 2.6 можно по величине показателя политропы определить ее относительное расположение в диаграмме Рv, а также выяснить характер процесса, т.е. имеет ли место подвод или отвод тепла и увеличение или уменьшение внутренней энергии газа.
- Для процессов расширения:
1. n < 1 - тепло подводится (q>0), внутренняя энергия газа увеличивается (Δu>0);
2. к > n >1 - тепло подводится (q>0), внутренняя энергия газа уменьшается
(Δu <0);
3. n > к - тепло отводится (q<0), внутренняя энергия газа уменьшается
(Δu <0).
- Для процессов сжатия:
1. n < 1 - тепло отводится, внутренняя энергия газа уменьшается;
2. к> n >1 - тепло отводится, внутренняя энергия газа увеличивается;
3. n >к — тепло подводится, внутренняя энергия газа увеличивается.
Зависимость между начальными и конечными параметрами процесса:
- между Р и v:
 (2.41)
(2.41)
- между Т и v:
 (2.42)
(2.42)
- между Р и Т:
 (2.43)
(2.43)
Работа 1 кг газа определяется по следующим формулам:
1=  (P1 v1-Р2v2) (2.44)
(P1 v1-Р2v2) (2.44)
1=  [1-
[1-  ] (2.45)
] (2.45)
1=  (Т1 -Т2) (2.46)
(Т1 -Т2) (2.46)
1=  [1 -
[1 -  ] (2.47)
] (2.47)
Если количество тепла, участвующего в процессе, известно, что работа может быть также вычислена по формуле:
1=  q (2.48)
q (2.48)
Для определения работы газа массой М кг нужно в формулах (2.44), (2.45) и (2.47) заметить удельный объем v общим объемом газа:
L =  (P1 V1-Р2V2) (2.49)
(P1 V1-Р2V2) (2.49)
L =  [1-
[1-  ] (2.50)
] (2.50)
L =  [1 -
[1 -  ] (2.51)
] (2.51)
Формула (2.46) для газа массой M кг примет следующий вид:
L=  (Т1 -Т2) (2.52)
(Т1 -Т2) (2.52)
или L =  Q (2.53)
Q (2.53)
Теплоемкость политропного процесса определяется из уравнения:
с =  (2.54).
(2.54).
или с=сv 
 (2.57).
(2.57).
Количество тепла, сообщаемого газу или отводимого от него:
q = c(t2-tl) = сv  (t2 - tl) (2.58)
(t2 - tl) (2.58)
Q = Mc(t2-tl) = M сv  (t2 - tl) (2.59)
(t2 - tl) (2.59)
Величина Q может быть также определена, если известна работа политропного процесса:
Q = L 
 (2.60)
(2.60)
Изменение внутренней энергии газа в политропном процессе находится по формуле:
Δu = Cvm(t2-tl) (2.61)
Показатель политропного процесса определяется из уравнения:
n=  (2.62)
(2.62)
Задание № 6. 1 кг воздуха при давлении P1 и температуре tl расширяется политропно до давления P2. Определить конечное состояние воздуха, изменение внутренней энергии, количество подведенного тепла и полученную работу, если показатель политропы n =1,2.
| Вариант | |||||||||||
| Рl | бар | 2,6 | 3,5 | 4,4 | 5,5 | 6,3 | |||||
| tl | °С | ||||||||||
| Р2 | бар | 0,1 | 0,2 | 0,3 | 0,4 | 0,5 | 0,6 | 0,7 | 0,8 | 0,9 | 1,0 |
Пример:
В закрытом сосуде емкостью V = 0,6 м3 содержится воздух при давлении Р1 = 5 бари температуре t1 = 20°С. В результате охлаждения сосуда воздух, содержащийся в нем, теряет тепло в количестве Q= -105 кДж. Принимая теплоемкость воздуха постоянной, определить, какое давление и какая температура установятся после этого в сосуде.
Решение:
Из уравнения состояния Клапейрона-Менделеева масса воздуха в сосуде определяется по формуле:
М= 
М=  =3,57 кг
=3,57 кг
Количество тепла, отводимого от воздуха в процессе, определяется по уравнению:
Q= Mcvm(t2— t1),
откуда t2 =  + t1
+ t1
где cvm –средняя массовая изохорная теплоёмкость воздуха, определяемая по формуле:
cvm= 
где μcvm –средняя мольная изохорная теплоёмкость воздуха, для двухатомных газов μcvm=20,93;
μ – моль, для воздуха μ=28,96; следовательно:
cvm=20,93/28,96=0,723 кДж/кг·К
t2=  +20=-20,7 °С
+20=-20,7 °С
Из соотношения параметров в изохорном процессе: 
давление в конечном состоянии определяется из уравнения:
Р2=Р1 
Р2=5·  =4,3 бар
=4,3 бар
Ответ: после охлаждения сосуда в нём установится давление 4,3 бар, температура-20,7 ° С.
Контрольные вопросы
1. Какой закон применим для изотермического процесса?
2. Какой закон применим для изобарного процесса?
3. Какой закон применим для изохорного процесса?
4. Напишите формулу для определения показателя адиабаты в зависимости от теплоёмкости.
ПРАКТИЧЕСКОЕ ЗАДАНИЕ
Тема: Нахождение параметров водяного пара по hS диаграмме
Цель работы: Формирование уменийиспользования hS диаграммы и применения полученных знаний при решении задач
Формируемые компетенции: ОК2, ОК4, ОК5
Ресурсы:
1. Барихина Н.В. Методические указания по выполнению заданий на практических занятиях [Текст]: - Екатеринбург: УПЭТ, 2013.-55с.
2. Бахшиева Л.Т., Кондрауров Б.П. [и др.] Техническая термодинамика и теплотехника: учебное пособие для вузов [Текст]: - М.: Изд. центр "Академия", 2008.-345с.
3. Ривкин С.Л., Александров А.А. Термодинамические свойства воды и водяного пара [Текст]: - М.: Энергоатомиздат, 2004.-456с.
Задание:
· ознакомиться с общими сведениями;
· выполнить задания №1, 2 и 3;
· ответить на контрольные вопросы.
Общие сведения:
· Наряду с таблицами насыщенного пара исключительно важное значение в теплотехнических расчётах имеют диаграммы Ts и hs. На рисунке 4.1 изображена диаграмма Ts для водяного пара. Кривая О1K — нижн