Алюминий – 3 стр., хром – 4, железо – 15, медь – 16, марганец – 17
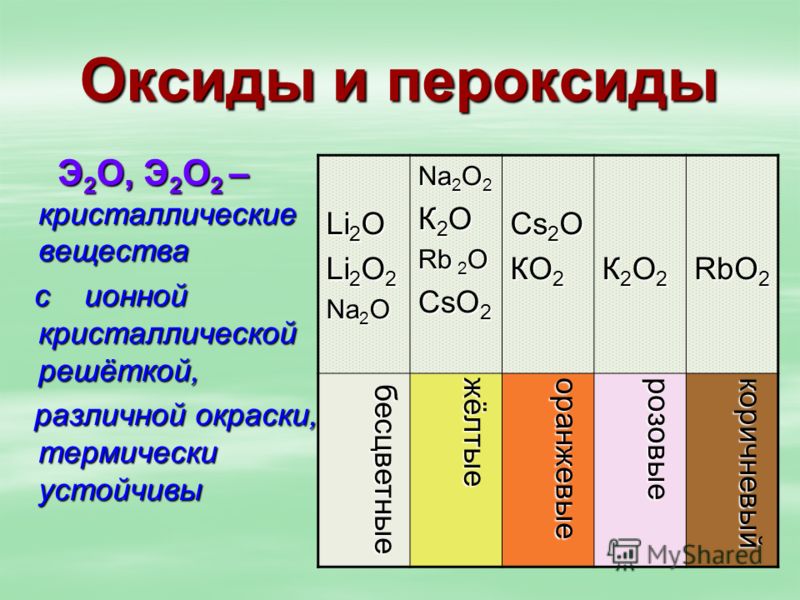



1 

Хром
Чистый хром - очень твердый тугоплавкий металл голубовато-серебристого цвета. Имеет самую большую твердость из всех применяемых в промышленности металлов. Т. пл. 1890°С, плотность 7,19 г/см.
При образовании соединений с другими элементами хром может использовать от 1 до 6 валентных электронов. Наибольшую устойчивость и практическую значимость имеют соединения, в которых атомы Сг находятся в степенях окисления +2, +3, +6.
С повышением степени окисления атомов Сг в оксидах и гидроксидах их основный характер ослабевает,а кислотный - усиливается. В этом же направлении происходит замена восстановительной активности на окислительную.
| Cr+2 | Cr+3 | Cr+6 | |||
| Оксиды | CrO основный | Cr2O3 амфотерный | CrO3 кислотный | ||
| Гидроксиды | Cr(OH)2 слабое основание | Cr(OH)3 ↔ HCrO2 + H2O амфотерный гидроксид | 2H2CrO4 ↔ H2Cr2O7 + H2O сильные кислоты | ||
| Соли | CrCl2, CrSO4, Cr(NO3)2, CrS | Тип I CrCl3, Cr(SO4)3, Cr(NO3)3 | Тип II KCrO2, Ca(CrO2)2, Fe(CrO2)2 хромиты | хроматы K2CrO4, Na2(CrO4)2, BaCrO4, PbCrO4 | дихроматы K2Cr2O7, Na2Cr2O7, (NH4)2Cr2O7 |
| Окислительно-восстановительная функция | Сильные восстановители | Окислители и восстановители | Сильные окислители | ||
1. Алюминотермический: Сr2O3 + 2Al = Аl2O3 + 2Сr
2. Силикотермический: 2Сr2O3 + 3Si = 3SiO2 + 4Cr
3. Электролитический: 2CrCl3 = 2Сr + 3Cl2
Поверхностная оксидная пленка является причиной инертности хрома при обычной температуре, благодаря чему этот металл не подвергается атмосферной коррозии (в отличие от железа).
При нагревании хром проявляет свойства довольно активного металла, что соответствует его положению в электрохимическом ряду напряжений.
Тонкоизмельченный хром интенсивно горит в токе кислорода. На воздухе реакция с O2 происходит лишь на поверхности металла.
4Сr + 3O2 = 2Сr2O3
При осторожном окислении амальгамированного хрома образуется низший оксид CrO.
(Сr не взаимодействует с Н2, но поглощает его в больших количествах)
2Cr + 3Cl2 = 2CrCl3, Cr + S = CrS - ионные соединения.
2Cr + N2 = 2CrN, Cr + C → CrxCy - ковалентные тугоплавкие инертные вещества, по твердости сравнимы с алмазом.
С кислотами
Сr + 2HCl = СrСl2 + Н2↑
Сr + H2SO4 = CrSO4 + Н2↑
Эти кислоты не растворяют хром при обычной температуре, они переводят его в «пассивное» состояние.
Пассивацию можно частично снять сильным нагреванием, после чего хром начинает очень медленно растворяться в кипящих конц. HNO3, H2SO4, «царской водке».
Сr + 6HNO3 = Cr(NO3)3 + 3NO2↑ + 3H2O
2Сr + 6H2SO4 = Cr2(SO4)3 + 3SO2↑ + 6H2O
Царская водка - смесь концентрированных HNO33 и НСl (1:3), растворяет золото и платиновые металлы (Pd,Os,Ru).
С солями
Сr + CuSO4 = CrSO4 + Сu
Сr + Pb(NO3)2 = Cr(NO3)2 + P
2Сr + KIO3 = Сr2O3 + KCl
2Сr + 3NaNO3 = Сr2O3 + 3NaNO2
СrO - оксид хрома (II). Твердое черное вещество, н. р. в Н2O.
1) медленное окисление хрома, растворенного в ртути 2Сr + O2 = 2СrO
2) обезвоживание Сr(ОН)2 в восстановительной атмосфере: Сr(ОН)2 = СrO + H2O
СrO - неустойчивое вещество, легко окисляется при небольшом нагревании до Сr2O3; при более высоких Т диспропорционирует: 3СrО = Сr + Сr2O3
СrO - типичный основный оксид, проявляет характерные для этого класса свойства. Реакции необходимо проводить в восстановительной среде.
Сr(OН)2 - гидроксид хрома (II) твердое желтое вещество, н. р. в Н2O. Желтый → зеленый
Получают обменными реакциями из солей Сr2+: CrCl2 + 2NaOH = Сr(ОН)2 + 2NaCl
Неустойчивое вещество, разлагается при нагревании; на воздухе быстро окисляется с образованием зеленого гидроксида хрома (III);
4Сr(ОН)2 + O2 + 2Н2O = 4Сr(ОН)3
Наиболее важные: CrCl2, CrSO4, (СН3СОО)2Сr. Гидратированный ион Сr2+ имеет бледно-голубую окраску.
1. Сr + неметалл (S, Hal2)
Сr + 2HCl(r) = CrCl2 + Н2
2. Восстановление солей Сr3+: 2СrСl3 + Н2 = 2CrCl2 + 2HCl
1. Соли Сr2+ - сильные восстановители, так как очень легко окисляются до солей Сr3+
4CrCl2 + 4HCl + O2 = 4СrСl3 + 2Н2О
2. Раствор CrSO4 в разбавленной H2SO4 - превосходный поглотитель кислорода:
4CrSO4 + O2 + 2H2SO4 = 2Cr2(SO4)3 + 2Н2О
3. С аммиаком соли Сr2+ образуют комплексные соли - аммиакаты:
CrCl2 + 6NH3 = [Cr(NH3)6]Cl2
Для Сr2+ характерно образование двойных сульфатов, например: K2Cr(SO4)2• 6Н2O
Сr2О3 - оксид хрома (III), Сr2O3 - типичный амфотерный оксид, важнейшее природное соединение хрома. Сr2О3, полученный химическими методами, представляет собой темно-зеленый порошок. В порошкообразном виде реагирует с сильными кислотами и сильными щелочами, в кристаллическом виде - химически инертное вещество.
1. Синтез из простых веществ: 4Сr + 3O2 = 2Сr2О3
2. Термическое разложение гидроксида хрома (III) или дихромата аммония:
2Сr(ОН)3 = Сr2O3 + 3Н2O
(NH4)2Cr2O7 = Сr2O3 + N2 + 4Н2O
3. Восстановление дихроматов углеродом или серой: К2Сr2O7 + S = Сr2O3 + K2SO4
Сr2O3 используется для изготовления краски «хромовая зеленая», обладающей термо- и влагоустойчивостью.
К наиболее практически важным реакциям относятся следующие:
1. Восстановление с целью получения металлического хрома: Сr2O3 + 2Al = 2Сr + Аl2O3
2. Сплавление с оксидами и карбонатами активных металлов:
Сr2O3 + МgО = Мg(СrO2)2
Сr2O3 + Na2CO3 = 2NaCrO2 + CO2
Образующиеся метахромиты являются производными метахромистой кислоты НСrO2.
3. Получение хлорида хрома (III):
Сr2O3 + ЗС + 3Cl2 = 2СrСl3 + ЗСО
Сr2O3 + ЗССl4 = 2СrСl3 + ЗСОСl2
Образуется в виде синевато-серого осадка при действии щелочей на соли Сr3+:
СrСl3 + 3NaOH = Сr(ОН)3 + 3NaCl
Практически нерастворимый в воде гидроксид может существовать в виде коллоидных растворов.
В твердом состоянии гидроксид хрома (III) имеет переменный состав Сr2O3• nН2O. Теряя молекулу воды, Сr(ОН)3 превращается в метагидроксид СrО(ОН).
Сr(ОН)3 - амфотерный гидроксид, способный растворяться как в кислотах, так и в щелочах:
Cr(OH)3 + 3HCl = СrСl3 + ЗН2O
Сr(ОН)3 + ЗН+ = Сr3+ + ЗН2O
Сr(ОН)3 + 3NaOH = Na3(Cr(OH)6]
Сr(ОН)3 + ЗОН- = [Cr(OH)6]3-гексагидроксохромитанион
При сплавлении с твердыми щелочами образуются метахромиты:
Сr(ОН)3 + NaOH = NaCrO2 + 2Н2O
Растворением осадка Сr(ОН)3 в кислотах получают нитрат Cr(NO3)3, хлорид СrСl3, сульфат Cr2(SO4)3 и другие соли. В твердом состоянии чаще всего содержат в составе молекул кристаллизационную воду, от количества которой зависит окраска соли.
Самой распространенной является двойная соль КСr(SO4)2• 12H2O - хромокалиевые квасцы (сине-фиолетовые кристаллы).
Хромиты, или хроматы (III) - соли, содержащие Сr3+ в составе аниона. Безводные хромиты получают сплавлением Сr2O3 с оксидами двухвалентных металлов:
Сr2O3 + МеО = Ме(СrO2)2 метахромиты
В водных растворах хромиты существуют в виде гидроксокомплексов.
К наиболее характерным свойствам солей Cr(III) относятся следующие:
1. Осаждение катиона Сг3+ под действием щелочей: Сr3+ + ЗОН- = Сr(ОН)3
Характерный цвет осадка и его способность растворяться в избытке щелочи используется для отличия ионов Сг3+ от других катионов.
2. Легкая гидролизуемость в водных растворах, обусловливающая сильнокислый характер среды:
Сr3+ + Н2O = СrОН2+ + Н+
Соли Сr (III) с анионами слабых и летучих кислот в водных растворах не существуют; так как подвергаются необратимому гидролизу, например:
Cr2S3 + 6Н2O = 2Сr(ОН)3 + 3H2S
3. Окислительно-восстановительная активность:
а) окислитель: соли Cr(III) → соли(VI) см. «Получение солей Cr(VI)»
б) восстановительь: соли Cr(III) → соли(II) см. «Получение солей Cr(II)»
4. Способность к образованию комплексных соединений - аммиакатов и аквакомплексов, например:
СrСl3 + 6NH3 = [Cr(NH3)6]Cl3
Кристаллическое вещество темно-красного цвета, очень гигроскопичное, легко растворимое в воде. Основной способ получения:
К2Сr2O7(кр.) + H2SO4 = 2CrO3 + K2SO4 + Н2O
СrО3 - кислотный оксид, активно взаимодействует с водой и щелочами, образуя хромовые кислоты и хроматы.
Хромовый ангидрид - чрезвычайно энергичный окислитель. Например, этанол воспламеняется при соприкосновении с СrO3:
С2Н6ОН + 4СrO3 = 2CO2 + ЗН2O + 2Сr2O3
Продуктом восстановления хромового ангидрида, как правило, является Сr2O3.
При растворении CrO3 в воде образуются 2 кислоты:
CrO3 + Н2O = Н2СrO4 хромовая
2CrO3 + Н2O = Н2Сr2O7 дихромовая
Обе кислоты существуют только в водных растворах. Между ними устанавливается равновесие:
2Н2СrO4 = Н2Сr2O7 + Н2O
Обе кислоты очень сильные, по первой ступени диссоциированы практически полностью:
Н2СrO4 = Н+ + НCrO4-
Н2Сr2O7 = Н+ + НСr2O7-

Хроматы (VI) - соли, сильные окислители. содержащие анионы хромовой кислоты CrO42-. Почти все имеют желтую окраску (реже - красную). В воде хорошо растворяются только хроматы щелочных металлов и аммония. Хроматы тяжелых металлов н. р. в Н2O. Наиболее распространены: Na2CrO4, К2CrO4, РЬCrO4 (желтый крон).
1. Сплавление CrO3 с основными оксидами, основаниями:
CrO3 + 2NaOH = Na2CrO4 + Н2O
2. Окисление соединений Cr(III) в присутствии щелочей:
2К3[Сr(ОН)6]+ ЗВr2+ 4КОН = 2К2СrO4 + 6КВr + 8Н2O
3. Сплавление Сr2O3 со щелочами в присутствии окислителя:
Сr2О3 + 4КOН + КClO3 = 2К2СrO4 + KCl + 2Н2O
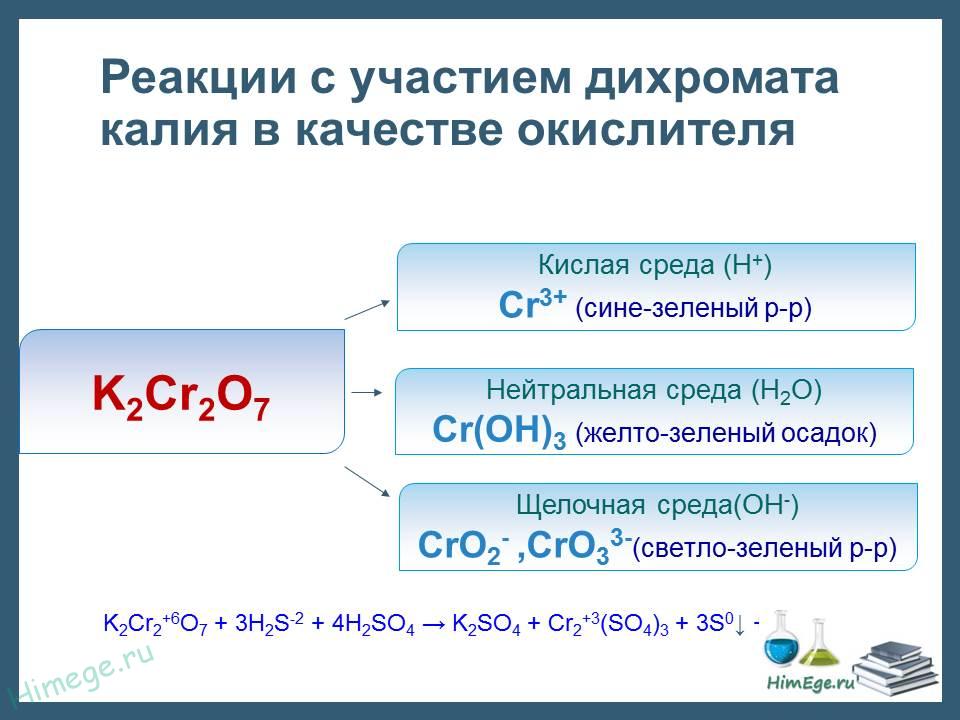
Хроматы существуют только в разбавленных щелочных растворах, которые имеют желтую окраску, характерную для анионов СrO42-. При подкислении раствора эти анионы превращаются в оранжевые дихромат-анионы:
2СrO42- + 2Н+ = Сr2O72- + Н2O Это равновесие мгновенно сдвигается в ту или иную сторону при изменении рН растворов.
При нагревании хроматы тяжелых металлов разлагаются; например:
4Нg2СrO4 = 2Сr2O3 + 8Нg + 5O2
Дихроматы (VI) - соли, содержащие анионы дихромовой кислоты Сr2O72-
В отличие от монохроматов имеют оранжево-красную окраску и обладают значительно лучшей растворимостью в воде. Наиболее важные дихроматы - К2Сr2O7, Na2Cr2O7, (NH4)2Cr2O7.
Их получают из соответствующих хроматов под действием кислот, даже очень слабых, например:
2Na2CrO4 + 2СO2 + Н2O → Na2Cr2O7 + 2NaHCO3
Водные растворы дихроматов имеют кислую среду вследствие устанавливаемого равновесия с хроматанионами (см. выше). Окислительные свойства дихроматов наиболее сильно проявляются в подкисленных растворах:
Сr2O72- + 14Н+ + 6e- = 2Сr3+ + 7Н2O
При добавлении восстановителей к кислым растворам дихроматов окраска резко изменяется от оранжевой до зеленой, характерной для соединений Сг3+.
K2Cr2O7 + 14HCl = 2CrCl3 + 3Cl2↑ + 2KCl +7Н2О
K2Cr2O7 + 3H2S + 4H2SO4 = Cr2(SO4)3 + 3S↓ + K2SO4
K2Cr2O7 + 3SO2 + H2SO4 = Cr2(SO4)3 + K2SO4 + H2O
Эта реакция используется для получения хромокалиееых квасцов KCr(SO4)2 • 12H2O
K2Cr2O7 + 6HI + 4H2SO4 = Cr2(SO4)3 + 3I2↓ + K2SO4 + 7H2O
K2Cr2O7 + 6FeSO4 +7H2SO4 = 3Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 + 7H2O
K2Cr2O7 + H2O2 + 4H2SO4 = Cr2(SO4)3 + K2SO4 + 3O2↑ + 7H2O
2K2Cr2O7 + 3CH3OH + 8H2SO4 = Cr2(SO4)3 + 3HCOOH + 2K2SO4 + 11H2O
8K2Cr2O7 + 3C12H22O11 + 32H2SO4 = 8Cr2(SO4)3 + 12CO2↑ + 8K2SO4 + 43H2O
Сплавление:
Na2Cr2O7 + 2C = Cr2O3 + Na2CO3 + CO↑
Очень сильным окислителем является «хромовая смесь» - насыщенный раствор K2Cr2O7 или Na2Cr2O7 в концентрированной H2SO4.
Хром.
Хром – это белый с голубоватым отливом блестящий металл, очень твердый (плотность 7, 2 г/см3), температура плавления 1890˚С.
Химические свойства: хром при обычных условиях неактивный металл. Это объясняется тем, что его поверхность покрыта оксидной пленкой (Сr2О3). При нагревании оксидная пленка разрушается, и хром реагирует с простыми веществами при высокой температуре:
· 4Сr +3О2 = 2Сr2О3
· 2Сr + 3S = Сr2S3
· 2Сr + 3Cl2 = 2СrСl3
Задание: составить уравнения реакций хрома с азотом, фосфором, углеродом и кремнием; к одному из уравнений составить электронный баланс, указать окислитель и восстановитель.
Взаимодействие хрома со сложными веществами:
При очень высокой температуре хром реагирует с водой:
· 2Сr + 3 Н2О = Сr2О3 + 3Н2↑
Задание: составить электронный баланс, указать окислитель и восстановитель.
Хром реагирует с разбавленной серной и соляной кислотами:
· Сr + Н2SО4 = СrSО4 + Н2↑
· Сr + 2НСl= СrСl2 + Н2↑
Задание: составить электронный баланс, указать окислитель и восстановитель.
Концентрированные серная соляная и азотная кислоты пассивируют хром.
Соединения хрома. (2)
1. Оксид хрома (2) - СrО – твердое ярко – красное вещество, типичный основной оксид (ему соответствует гидроксид хрома (2) - Сr(ОН)2), не растворяется в воде, но растворяется в кислотах:
· СrО + 2НСl = СrСl2 + Н2О
Задание: составить уравнение реакции в молекулярном и ионном виде взаимодействия оксида хрома (2) с серной кислотой.
Оксид хрома (2) легко окисляется на воздухе:
· 4СrО+ О2 = 2Сr2О3
Задание: составить электронный баланс, указать окислитель и восстановитель.
Оксид хрома (2) образуется при окислении амальгамы хрома кислородом воздуха:
2Сr (амальгама) + О2 = 2СrО
2. Гидроксид хрома (2) - Сr(ОН)2 – вещество желтого цвета, плохо растворимо в воде, с ярко выраженным основным характером, поэтому взаимодействует с кислотами:
· Сr(ОН)2 + Н2SО4 = СrSO4 + 2Н2О
Задание: составить уравнения реакций в молекулярном и ионном виде взаимодействия оксида хрома (2) с соляной кислотой.
Как и оксид хрома (2), гидроксид хрома (2) окисляется:
· 4 Сr(ОH)2 + О2 + 2Н2О = 4Сr(ОН)3
Задание: составить электронный баланс, указать окислитель и восстановитель.
Получить гидроксид хрома (2) можно при действии щелочей на соли хрома (2):
· CrCl2 + 2KOH = Cr(OH)2↓ + 2KCl
Задание: составить ионные уравнения.
Соединения хрома. (3)
1. Оксид хрома (3) - Сr2О3 – порошок темно – зеленого цвета, нерастворим в воде, тугоплавкий, по твёрдости близок к корунду (ему соответствует гидроксид хрома (3) – Сr(ОН)3). Оксид хрома (3) имеет амфотерный характер, однако в кислотах и щелочах растворяется плохо. Реакции со щелочами идут при сплавлении:
· Сr2О3 + 2КОН = 2КСrО2 (хромит К) + Н2О
Задание: составить уравнение реакции в молекулярном и ионном виде взаимодействия оксида хрома (3) с гидроксидом лития.
С концентрированными растворами кислот и щелочей взаимодействует с трудом:
· Сr2О3 + 6 КОН + 3Н2О = 2К3[Сr(ОН)6]
· Сr2О3 + 6НСl = 2СrСl3 + 3Н2О
Задание: составить уравнения реакций в молекулярном и ионном виде взаимодействия оксида хрома (3) с конценрированной серной кислотой и концентрированным раствором гидроксида натрия.
Оксид хрома (3) может быть получен при разложении дихромата аммония:
· (NН4)2Сr2О7 = N2 + Сr2О3 +4Н2О
2. Гидроксид хрома (3) Сr(ОН)3 получают при действии щелочей на на растворы солей хрома (3):
· СrСl3 +3КОН = Сr(ОН)3↓ + 3КСl
Задание: составить ионные уравнения
Гидроксид хрома (3) представляет собой осадок серо – зеленого цвета, при получении которого, щелочь надо брать в недостатке. Полученный таким образом гидроксид хрома (3), в отличие от соответствующего оксида легко взаимодействует с кислотами и щелочами, т.е. проявляет амфотерные свойства:
· Сr(ОН)3 + 3НNО3 = Сr(NО3)3 + 3Н2О
· Сr(ОН)3 + 3КОН = К3[Сr(ОН)6] (гексагидроксохромит К)
Задание: составить уравнения реакций в молекулярном и ионном виде взаимодействия гидроксида хрома (3) с соляной кислотой и гидроксидом натрия.
При сплавлении Сr(ОН)3 со щелочами получаются метахромиты и ортохромиты:
· Cr(OH)3 + KOH = KCrO2 (метахромит К) + 2H2O
· Cr(OH)3 + KOH = K3CrO3 (ортохромит К) + 3H2O
Соединения хрома. (6)
1. Оксид хрома (6) - СrО3 – темно – красное кристаллическое вещество, хорошо растворимо в воде – типичный кислотный оксид. Этому оксиду соответствует две кислоты:
· СrО3 + Н2О = Н2СrО4 (хромовая кислота – образуется при избытке воды)
· СrО3 + Н2О =Н2Сr2О7 (дихромовая кислота – образуется при большой концентрации оксида хрома (3)).
Оксид хрома (6) – очень сильный окислитель, поэтому энергично взаимодействует с органическими веществами:
· С2Н5ОН + 4СrО3 = 2СО2 + 2Сr2О3 + 3Н2О
Окисляет также иод, серу, фосфор, уголь:
· 3S + 4CrO3 = 3SO2 + 2Cr2O3
Задание: составить уравнения химических реакций оксида хрома (6) с йодом, фосфором, углем; к одному из уравнений составить электронный баланс, указать окислитель и восстановитель
При нагревании до 2500С оксид хрома (6) разлагается:
· 4CrO3 = 2Cr2O3 + 3O2
Оксид хрома (6) можно получить при действии концентрированной серной кислоты на твердые хроматы и дихроматы:
· К2Сr2О7 + Н2SО4 = К2SО4 + 2СrО3 + Н2О
2. Хромовая и дихромовая кислоты.
Хромовая и дихромовая кислоты существуют только в водных растворах, образуют устойчивые соли, соответственно хроматы и дихроматы. Хроматы и их растворы имеют желтую окраску, дихроматы – оранжевую.
Хромат - ионы СrО42- и дихромат – ионы Сr2О72- легко переходят друг в друга при изменении среды растворов
В кислой среде раствора хроматы переходят в дихроматы:
· 2К2СrО4 + Н2SО4 = К2Сr2О7 + К2SО4 + Н2О
В щелочной среде дихроматы переходят в хроматы:
· К2Сr2О7 + 2КОН = 2К2СrО4 + Н2О
При разбавлении дихромовая кислота переходит в хромовую кислоту:
· H2Cr2O7 + H2O = 2H2CrO4
Зависимость свойств соединений хрома от степени окисления.
| Степень окисления | +2 | +3 | +6 |
| Оксид | СrО | Сr2О3 | СrО3 |
| Характер оксида | основной | амфотерный | кислотный |
| Гидроксид | Сr(ОН)2 | Сr(ОН)3 – Н3СrО3 | Н2СrО4 Н2Сr2О7 |
| Характер гидроксида | основной | амфотерный | кислотный |
| → ослабление основных свойств и усиление кислотных→ |