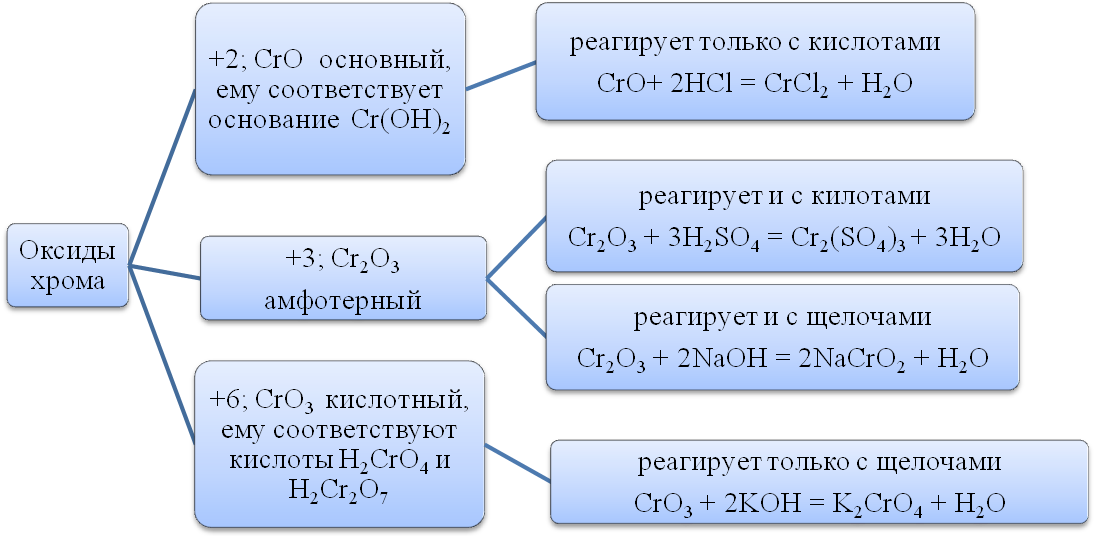
Реакции в кислотной среде.
В кислотной среде соединения Сr+6 переходят в соединения Сr+3 под действием восстановителей: H2S, SO2, FeSO4
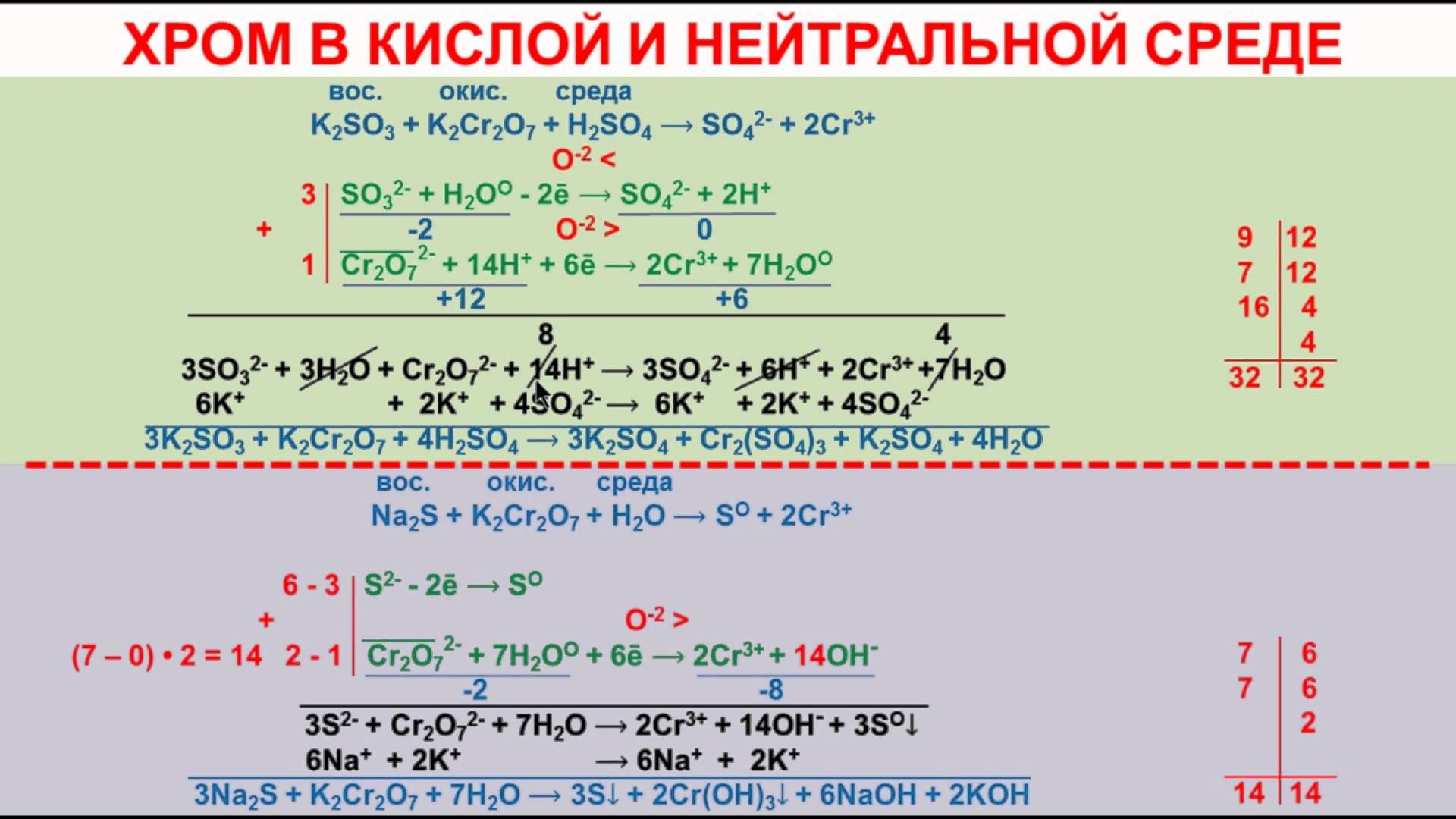
· К2Сr2О7 +3Н2S +4Н2SО4 = 3S + Сr2(SО4)3 + K2SO4+ 7Н2О
· S-2 – 2e → S0
· 2Cr+6 + 6e → 2Cr+3
Задание:
1. Уравнять уравнение реакции методом электронного баланса, указать окислитель и восстановитель:
· Na2CrO4 + K2S + H2SO4 = S + Cr2(SO4)3 + K2SO4 + Na2SO4 + H2O
2. Дописать продукты реакции, уравнять уравнение методом электронного баланса, указать окислитель и восстановитель:
· K2Cr2O7 + SO2 + H2SO4 =? +? +Н2О
Реакции в щелочной среде.
В щелочной среде соединения хрома Сr+3 переходят в соединения Сr+6 под действием окислителей: J2, Br2, Cl2, Ag2O, KClO3, H2O2, KMnO4:
· 2KCrO2 +3 Br2 +8NaOH =2Na2CrO4 + 2KBr +4NaBr + 4H2O
· Cr+3 - 3e → Cr+6
· Br20 +2e → 2Br-
Задание:
Уравнять уравнение реакции методом электронного баланса, указать окислитель и восстановитель:
· NaCrO2 + J2 + NaOH = Na2CrO4 + NaJ + H2O
Дописать продукты реакции, уравнять уравнение методом электронного баланса, указать окислитель и восстановитель:
· Cr(OH)3 + Ag2O + NaOH = Ag +? +?
Таким образом, окислительные свойства последовательно усиливаются с изменением степеней окисления в ряду: Cr+2→ Сr+3 → Сr+6. Соединения хрома (2) - сильные восстановители, легко окисляются, превращаясь в соединения хрома (3). Соединения хрома (6) – сильные окислители, легко восстанавливаются в соединения хрома (3). Соединения хрома (3) при взаимодействии с сильными восстановителями проявляют окислительные свойства, переходя в соединения хрома (2), а при взаимодействии с сильными окислителями проявляют восстановительные свойства, превращаясь в соединеня хрома (6)
2. напишите уравнения химических реакций с помощью которых можно осуществить следующие превращения:
· Cr→ CrCl2→ Cr(OH)2→ Cr(OH)3→ Cr(NO3)3→ Cr2O3→ Cr
· Cr →Cr(NO3)3→ Cr(OH)3→ K3[Cr(OH)6]→ Cr(OH)3→ CrCl3
· Cr2(SO4)3→ Cr(OH)3→ CrCl3
· 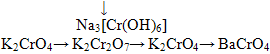















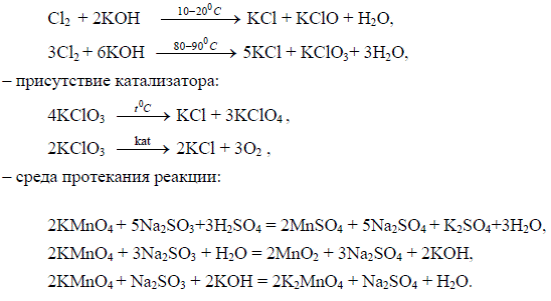
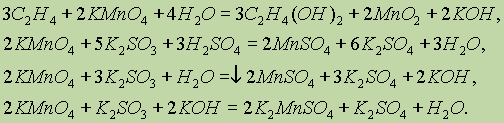



Марганец
Соединения двухвалентного марганца.
Соли двухвалентного марганца можно получить при растворении в разбавленных кислотах:
Mn+2HCl = MnCl2+H2
При растворении в воде образуется гидроксид Mn(II): Mn+2HOH = Mn(OH)2+H2
Гидроксид марганца можно получить в виде белого осадка при действии на растворы солей двухвалентного марганца щелочью:
MnSO4+2NaOH = Mn(OH)2 +NaSO4
Соединения Mn(II) на воздухе неустойчивы, и Mn(OH)2 на воздухе быстро буреет, превращаясь в оксид-гидроксид четырёхвалентного марганца.
2Mn(OH)2+O2 = MnO(OH)2
Гидроксид марганца проявляет только основные свойства и не реагирует со щелочами, а при взаимодействии с кислотами даёт соответствующие соли.
Mn(OH)2+2HCl = MnCl2+2H2O
Оксид марганца может быть получен при разложении карбоната марганца:
MnCO3 = MnO+CO2
Либо при восстановлении диоксида марганца водородом:
MnO2+H2 = MnO+H2O
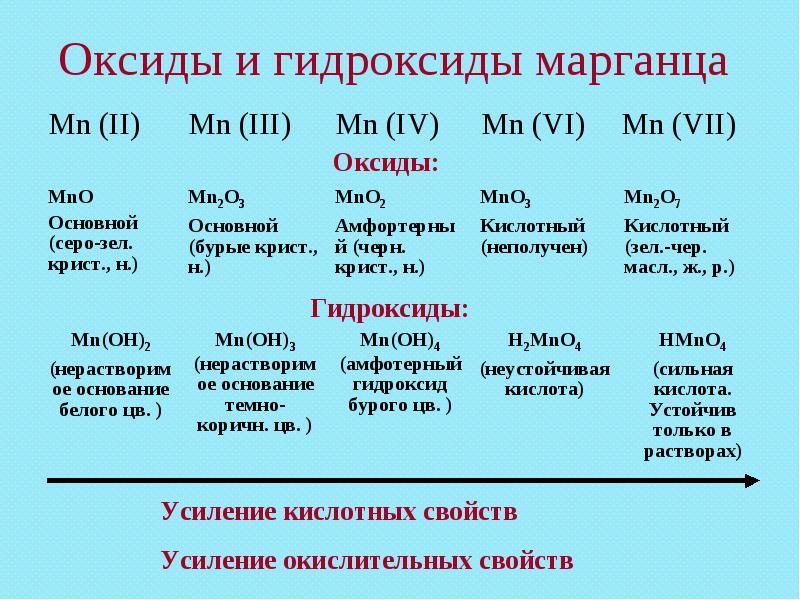
Соединения четырёхвалентного марганца.
Из соединений четырёхвалентного марганца наиболее известен диоксид марганца MnO2 - пиролюзит. Поскольку валентность IV является промежуточной, соединения Mn (VI) образуются как при окислении двухвалентного марганца.
Mn(NO3)2 = MnO2+2NO2
Так и при восстановлении соединений марганца в щелочной среде:
3K2MnO4+2H2O = 2KMnO4+MnO2+4KOH
Последняя реакция является примером реакции самоокисления - самовосстановления, для которых характерно то, что часть атомов одного и того же элемента окисляется, восстанавливая одновременно оставшиеся атомы того же элемента:
Mn6++2e=Mn4+ 1
Mn6+-e=Mn7+ 2
В свою очередь MnО2 может окислять галогениды и галоген водороды, например HCl:
MnO2+4HCl = MnCl2+Cl2+2H2O
Диоксид марганца - твёрдое порошкообразное вещество. Он проявляет как основные, так и кислотные свойства.
Соединения шестивалентного марганца.
При сплавлении MnO2 со щелочами в присутствии кислорода, воздуха или окислителей получают соли шестивалентного Марганца, называемые манганатами.
MnO2+2KOH+KNO3 = K2MnO2+KNO2+H2O
Сама марганцевая кислота, как и соответствующей ей триоксид марганца MnO3, в свободном виде не существует вследствии неустойчивости к процессам окисления - восстановления. Замена протона в кислоте на катион металла приводит к устойчивости манганатов, но их способность к процессам окисления - восствновления сохраняется. Растворы манганатов окрашены в зелёный цвет. При их подкислении образуется марганцеватая кислота,разлагается до соединений марганца четырёхвалентного и семивалентного.
Сильные окислители переводят марганец шестивалентный в семивалентный.
2K2MnO4+Cl22 = 2KMnO4+2KCl
Соединения семивалентного марганца.
В семивалентном состоянии марганец проявляет только окислительные свойства. Среди применяемых в лабораторной практике и в промышленности окислителей широко применяется перманганат калия KMnO2, в быту называемый марганцовкой. Перманганат калия представляет собой кристаллы чёрно-фиолетового цвета. Водные растворы окрашены в фиолетовый цвет, характерный для иона MnO4-.
Перманганаты являются солями марганцевой кислоты, которая устойчива только в разбавленных растворах (до 20%). Эти растворы могут быть получены действием сильных окислителей на соединения марганца двухвалентного:
2Mn(NO3) 2+PbO2+6HNO3 = 2HMnO4+5Pb(NO3) 2+2H2O
При концентрации HMnO4 выше 20% происходит разложение её по уравнению:
4HMnO4 = 4MnO+3O2 +2H2O
Соответствующий марганцевой кислоте марганцевый ангидрид, или оксид марганца (VII), Mn2O7 может быть получен путем воздействия концентрированной серной кислоты на перманганат калия. Этот оксид является ещё более сильным окислителем, чем HMnO4 и KMnO4. Органические соединения при с Mn2O2 самовоспламеняются. При растворении Mn2O2 в воде образуется марганцевая кислота. Из-за неустойчивости и крайне высокой реакционной способности Mn2O2 не применяют, а вместо него используют твердые перманганаты.
В зависимости от среды перманганат калия может восстанавливаться до различных соединений.
При нагревании сухого перманганата калия до температуры выше 200 ОС он разлагается.
2KMnO4 = K2MnO4 + MnO2 + O2
Этой реакцией в лаборатории иногда пользуются для получения кислорода.
Характерные степени окисления марганца: 0, +2, +3, +4, +6, +7 (степени окисления +1, +5 малохарактерны).
При окислении на воздухе пассивируется. Порошкообразный марганец сгорает в кислороде:
{\displaystyle {\mathsf {Mn+O_{2}\rightarrow MnO_{2}}}}
Марганец при нагревании разлагает воду, вытесняя водород:
{\displaystyle {\mathsf {Mn+2H_{2}O{\xrightarrow[{}]{^{o}t}}Mn(OH)_{2}+H_{2}\uparrow }}}При этом слой образующегося гидроксида марганца замедляет реакцию.
Марганец поглощает водород, с повышением температуры его растворимость в марганце увеличивается. При температуре выше 1200 °C взаимодействует с азотом, образуя различные по составу нитриды.
Углерод реагирует с расплавленным марганцем, образуя карбиды Mn3C и другие. Образует также силициды, бориды, фосфиды.{\displaystyle {\mathsf {3Mn+8HNO_{3}\rightarrow 3Mn(NO_{3})_{2}+2NO\uparrow +4H_{2}O}}}
В щелочном растворе марганец устойчив.
Марганец образует следующие оксиды: MnO, Mn2O3, MnO2, MnO3 (не выделен в свободном состоянии) и марганцевый ангидрид Mn2O7.
Mn2O7 в обычных условиях жидкое маслянистое вещество тёмно-зелёного цвета, очень неустойчивое; в смеси с концентрированной серной кислотой воспламеняет органические вещества. При 90 °C Mn2O7 разлагается со взрывом. Наиболее устойчивы оксиды Mn2O3 и MnO2, а также комбинированный оксид Mn3O4 (2MnO·MnO2, или соль Mn2MnO4).
При сплавлении оксида марганца (IV) (пиролюзит) со щелочами в присутствии кислорода образуются манганаты:
{\displaystyle {\mathsf {2MnO_{2}+4KOH+O_{2}\rightarrow 2K_{2}MnO_{4}+2H_{2}O}}}Раствор манганата имеет тёмно-зелёный цвет. При подкислении протекает реакция:
{\displaystyle {\mathsf {3K_{2}MnO_{4}+3H_{2}SO_{4}\rightarrow 3K_{2}SO_{4}+2HMnO_{4}+MnO(OH)_{2}\downarrow +H_{2}O}}}Раствор окрашивается в малиновый цвет из-за появления аниона MnO4−, и из него выпадает коричневый осадок оксида-гидроксида марганца (IV).
Марганцевая кислота очень сильная, но неустойчивая, её невозможно сконцентрировать более, чем до 20 %. Сама кислота и её соли (перманганаты) — сильные окислители. Например, перманганат калия в зависимости от pH раствора окисляет различные вещества, восстанавливаясь до соединений марганца разной степени окисления. В кислой среде — до соединений марганца (II), в нейтральной — до соединений марганца (IV), в сильно щелочной — до соединений марганца (VI).
При прокаливании перманганаты разлагаются с выделением кислорода (один из лабораторных способов получения чистого кислорода). Реакция идёт по уравнению (на примере перманганата калия):
{\displaystyle {\mathsf {2KMnO_{4}{\xrightarrow[{}]{^{0}t}}K_{2}MnO_{4}+MnO_{2}+O_{2}}}}Под действием сильных окислителей ион Mn2+ переходит в ион MnO4−:
{\displaystyle {\mathsf {2MnSO_{4}+5PbO_{2}+6HNO_{3}\rightarrow 2HMnO_{4}+2PbSO_{4}+3Pb(NO_{3})_{2}+2H_{2}O}}}Эта реакция используется для качественного определения Mn2+ (см. в разделе «Определение методами химического анализа»).
При подщелачивании растворов солей Mn (II) из них выпадает осадок гидроксида марганца (II), быстро буреющий на воздухе в результате окисления. Подробное описание реакции см. в разделе «Определение методами химического анализа».
Соли MnCl3, Mn2(SO4)3 неустойчивы. Гидроксиды Mn(OH)2 и Mn(OH)3 имеют основный характер, MnO(OH)2 — амфотерный. Хлорид марганца (IV) MnCl4 очень неустойчив, разлагается при нагревании, чем пользуются для получения хлора:
{\displaystyle {\mathsf {MnO_{2}+4HCl\rightarrow MnCl_{2}+Cl_{2}\uparrow +2H_{2}O}}}Нулевая степень окисления у марганца проявляется в соединениях с σ-донорными и π-акцепторными лигандами. Так, для марганца и известен карбонил состава Mn2(CO)10.
Известны и другие соединения марганца с σ-донорными и π-акцепторными лигандами (PF3, NO, N2, P(C5H5)3).
Определение методами химического анализа
Марганец принадлежит к пятой аналитической группе катионов.
Специфические реакции, используемые в аналитической химии для обнаружения катионов Mn2+, следующие:
1. Едкие щёлочи с солями марганца (II) дают белый осадок гидроксида марганца (II):
{\displaystyle {\mathsf {MnSO_{4}+2KOH\rightarrow Mn(OH)_{2}\downarrow +K_{2}SO_{4}}}}{\displaystyle {\mathsf {Mn^{2+}+2OH^{-}\rightarrow Mn(OH)_{2}\downarrow }}}Осадок на воздухе меняет цвет на бурый из-за окисления кислородом воздуха.
Выполнение реакции. К двум каплям раствора соли марганца добавляют две капли раствора щёлочи. Наблюдают изменение цвета осадка.
2. Пероксид водорода в присутствии щёлочи окисляет соли марганца (II) до тёмно-бурого соединения марганца (IV):
{\displaystyle {\mathsf {MnSO_{4}+H_{2}O_{2}+2NaOH\rightarrow MnO(OH)_{2}\downarrow +Na_{2}SO_{4}+H_{2}O}}}{\displaystyle {\mathsf {Mn^{2+}+H_{2}O_{2}+2OH^{-}\rightarrow MnO(OH)_{2}\downarrow +H_{2}O}}} Выполнение реакции. К двум каплям раствора соли марганца добавляют четыре капли раствора щёлочи и две капли раствора H2O2.
3. Диоксид свинца PbO2 в присутствии концентрированной азотной кислоты при нагревании окисляет Mn2+ до MnO4− с образованием марганцевой кислоты малинового цвета:
{\displaystyle {\mathsf {2MnSO_{4}+5PbO_{2}+6HNO_{3}\rightarrow 2HMnO_{4}+2PbSO_{4}\downarrow +3Pb(NO_{3})_{2}+2H_{2}O}}}{\displaystyle {\mathsf {2Mn^{2+}+5PbO_{2}+4H^{+}\rightarrow 2MnO_{4}^{-}+5Pb^{2+}+2H_{2}O}}}Эта реакция даёт отрицательный результат в присутствии восстановителей, например хлороводородной кислоты и её солей, так как они взаимодействуют с диоксидом свинца, а также с образовавшейся марганцевой кислотой. При больших количествах марганца провести эту реакцию не удаётся, так как избыток ионов Mn2+восстанавливает образующуюся марганцевую кислоту HMnO4 до MnO(OH)2, и вместо малиновой окраски появляется бурый осадок. Вместо диоксида свинца для окисления Mn2+ в MnO4− могут быть использованы другие окислители, например, персульфат аммония (NH4)2S2O8 в присутствии катализатора — ионов Ag+ или висмутата натрия NaBiO3:
{\displaystyle {\mathsf {2MnSO_{4}+5NaBiO_{3}+16HNO_{3}\rightarrow 2HMnO_{4}+5Bi(NO_{3})_{3}+NaNO_{3}+2Na_{2}SO_{4}+7H_{2}O}}} Выполнение реакции. В пробирку вносят стеклянным шпателем немного PbO2, а затем 5 капель концентрированной азотной кислоты HNO3 и нагревают смесь на кипящей водяной бане. В нагретую смесь добавляют 1 каплю раствора сульфата марганца (II) MnSO4 и снова нагревают 10—15 мин, встряхивая время от времени содержимое пробирки. Дают избытку диоксида свинца осесть и наблюдают малиновую окраску образовавшейся марганцевой кислоты.
При окислении висмутатом натрия реакцию проводят следующим образом. В пробирку помещают 1—2 капли раствора сульфата марганца (II) и 4 капли 6 н. HNO3, добавляют несколько крупинок висмутата натрия и встряхивают. Наблюдают появление малиновой окраски раствора.
4. Сульфид аммония (NH4)2S осаждает из раствора солей марганца сульфид марганца (II), окрашенный в телесный цвет:
{\displaystyle {\mathsf {MnSO_{4}+(NH_{4})_{2}S\rightarrow MnS\downarrow +(NH_{4})_{2}SO_{4}}}}{\displaystyle {\mathsf {Mn^{2+}+S^{2-}\rightarrow MnS\downarrow }}}Осадок легко растворяется в разбавленных минеральных кислотах и даже в уксусной кислоте.
Выполнение реакции. В пробирку помещают 2 капли раствора соли марганца (II) и добавляют 2 капли раствора сульфида аммония