«Строение электронных оболочек атомов»
1. Заполните таблицу. Определите элемент и его электронную формулу.
| Распределение электронов по энергетическим уровням | Элемент | Электронная формула |
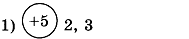
| ||

| ||
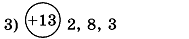
|
Атомы каких элементов будут обладать сходными свойствами? Почему?
2. Напишите электронные формулы элементов кислорода и натрия. Укажите для каждого элемента:
а) общее число энергетических уровней в атоме,
б) число заполненных энергетических уровней в атоме,
в) число электронов на внешнем энергетическом уровне.
3. Выберите правильные утверждения:
а) максимальное число электронов на внешнем энергетическом уровне атомов любого элемента равно номеру группы,
б) максимальное число электронов во втором энергетическом уровне равно восьми,
в) общее число электронов в атомах любого элемента равно порядковому номеру элемента.
1. Заполните таблицу. Определите элемент и его электронную формулу.
| Распределение электронов по энергетическим уровням | Элемент | Электронная формула |
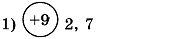
| ||
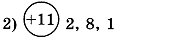
| ||
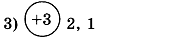
|
Атомы каких элементов будут обладать сходными свойствами? Почему?
2. Напишите электронные формулы элементов углерода и аргона. Укажите для каждого элемента:
а) общее число энергетических уровней в атоме,
б) число заполненных энергетических уровней в атоме,
в) число электронов на внешнем энергетическом уровне.
3. Выберите правильные утверждения:
а) число энергетических уровней в атомах элементов равно номеру периода,
б) общее число электронов в атоме химического элемента равно номеру группы,
в) число электронов на внешнем уровне атомов элементов одной группы главной подгруппы одинаково.
1. Заполните таблицу. Определите элемент и его электронную формулу.
| Распределение электронов по энергетическим уровням | Элемент | Электронная формула |
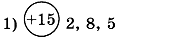
| ||
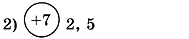
| ||

|
Атомы каких элементов будут обладать сходными свойствами? Почему?
2. Напишите электронные формулы элементов хлора и бора. Укажите для каждого элемента:
а) общее число энергетических уровней в атоме,
б) число заполненных энергетических уровней в атоме,
в) число электронов на внешнем энергетическом уровне.
3. Выберите правильные утверждения:
а) атомы элементов одного периода содержат одинаковое число энергетических уровней,
б) максимальное число электронов на s -орбитале равно двум,
в) сходными свойствами обладают атомы химических элементов с одинаковым числом энергетических уровней.
1. Заполните таблицу. Определите элемент и его электронную формулу.
| Распределение электронов по энергетическим уровням | Элемент | Электронная формула |
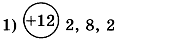
| ||

| ||
|
Атомы каких элементов будут обладать сходными свойствами? Почему?
2. Напишите электронные формулы элементов алюминия и неона. Укажите для каждого элемента:
а) общее число энергетических уровней в атоме,
б) число заполненных энергетических уровней в атоме,
в) число электронов на внешнем энергетическом уровне.
3. Выберите правильные утверждения:
а) во всех энергетических уровнях может содержаться до восьми электронов,
б) изотопы одного химического элемента имеют одинаковые электронные формулы,
в) максимальное число электронов на р -орбитале равно шести.
Тест: "Строение атома"
1. Протоны являются частицами:
- с положительным зарядом +1
- незаряженными
- с отрицательным зарядом – 1
2. Положительный заряд ядра равен:
- числу протонов
- числу электронов
- числу нейтронов
3. Положительный заряд ядра атома равен:
- порядковому номеру химического элемента
- молекулярной массе
- группе в таблице Менделеева
4. Формулой массового числа атомов является:
- A = Z + N
- A= Z – N
- Z= A + N
5. Сколько нейтронов и протонов содержит атом алюминия:
- 13 протонов и 14 нейтронов
- 27 протонов и 13 нейтронов
- 27 протонов и 14 нейтронов
6. Атом является:
- электронейтральной частицей
- электроположительной частицей
- электроотрицательной частицей
7. Число электронов равняется:
- числу протонов в ядре
- числу нейтронов в ядре
- сумме двух протонов в ядре
8. Сера содержит в атоме:
- 16 протонов и 16 электронов
- 32 протона и 16 электронов
- 16 протонов и 32 электрона
9. Масса электрона равна:
- 1/1837 массы протона
- 1/1532 массы протона
- 1/1645 массы нейтрона
тест 10. Ядро имеет:
- положительный заряд
- отрицательный заряд
- не имеет заряда
11. Изотопами являются:
- разновидности атомов одного и того же элемента, которые имеют одинаковый заряд ядра, но разные массовые числа
- разновидности атомов одного и того же элемента, которые имеют одинаковый заряд ядра и массовые числа
- разновидности атомов одного и того же элемента, которые имеют одинаковые массовые числа, но разные заряды ядра
12. Изотопы отличаются лишь только числом:
- нейтронов
- электронов
- протонов
13. Изотопы в таблице Менделеева:
- занимают одно место
- находятся в разных местах
- находятся в разных местах, но в одной и той же группе
14. Массовое число указывают:
- вверху слева от символа элемента
- вверху справа от символа элемента
- внизу слева от символа элемента
15. Заряд ядра указывают:
- внизу слева от символа элемента
- внизу справа от символа элемента
- вверху справа от символа элемента
16. Содержание в природе изотопа хлора с массовым числом 35:
- 75.5 %
- 60.5 %
- 25. 5 %
17. Содержание в природе изотопа хлора с массовым числом 37:
- 24.5 %
- 65.5 %
- 30.5 %
18. В медицине барий – 137 применяют для:
- диагностики заболеваний пищеварительной системы
- измерения скорости тока крови и изучения заболеваний крови
- диагностики заболеваний щитовидной железы
19. В медицине кобальт – 60 применяют для:
- лечения рака
- измерения скорости тока крови и изучения заболеваний крови
- диагностики заболеваний пищеварительной системы
тест-20. Чем ближе к ядру расположены электроны, тем:
- сильнее их связь с ядром, но меньше резерв энергии
- слабее их связь с ядром, но больше резерв энергии
- слабее их связь с ядром и меньше резерв энергии
21. По мере удаления от ядра атома:
- мощность притяжения электрона к ядру уменьшается, а резерв энергии увеличивается
- мощность притяжения электрона к ядру увеличивается, а резерв энергии уменьшается
- мощность притяжения электрона к ядру уменьшается и резерв энергии тоже уменьшается
22. Электроны внешнего энергетического уровня:
- имеют максимальный резерв энергии и наименее прочную связь с ядром
- имеют минимальный резерв энергии и наиболее прочную связь с ядром
- имеют минимальный резерв энергии и наименее прочную связь с ядром
23. Формулой для определения максимального числа электронов, которые могут находиться на том или ином энергетическом уровне является:
- N = 2n^2
- N = 2n^3
- N = 3n^2
24. На внешнем энергетическом уровне может находиться не более:
- восьми электронов
- десяти электронов
- шести электронов
25. Завершенный энергетический уровень характеризуется:
- содержанием максимального числа электронов
- содержанием минимального числа электронов
- содержанием минимального числа нейтронов
26. Незавершенный энергетический уровень характеризуется:
- не содержанием максимального числа электронов
- содержанием максимального числа протонов
- не содержанием максимального числа нейтронов
27. На первом энергетическом уровне у гелия содержится:
- два электрона
- четыре электрона
- восемь электронов
28. Атом азота на внешнем энергетическом уровне имеет:
- пять электронов
- шесть электронов
- семь электронов
29. Заряд у ядра атома является:
- + 11
- + 10
- + 15
тест_30. Атомы металлов способны:
- отдавать электроны другим атомам
- принимать электроны от других атомов
- не принимают и не отдают электроны
31. Если легче атомы отдают электроны с внешнего уровня, то:
- в большей мере выражены металлические свойства
- в меньшей мере выражены металлические свойства
- металлические свойства не выражены
32. Атомы неметаллов способны:
- как присоединять, так и отдавать электроны
- только присоединять электроны
- только отдавать электроны
33. Если легче атомы принимают электроны с внешнего уровня, то:
- в большей степени выражены неметаллические свойства
- в меньшей степени выражены неметаллические свойства
- в большей степени выражены металлические свойства
34. Благородными газами являются:
- атомы неметаллов, имеющие завершенный энергетический уровень
- атомы металлов, имеющие завершенный энергетический уровень
- атомы неметаллов, имеющие незавершенный энергетический уровень
35. Благородные газы не обладают способностью:
- принимать электроны
- отдавать электроны
- отдавать протоны