(уравнение Менделеева –Клапейрона)
Состояние газа однозначно задается тремя макроскопическими параметрами: давлением, объемом и температурой. Мы знаем, что горячий воздух поднимается вверх. С увеличением температуры он становится легче – уменьшается плотность, увеличивается расстояние между молекулами. То есть происходит расширение – увеличение объема. Можно сделать вывод, что объем и температура газа связаны. Если сдавить воздушный шарик, то внутри него увеличится давление. То есть объем газа также связан с давлением. Получается, что давление, объем и температура газа связаны между собой. Попробуем понять, как именно.
Мы работаем с моделью идеального газа, которая описывает реальный газ достаточно точно для решения многих задач. Мы уже получили для идеального газа основное уравнение МКТ, с помощью которого связали давление с микропараметрами – массой и средней скоростью одной молекулы: 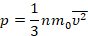
Это уравнение – решение задачи в модели механики. Мы приняли, что газ состоит из хаотично движущихся молекул – и вычислили, как они действуют на стенку, какое давление создают, когда с ней сталкиваются. Но мы не измеряем скорости и массы отдельных молекул. На макроуровне мы умеем измерять температуру, которую мы связали со средней кинетической энергией молекул, а значит, и с микропараметрами: массой и средней скоростью одной молекулы: 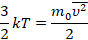
Подставив кинетическую энергию из одного уравнения в другое, получили: 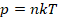
В таком виде применять уравнение для решения задач все еще не удобно. Для измерения давления газа существуют различные приборы (манометры, барометры), для измерения температуры – термометры. Но мы не можем напрямую измерять концентрацию – количество частиц в единице объема. Преобразуем уравнение до удобного вида. Концентрация – это, по определению,  :
: 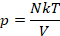
А количество молекул удобнее представить через количество вещества. Мы помним, что в одном моле вещества 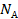 молекул. Значит,
молекул. Значит, 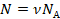 :
: 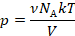
Договоримся: чтобы каждый раз не перемножать постоянные величины 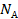 на
на 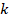 , сделаем это один раз, а произведение обозначим
, сделаем это один раз, а произведение обозначим 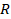 :
: 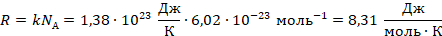
Это значение назвали универсальной газовой постоянной, почему – станет понятно чуть позже. Умножим обе части уравнения на объем и перепишем: 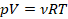
Получили уравнение, которое связывает три макропараметра идеального газа, которые легко измерить: объем, температуру и давление. И если взять какое-то определенное количество газа 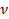 , эти три параметра однозначно зададут его состояние, неизвестных в уравнении не останется. Поэтому это уравнение назвали уравнением состояния идеального газа, или иначе уравнением Менделеева – Клапейрона. А на случай, если нам неудобно пользоваться количеством вещества в молях, можно его выразить через массу вещества:
, эти три параметра однозначно зададут его состояние, неизвестных в уравнении не останется. Поэтому это уравнение назвали уравнением состояния идеального газа, или иначе уравнением Менделеева – Клапейрона. А на случай, если нам неудобно пользоваться количеством вещества в молях, можно его выразить через массу вещества: 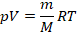
Именно в этом виде его чаще всего и записывают. Мы начали с движения молекул, придумали инструменты для его описания, а в итоге получили уравнение, которое связывает поддающиеся непосредственному измерению макропараметры.
Решим задачу.
Задача 1. Какое давление должен выдерживать газовый баллон объемом 50 л, чтобы при температуре 25 ˚С в нем можно было хранить 2 кг метана (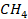 )?
)?
Анализ условия. В задаче сказано о метане – это газ, в баллоне не создается экстремальных условий, температура комнатная, так что будем описывать его с помощью модели идеального газа. Речь идет о связи трех макропараметров газа, поэтому будем применять уравнение состояния идеального газа.
Физическая часть решения: В условии задана масса газа, поэтому запишем уравнение состояния идеального газа в том виде, в котором есть масса: 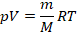
Все величины известны, осталось только найти молярную массу метана (ее можно найти, зная состав его молекулы, см. рис. 1), перевести значения величин в СИ и получить ответ. На выборе уравнения физика закончилась, осталось решить простое уравнение. Выразим давление: 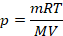

Рис. 1. Углерод и водород в таблице Менделеева
Молекула метана состоит из одного атома углерода с относительной атомной массой 12 (смотрим в таблице Менделеева) и четырех атомов водорода с относительной атомной массой 1. Тогда: 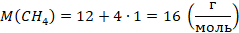
Будем использовать в СИ: 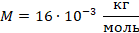
1 л – это 1 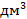 или в СИ
или в СИ 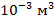 . Значит, объем баллона в СИ будет равен
. Значит, объем баллона в СИ будет равен 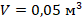 .
.
Температуру выразим в кельвинах: 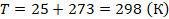
Вычислим давление: 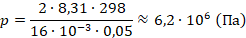
Получили ответ: давление около 6,2 МПа, что в 62 раза больше атмосферного. Задача решена.
Во многих задачах берется некоторое фиксированное количество газа и рассматривается изменение его состояния. Это значит, что в рамках таких задач количество вещества постоянно (как и масса, смотря в чем выразим). Можно все постоянные перенести в одну часть уравнения, а три изменяющихся параметра состояния – в другую: 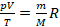 или
или 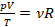
Если взять 1 моль любого газа (одноатомного аргона, углекислого газа, водяного пара – лишь бы к нему была применима модель идеального газа), выражение 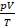 будет равно постоянной
будет равно постоянной 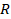 . Поэтому эта постоянная и названа универсальной. Но даже если мы возьмем произвольную, но – что важно – фиксированную массу газа, выражение
. Поэтому эта постоянная и названа универсальной. Но даже если мы возьмем произвольную, но – что важно – фиксированную массу газа, выражение 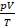 для этой массы газа будет постоянным:
для этой массы газа будет постоянным: 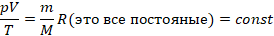
Или, по-другому, если газ переходит из одного состояния с параметрами 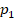 ,
, 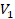 ,
, 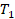 в состояние с параметрами
в состояние с параметрами 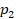 ,
, 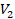 ,
, 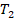 , то можем записать:
, то можем записать: 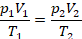
В таком виде или в виде 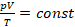 это уравнение называют уравнением Клапейрона, хотя это то же уравнение состояния, записанное немного иначе.
это уравнение называют уравнением Клапейрона, хотя это то же уравнение состояния, записанное немного иначе.
Задача 2. При сжатии воздуха в цилиндре дизельного двигателя объем воздуха уменьшается в 15 раз, а температура повышается от 47 до 620 ˚С. Каково давление воздуха в конце сжатия, если в начале сжатия давление воздуха было равно атмосферному (100 кПа)?
Анализ условия. В задаче описано изменение состояния воздуха, будем его описывать с помощью модели идеального газа – температура сотни градусов по Цельсию это позволяет. Состояние газа описано тремя макропараметрами (давлением, температурой и объемом), причем изменяются все три макропараметра, это не изопроцесс. При этом ничего об утечках воздуха из цилиндра ничего не сказано, значит, количество воздуха не изменяется. Будем применять уравнение Клапейрона.
Физическая часть решения. Запишем уравнение в виде, удобном для описания перехода из состояния 1 в состояние 2: 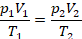
Температуры заданы (нужно только перевести их в кельвины), давление тоже. Что сказано об объеме – перепишем условие в математическом виде. Объем уменьшился в 15 раз, это значит, что в состоянии 2 объем в 15 раз меньше, чем в состоянии 1: 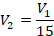
Получили простую систему уравнений, решим ее – это будет математическая часть решения. Подставим второе давление: 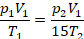
Выразим давление во втором состоянии: 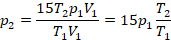
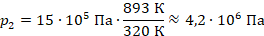
Получили ответ: 4,2 МПа (или 42 атмосферы).
Задача 3. После повышения температуры на 15 К давление газа в закрытом баллоне увеличилось на 3 %. Какой была начальная температура?
Анализ условия. В задаче описано изменение состояния газа. За неимением другой информации будем применять модель идеального газа. Речь идет о закрытом баллоне. Это значит, во-первых, что масса газа постоянна, а, во-вторых, баллоны обычно жесткие, значит, и объем не изменяется. Поэтому можем описать процесс как изохорный.
Физическая часть решения. Запишем уравнение для изохорного процесса: 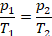
Перепишем условие в математическом виде, чтобы можно было подставлять в уравнение. Температура увеличилась на 15 К, значит, 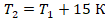 .
.
А давление увеличилось на 3 %, это по-другому можно записать: 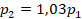
Физика здесь закончилась на выборе закона, которым описывать процесс, осталось подставить переписанные величины и решить уравнение: 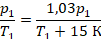
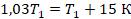
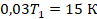
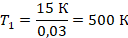
Нашли начальную температуру, она равна 500 К. Или, в более привычных для нас градусах Цельсия, 227 ˚С.
2. Для закрепления материала посмотрите видео по ссылкам:
https://www.youtube.com/watch?v=N8RpIGy_6OA - Уравнение состояния идеального газа
https://www.youtube.com/watch?v=OUDQg771K9M - Измерение скоростей молекул газа
3. Решите задачу: Определите температуру газа, если средняя кинетическая энергия поступательного движения одной молекулы равна 6,9·10-21 Дж.