Химия 9 класс
Классная работа за 31.03
Решение расчетных задач
Повторить формулы основных величин
Физические величины, используемые при решении задач данного типа
| наименование величины | обозначение | единица измерения | пример формы записи | можно найти по формулам |
| масса вещества | m | мг; г; кг | m (H2O) = 15 г | m= М· ν m= ρ · М m= N/ NA · М m= V/ Vm· М mраств. в-ва= ω · mраствора mраствора = mраств. в-ва/ ω m = V · ρ |
| количество вещества | ν(ню) или n | моль | ν(CH4) = 1,2 моль | ν = m/ М ν = V/ Vm ν = N/ NA |
| объём вещества (1 моль любого газа при нормальных условиях занимает 22,4 л) | V | мл; л; м3 | V(O2) = 10 л | V = Vm· ν V=(m/ М) · Vm V = m/ ρ |
| молярный объём (нормальные условия) | Vm | л/моль; м3/моль | Vm= 22,4 л/моль | Vm= V/ ν Vm= М/ ρ Vm= V· (М/ m) |
| плотность вещества | ρ(ро) | г/мл; г/см3; кг/м3 | ρ(H2O) = 1 г/мл | ρ = m/ V ρ = М/ Vm ρгаза = Мгаза/ Vm |
| относительная плотность | D | безразмерная | D H2 = 16 | Dгаза по H2 = Мгаза/ 2 г/моль Dгаза по воздуху = Мгаза/ 29 г/моль |
| массовая доля вещества в растворе или в смеси | ω(омега) | безразмерная или в % | ω (С) = 0,45 или 45% | ω = mраств. в-ва/ mраствора |
| массовая доля элемента в соединении (веществе) | ω(омега) | безразмерная или в % | ω (С) = 0,45 или 45% | ω = n Ar/ Mr, где n – число атомов элемента в соединении |
| массовая доля чистого вещества | ω(омега) | безразмерная или в % | ω (СО2) = 0,25 или 25% | ωчист.в-ва = mчист.в-ва/ mсмеси |
Записать алгоритм в классную работу
Алгоритм вычисления массы (объёма) продукта реакции по известной массе или объёму исходного вещества, содержащего примеси
| ПОСЛЕДОВАТЕЛЬНОСТЬ ДЕЙСТВИЙ | ПРИМЕР ВЫПОЛНЕНИЯ ДЕЙСТВИЙ |
| 1.Прочитайте текст задачи. | 1.Сколько граммов оксида кальция можно получить из 400г известняка, содержащего 20% примесей? |
| 2.Запишите условие и требование задачи с помощью общепринятых обозначений. |  2.Дано:
m(CаСO3) = 400 г
ω прим.= 20% (0,2) 2.Дано:
m(CаСO3) = 400 г
ω прим.= 20% (0,2)
  m(CаO)=?
m(CаO)=?
|
| 3.Составьте уравнение химической реакции. | 3.Решение: CаСO3 = CаО + СO2 |
| 4.Массу чистого вещества (как и объём) можно вычислить двумя способами 1 способ: ω (чист.вещ-ва)= 100% - ω прим. ω (чист.вещ-ва) = m (чист.вещества) / m (смеси) Отсюда: m (чист.вещ-ва) = m (смеси) · ω (чист.вещ-ва) 2 способ: m (примеси) = m (смеси) · ω (примеси) m (чист.вещества) = m (смеси) - m (примеси) | 4.Решение: 1 способ: ω (чист.вещества) CаСO3= 100% - 20% = 80% или 0,8 m (чист.вещества) CаСO3= 400г · 0,8 = 320 г 2 способ: m (примеси) = 400 г · 0,2 = 80 г m (чист.вещества) CаСO3= 400 г – 80 г = 320 г Выбирай понятный для тебя способ решения! |
| 5. В уравнении одной чертой подчеркните формулы веществ, о которых идёт речь в задаче. | 5. CаСO 3 = CаО + СO2 |
| 6. Вычислите молярные массы этих веществ. | 6. М(CаСO3) = 40 + 12 + 16·3 = 100 г/моль М(СaO) = 40 + 16 = 56 г/моль |
| 7.Массу чистого вещества, полученную в пункте 4, переведите в количество вещества по формуле ν= m/М | 7. ν (CаСO3)= 320 г/100 г/моль = 3,2 моль |
| 8.Над подчёркнутой формулой известного вещества укажите величину, полученную в пункте 7, - показывает количество взятого реагента по условию задачи, над формулой вещества, массу которого надо найти, поставим Хмоль. | 8. 3,2 моль Хмоль CаСO 3 = CаО + СO2 |
| 9. Под подчёркнутыми формулами исходного и образующегося веществ укажите количество вещества (число молей) согласно уравнению реакции (это будут коэффициенты, стоящие перед формулами веществ в уравнении реакции) - показывают необходимые количества исходного и образующегося веществ. | 9. 3,2 моль Хмоль CаСO 3 = CаО + СO2 1моль 1моль |
| 10.Составить и решить пропорцию. | 10.
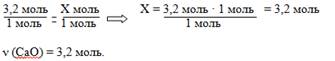
|
| 11.Вычислите массу продукта реакции m(вещества)= ν(вещества) · М(вещества | 11. m(СаО) =3,2 моль · 56 г/моль = 179,2 г |
| 12.Запишите ответ. | 12.Ответ: m(CаО) = 179,2 г. |
| Метод пропорций | |
| 1. Повторить действия пунктов 1 – 6 количественного метода | |
| 2. По формуле m= М · ν(где ν –коэффициент перед соответствующей формулой вещества в уравнении реакции) найдите массу вещества | m= М · ν m(CаСO3) = 100 г/моль · 1 моль = 100 г m(СaO) = 56 г/моль · 1 моль = 56 г |
| 3. Над подчёркнутой формулой известного вещества укажите массу, полученную в пункте 4 количественного метода, над формулой вещества, массу которого надо найти, поставим Хг | 3. 320 г Хг CаСO 3 = CаО + СO2 |
| 4. Под соответствующей формулой записать массу, полученную в пункте 3 | 4. 320 г Хг CаСO 3 = CаО + СO2 100 г 56 г |
| 5. Составить и решить пропорцию | 5.
 320 г = Х г Х = 320 г · 56 г = 179,2 г
100 г 56 г 100 г 320 г = Х г Х = 320 г · 56 г = 179,2 г
100 г 56 г 100 г
|
| 6.Запишите ответ. | 6.Ответ: m(CаО) = 179,2 г. |