ЛАБОРАТОРНАЯ РАБОТА № 3.
ХИМИЧЕСКОЕ РАВНОВЕСИЕ
Цель работы. Изучение химического равновесия на примере обратимых реакций, протекающих в водных растворах, а также экспериментальное подтверждение принципа Ле-Шателье.
Приборы и реактивы
Пробирки, стеклянные палочки, шпатели, пробиркодержатели, растворы FeCl3 (конц.), КSCN или NH4SCN (конц.), K2Cr2O7 (10 %-й), NaOH (конц.), H2SO4 (конц.), раствор крахмала, йодная вода, кристаллический КCl или NH4Cl.
Опыт 1. Влияние концентрации реагирующих веществ на химическое равновесие
В данном опыте изучают обратимую реакцию взаимодействия хлорида железа(III) с тиоцианатом калия (аммония):
FeCl3 + 6КSCN <=> К3[Fe(SCN)6] + 3КCl.
Образующееся в результате реакции комплексное соединение гексатиоцианатоферрат (III) калия придает красную окраску раствору. По интенсивности данной окраски можно судить об изменении концентрации участвующих в реакции веществ, т. е. о направлении смещения химического равновесия.
Ход работы
1. В пробирку добавьте по 1-2 капли концентрированных растворов хлорида железа (III) и тиоцианата калия, наблюдайте образование насыщенного кроваво-красного раствора комплексной солиК3[Fe(SCN)6].
2. Разбавьте К3[Fe(SCN)6] дистиллированной водой до получения красного прозрачного раствора и разделите на 4 пробирки. В первую добавьте несколько кристалликов или концентрированный раствор хлорида железа (III), во вторую – концентрированный раствора тиоцианата калия, в третью – несколько кристалликов хлорида калия.
3. Сравните интенсивность окраски полученных растворов в трёх пробирках с интенсивностью окраски в эталонной пробирке. Результаты наблюдений внесите в таблицу 5.
Таблица 5
Опытные данные для определения смещения равновесия
| № пробирки | Что добавлено | Изменение окраски раствора | Смещение равновесия |
| FeCl3 | |||
| КCNS | |||
| КCl |
4. На основании уравнения реакции между FeCl3 и КSCN запишите выражение константы равновесия для данной системы. Сделайте вывод о влиянии концентрации веществ, участвующих в реакции, на её равновесие. Дайте объяснения на основании принципа Ле-Шателье.
Опыт 2. Влияние реакции среды на смещение равновесия
В данном опыте изучают влияние реакции среды (концентрации ионов водорода) на смещение равновесия.
В растворах, содержащих хром (VI), имеет место равновесие:
2CrO42- + 2H+ <=> H2O + Cr2O72-.
хромат-ион дихромат-ион
(желтый) (оранжевый)
Ход работы
1. В пробирку налейте 1 мл раствора K2Cr2O7, добавьте по каплям концентрированный раствор щелочи. Наблюдайте изменение окраски.
2. Когда раствор станет желтым, добавьте по каплям концентрированную серную кислоту. Наблюдайте появление оранжевой окраски.
Сделайте вывод о влиянии концентрации ионов водорода на смещение равновесия. Какой из ионов, содержащих хром (VI), устойчив в кислых средах, а какой – в щелочных и нейтральных?
Опыт 3. Влияние температуры на химическое равновесие
При действии йода на крахмал образуется непрочный адсорбционный комплекс сложного состава, окрашенный в синий цвет. Эта реакция является экзотермической. Равновесие реакции можно условно изобразить следующим уравнением:
крахмал + иод <=> окрашенное соединение, DН<0.
Ход работы
1. Налейте в пробирку 1-2 мл раствора крахмала, добавьте каплю йодной воды до появления синей окраски.
2. Содержимое пробирки нагрейте почти до кипения.
Объясните, почему при нагревании окраска становится менее интенсивной или совсем исчезает? Дайте объяснение с позиций принципа Ле-Шателье.
ЛАБОРАТОРНАЯ РАБОТА № 9.
СКОРОСТЬ ХИМИЧЕСКОЙ РЕАКЦИИ
Цель работы: экспериментальное изучение влияния различных факторов на скорость химической реакции и определение энергии активации.
Приборы и реактивы: цилиндры ёмкостью 10 и 25 мл; растворы Na2S2O3 (0,1н), серной кислоты (2н); штатив с пробирками; термометр; секундомер; водяная баня.
Опыт 1. Влияние концентрации реагирующих веществ на скорость химической реакции. Закон действующих масс
Зависимость скорости реакции от концентрации реагирующих веществ можно исследовать на примере взаимодействия серной кислоты с тиосульфатом натрия, в результате чего образуется сера, выделяющаяся в виде мути: H2SO4 + Na2S2O3 = Na2SO4 + H2O + SO2 + S↓
Время от начала реакции до появления первых следов мути зависит от скорости этой реакции.
С помощью цилиндров возьмите необходимые объёмы растворов тиосульфата натрия, серной кислоты и воды согласно таблице 1. Смешивание растворов проводите в пробирке, при этом учтите, что кислота вводится в реакционную смесь последней! Сразу после добавления кислоты отметьте по секундомеру, сколько времени пройдет от момента сливания растворов до момента появления мути в пробирке. Полученные результаты внесите в таблицу 14.
Таблица 14
Экспериментальные данные для определения зависимости скорости реакции от концентрации реагирующих веществ
| № пробирки | Объем, мл | Относительная концентрация
Na2S2O3
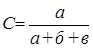
| τ – время появления мути, с | Относительная скорость реакции υ = 1/ τ, с-1 | ||
| Na2S2O3 (а) | H2O (б) | H2SO4 (в) | ||||
| – |
Запишите математическое выражение закона действия масс для изучаемой реакции. От концентрации какого реагента зависит скорость реакции? Концентрация какого реагента остается постоянной и может быть объединена с константой скорости в единую константу К*?
Результаты наблюдения представьте графически. На оси ординат отложите относительную скорость реакции 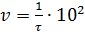 , а на оси абсцисс – относительную концентрацию Na2S2O3.
, а на оси абсцисс – относительную концентрацию Na2S2O3.
Сделайте вывод о характере зависимости скорости реакции от концентрации.
Опыт 2. Зависимость скорости химической реакции от температуры. Правило Вант - Гоффа. Энергия активации химической реакции
Исследование влияния температуры рассмотрите на примере той же реакции, что и в предыдущем опыте.
В две пробирки налейте по 10 мл раствора серной кислоты и раствора тиосульфата натрия. В пробирку с тиосульфатом опустите термометр.
Первый эксперимент выполните при комнатной температуре. Затем поместите пару пробирок (H2SO4 – Na2S2O3) в стакан с горячей водой и следите за повышением температуры. При достижении необходимой температуры (на 10 0С выше комнатной), выньте термометр, слейте содержимое пробирок в одну и включите секундомер (кислоту прилить к раствору тиосульфата натрия). Запишите время с момента сливания до начала помутнения раствора. Пробирки тщательно промойте.
Следующую пару пробирок поместите в стакан с горячей водой и нагрейте до температуры уже на 100 выше той, при которой проводился второй опыт. Запишите время появления мути. Данные внесите в таблицу 15.
Таблица 15
Экспериментальные данные для определения зависимости
скорости реакции от температуры
| № опыта | Температура опыта, t, 0С | τ – время появления мути, с | Относительная скорость реакции υ = 1/τ, с-1 | Температурный коэффициент Вант-Гоффа, g |
Рассчитайте температурный коэффициент g по уравнению Вант-Гоффа, используя данные опытов 1 и 2, 2 и 3, 1 и 3, определите среднее значение.
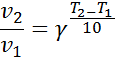
Результаты наблюдений представьте графически в координатах υ = f(t0) (для удобства построения графика относительную скорость реакции υ1 = 1/τ умножьте на 102).
Сделайте вывод о зависимости скорости реакции от температуры, запишите математическое выражение уравнения Вант-Гоффа для данной реакции.
Аналитическую зависимость скорости реакции от энергии активации и температуры установил С. Аррениус:
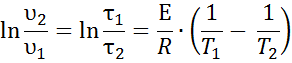
E – энергия активации реакции, Дж/моль
Т – температура по шкале Кельвина,
υ1 – скорость реакции при температуре Т1,
υ2 – скорость реакции при температуре Т2 ,
t1 – скорость реакции при температуре Т1,
t2 - время реакции при температуре Т2.
Время, которое проходит от начала реакции до помутнения раствора, обратно пропорционально скорости химической реакции, поэтому энергия активации реакции может быть определена по уравнению:
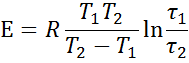
Рассчитайте величину энергии активации (кДж/моль) и ее среднее значение по уравнению Аррениуса, используя данные опытов 1 и 2, 2 и 3, 1 и 3 попарно.
Экспериментальные данные для определения энергии активации реакции на изучаемом температурном интервале
| Температура опыта Т, К | τ – время появления мути, с | Е – энергия активации реакции, кДж/моль | Еср, кДж/моль | |||
| 1-2 | ||||||
| 2-3 | ||||||
| 1-3 |
Сделайте вывод о применимости правила Вант-Гоффа и уравнения Аррениуса к исследуемой реакции.