1) Активаторы – это вещества, которые увеличивают скорость реакций, катализируемых ферментами. К ним относятся ионы металлов (Mg, Mn, Zn, K, Co) и некоторые анионы (Cl). В одних случаях ионы металлов входят в состав простатической группы фермента, в других - способствуют присоединению субстрата к активному центру и образованию фермент-субстратною комплекса. 13 ряде случаев металлы соединяются с субстратом, образуя' истинный субстрат, на который действует фермент. Металлы принимают участие в формировании и стабилизации активного центра и всей третичной структуры молекулы фермента.
Мощное действие на ферменты оказывают аллостерические активаторы. Они присоединяются к аллостерическому центру фермента и изменяют третичную структуру белковой молекулы. В результате этого образуется наиболее выгодная пространственная конфигурация фермента для осуществления своих функции. Анионы металлов обычно неэффективны или оказывают небольшое активирующее влияние на ферменты.
2) Ингибиторы. Действие ферментов можно полностью или частично подавить (ингибировать) определенными химическими веществами (ингибиторами). Ингибиторы - это вещества, вызывающие частичное или полное торможение реакций, катализируемых ферментами. Ферменты являются белками, полому любые агенты, вызывающие денатурацию белка, приводят к инактивации фермента. Однако подобное инактивироваиие относительно неспецифично. Оно не связано с механизмом действия ферментов.
Гораздо большую группу составляют специфические ингибиторы, которые оказывают свое действие на I какой-либо фермент или группу родственных ферментов.
По характеру действия ингибиторы могут быть обратимыми и необратимыми. В основе этого деления лежит прочность соединения ингибитора с ферментом.
Другой способ деления ингибиторов основывается на характере места их связывания. Одни из них связываются с ферментом в активном центре, а другие - в удаленном от активного центра месте. Они могут связывать и блокировать функциональную группу молекулы фермента, необходимую для проявления его активности. При этом они необратимо, часто ковалентно, связываются с ферментом или фермент - субстратным комплексом и необратимо изменяют нативную конформацию. Это, в частности, объясняет действие Hg2+, Pb2+, соединений мышьяка. Ингибиторы такого рода могут быть полезны при изучении природы ферментативного катализа.
Например, диизопропилфторфосфат ингибирует ферменты, имеющие серии в активном центре. Таким ферментом является ацетилхолинэстераза, катализирующая следующую реакцию:

Реакция происходит каждый раз после проведения нервного импульса, прежде чем второй импульс будет передан через синапс. Диизопропилфторфосфат -одно из отравляющих веществ нервно-паралитического действия, так как приводит к утрате способности нейронов проводить нервные импульсы.

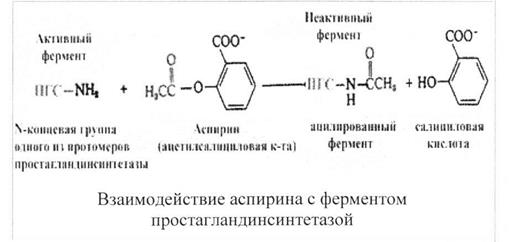
Терапевтическое действие аспирина как жаропонижающего и противовоспалительного средства объясняется тем, что аспирин ингибирует один из ферментов, катализирующий синтез простагландинов (ПГ). Простагландины - вещества, участвующие в развитии воспаления. Ингибирование обусловлено ковалентной модификацией одной из аминогрупп фермента - простагландинсинтетазы.
Обратимые ингибиторы. Существует два типа подобных ингибиторов - конкурентные и неконкурентные. Конкурентный ингибитор конкурирует с субстратом за связывание с активным центром. Это происходит потому, что ингибитор и субстрат имеют сходные структуры:

Конкурентное ингибирование: S-субстрат, I-ингибитор (своей трехмерной структурой похож на субстрат).
В отличие от субстрата связанный с ферментом конкурентный ингибитор не подвергается ферментативному превращению. Более того, образование EI уменьшает число молекул свободного фермента, и скорость реакции снижается. Связывание S и I происходит взаимоисключающим образом. Образуется либо ES, либо EI, но не EIS. Так как конкурентный ингибитор обратимо связывается с ферментом, то можно сдвинуть равновесие реакции Е + I <-> EI влево простым увеличением концентрации субстрата.
Конкурентными ингибиторами являются многие химиотерапевтические средства. Например, сульфамидные препараты, используемые для лечения инфекционных болезней.
Сульфаниламиды - это структурные аналоги парааминобензойной кислоты, из которой в клетке микроорганизма синтезируется кофермент (Н4 - фолат), участвующий в биосинтезе нуклеиновых оснований. Нарушение синтеза нуклеиновых кислот приводит к гибели микроорганизмов.


Классическим примером конкурентного ингибирования также является ингибирование сукцинатдегидрогеназы малоновой кислотой:

Неконкурентное ингибирование вызывается веществами, не имеющими структурного сходства с субстратами и часто связывающимися не с активным центром, а в другом месте молекулы фермента. Ингибитор взаимодействует с апоферментом или простетической группой, вследствие чего фермент теряет активность. Одним из вариантов такого торможения может служить блокирование ферментов тяжелыми металлами (мышьяк, Hg, Pb, которые присоединяются к сульфгидрильным группам полипептидной цепи), солями синильной кислоты, СО и другими. Степень торможения во многих случаях определяется продолжительностью действия ингибитора на фермент При данном типе ингибирования благодаря образованию стабильной ковалентной связи фермент часто подвергается полной инактивации и тогда торможение становится необратимым.