Общие свойства ферментов
Ферменты как катализаторы обладают всеми свойствами обычных химических катализаторов, но их белковая природа дает ферментам другие свойства, такие как:
1. Лабильность действия:
а) термолабильность;
б) влияние рН;
2. Специфичность действия;
3. Влияние ингибиторов и активаторов.
Лабильность действия ферментов
а) Термолабильность
Термолабильность ферментов объясняется тем, что температура, с одной стороны, воздействует на белковую часть фермента, приводя при слишком высоких значениях к денатурации белка и снижению каталитической функции, а с другой стороны, оказывает влияние на скорость реакции образования фермент-субстратного комплекса и на все последующие этапы преобразования субстрата, что ведет к усилению катализа. Зависимость каталитической активности фермента от температуры выражается кривой.
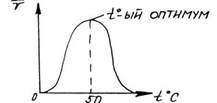
 До некоторого значения температуры (в среднем до 50°С) каталитическая активность растет, причем на каждые 10°С примерно в 2 раза повышается скорость преобразования субстрата. В то же время постепенно возрастает количество инактивированного фермента за счет денатурации его белковой части. При температуре выше 50°С денатурация ферментного белка резко усиливается и, хотя скорость реакций преобразования субстрата продолжает расти, активность фермента, выражающаяся количеством превращенного субстрата, падает. Температура, при которой каталитическая активность фермента максимальна, называется его температурным о п т и м у м о м. Температурный оптимум для различных ферментов неодинаков. В общем для ферментов животного происхождения он лежит между 40 и 50°С, а растительного - между 50 и 60°С. При 100 ºС почти все ферменты утрачивают свою активность. При низких температурах ферменты не разрушаются, хотя активность их падает почти до нуля.
До некоторого значения температуры (в среднем до 50°С) каталитическая активность растет, причем на каждые 10°С примерно в 2 раза повышается скорость преобразования субстрата. В то же время постепенно возрастает количество инактивированного фермента за счет денатурации его белковой части. При температуре выше 50°С денатурация ферментного белка резко усиливается и, хотя скорость реакций преобразования субстрата продолжает расти, активность фермента, выражающаяся количеством превращенного субстрата, падает. Температура, при которой каталитическая активность фермента максимальна, называется его температурным о п т и м у м о м. Температурный оптимум для различных ферментов неодинаков. В общем для ферментов животного происхождения он лежит между 40 и 50°С, а растительного - между 50 и 60°С. При 100 ºС почти все ферменты утрачивают свою активность. При низких температурах ферменты не разрушаются, хотя активность их падает почти до нуля.
б) Зависимость активности фермента от значения pH среды. Для каждого фермента существует оптимальное значение pH среды, при котором он проявляет максимальную активность. Зависимость каталитической активности фермента от рН среды выражается кривой.
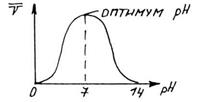
Точка, при которой фермент проявляет максимальную каталитическую активность, называют оптимумом рН среды для действия данного фермента. Большинство ферментов имеет максимальную активность в зоне рН поблизости от нейтральной точки. В резко кислой или резко щелочной среде хорошо работают лишь некоторые ферменты (пепсин = 2, аргиназа = 10, уреаза = 7).
Переход к большей пли меньшей (по сравнению с оптимальной) концентрации водородных ионов сопровождается более или менее равномерным падением активности фермента. Влияние концентрации водородных ионов на каталитическую активность ферментов состоит в воздействии ее на активный центр. При разных значениях pH в реакционной среде активный центр может быть слабее или сильнее ионизирован, больше или меньше экранирован соседними с ним фрагментами полипептидной цепи белковой части фермента и т.п. Кроме того, рН среды влияет на степень ионизации субстрата, фермент-субстратного комплекса и на третичную структуру белковой молекулы.
Так как максимальная активность фермента обусловлена оптимальной конформацией молекулы фермента в целом и активного центра в частности, то даже небольшие изменения окружающих условий, которые затрагивают связывание субстрата или конформацию третичной структуры белка, будут влиять на скорость ферментативной реакции. Например, изменение pH приводит к изменению степени ионизации ионогенных групп фермента и, следовательно, ведет к перераспределению межрадикальных связей в третичной структуре. Оптимальное pH для каждого фермента означает некоторое оптимальное состояние его ионизации, соответствующее наилучшей комплементарности.