Кровь, как внутренняя среда организма, характеризуется постоянством физико-химических параметров. При развитии заболеваний показатели изменяются и это определяет важную диагностическую ценность биохимических анализов крови Плотность крови составляет 1,050-1,065. Измеряют с помощью ареометра. Относительная вязкость крови равна 5-6 (т.е. в 5-6 раз выше, чем вязкость воды). Определяется белками и форменными элементами. Определяется с помощью вискозиметра. При повышении вязкости крови происходит нарушение рефлекторной деятельности сердечно-сосудистой системы. Осмотическое давление крови, зависящее от низкомолекулярных соединений, составляет 6-8 атмосфер. Оно определяется криоскопическим методом, который позволяет измерить разницу между температурой замерзания воды и температурой замерзания крови. Δto=0,55-0,58о. Осмотическое давление определяется солевым составом плазмы крови. Осмотическое давление учитывается при внутривенном введении жидкостей. Различают:
1) Изотонический раствор – 0,9% NaCl, 5% глюкоза.
2) Гипертонический раствор – 45% глюкоза.
3) Гипотонический раствор – вода, слабые солевые растворы.
рН крови = 7,36-7,44 (в среднем 7,40 при 37оС (в венозной крови рН=7,38). При смещение рН на несколько десятых может наступить смерть (например, смещение на 0,3 приводит к коме). рН определяет активность всех ферментов нашего организма, поэтому важно поддерживать постоянство рН. Постоянство рН крови поддерживается буферными системами и физиологическими механизмами (лёгкие, кожа, почки, ЖКТ). Общая буферная ёмкость крови высока. Чтобы сместить рН крови в 1мл на 0,1 нужно добавить 4,5мл 0,1н HCl.
Буферные системы крови
I. Бикарбонатная – на её долю приходится 10-12% всей буферной ёмкости крови. Состоит из H2CO3 и NaHCO3. Для данной буферной системы величину рН можно выразить через константу диссоциации H2CO3 (рК) и по градиенту концентрации недиссоциированных молекул H2CO3 и NaHCO3:
pH = pKН2СО3 + lg 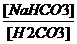
Однако, истинная концентрация недиссоциированных молекул Н2СО3 в крови очень незначительна и в сотни (500-800) меньше, чем концентрация СО2, то удобнее пользоваться следующей формулой:
pH = pK’+lg 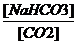 , где pK’ – коэффициент пересчета.
, где pK’ – коэффициент пересчета.  При работе этого буфера, роль донора протонов выполняет Н2СО3 (Н2СО3 Н++НСО3-), а акцептора NaHCO3. Для этой системы в крови поддерживается состояние соль/кислота = 20/1.
При работе этого буфера, роль донора протонов выполняет Н2СО3 (Н2СО3 Н++НСО3-), а акцептора NaHCO3. Для этой системы в крови поддерживается состояние соль/кислота = 20/1.
II. Фосфатная – составляет 1-3% буферной ёмкости крови. Состоит из NаH2PO4 (кислый компонент) и Na2HPO4 (щелочной компонент). Для тканей, (кроме крови) это одна из основных буферных систем. Буферное действие этой системы основано на возможности присоединения протонов к Na2HPO4 с образованием NаH2PO4. А ионы ОН- могут связаться с NаH2PO4 с образованием Na2HPO4 и воды. В крови фосфатный буфер находится в тесном взаимодействии с бикарбонатным. Также эта система функционирует в комплексе с почками. Для фосфатного буфера:
pH = pKNaH2PO4 + lg 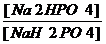
В крови поддерживается следующее соотношение: NaH2PO4/ Na2HPO4 = 1/4.
III. Белковая - составляет 10-15% всей буферной ёмкости крови. Белки способны отдавать или присоединять протоны. Белки образуют буферную систему благодаря наличию кислотных и основных групп в своей молекуле. При закислении среды белки способны присоединять протон:

 COOH COOH
COOH COOH


 R + H+ R
R + H+ R
NH2 NH3+
В случае защелачивания среды белки способны отдавать протон:.

 COOH COO+
COOH COO+


 R R + H+
R R + H+
NH2 NH2
IV. 
 Гемоглобиновая – самая мощная буферная система крови, на её долю приходится до 75% общей буферной ёмкости крови. Она состоит из восстановленного гемоглобина (Hb) и оксигемоглобина (HbO2). Восстановленный Hb способен присоединять протоны (меняется заряд в определённых участках молекулы Hb и при этом гистидин и концевые группы –NH2 способны присоединять протон). Особое значение гемоглобинового буфера проявляется в процессе газообмена. Из тканей в кровь поступают СО2, который соединяясь с водой образует Н2СО3. При диссоциации Н2СО3 образует протоны: Н2СО3 Н++НСО3-. Это могло бы привесть к закислению среды, но HbО2 отдаёт тканям кислород и превращается в восстановленный Hb, который обладает повышенной способностью связывать Н+ и закисления среды не происходит. В лёгких происходит отдача СО2, т.е. равновесие Н2СО3 Н++НСО3- сдвинуто влево. Можно было бы ожидать защелачивания крови. Но восстановленный гемоглобин, богатый протонами, будет присоединять О2 и превращаться в HbO2, который не может удержать Н+, протоны будут поступать в раствор, защелачивания не будет.
Гемоглобиновая – самая мощная буферная система крови, на её долю приходится до 75% общей буферной ёмкости крови. Она состоит из восстановленного гемоглобина (Hb) и оксигемоглобина (HbO2). Восстановленный Hb способен присоединять протоны (меняется заряд в определённых участках молекулы Hb и при этом гистидин и концевые группы –NH2 способны присоединять протон). Особое значение гемоглобинового буфера проявляется в процессе газообмена. Из тканей в кровь поступают СО2, который соединяясь с водой образует Н2СО3. При диссоциации Н2СО3 образует протоны: Н2СО3 Н++НСО3-. Это могло бы привесть к закислению среды, но HbО2 отдаёт тканям кислород и превращается в восстановленный Hb, который обладает повышенной способностью связывать Н+ и закисления среды не происходит. В лёгких происходит отдача СО2, т.е. равновесие Н2СО3 Н++НСО3- сдвинуто влево. Можно было бы ожидать защелачивания крови. Но восстановленный гемоглобин, богатый протонами, будет присоединять О2 и превращаться в HbO2, который не может удержать Н+, протоны будут поступать в раствор, защелачивания не будет.
Кроме рассмотренных буферных систем в организме есть физиологические системы поддержания рН (удаляются из организма кислые и щелочные продукты, перестраиваются обменные процессы в тканях и т.д.). Но несмотря на действие буферных и физиологических систем, иногда в организме отмечается нарушение кислотно-щелочного равновесия. При повышение концентрации Н+ в крови выше нормальных пределов, развивается ацидоз. В тех же случаях, когда концентрация Н+ в крови уменьшается, развивается состояние алкалоза. Эти состояния определяют измеряя рН крови, рН мочи (в норме рН мочи = 5-6, при ацидозе уменьшается, при алкалозе увеличивается). Определяют содержание аммиака в моче (при ацидозах содержание NH3 повышается, при алкалозах снижается). Определяют активность глютаминазы почек (этот фермент отщепляет аммиак от глютамина) – при ацидозе активность этого фермента повышается, при алкалозе понижается. Изменения рН как в сторону ацидоза, так и в сторону алкалоза возможны при развитие различных патологических состояний. По степени выраженности ацидозы и алкалозы делят на три вида:
1) Компенсированный (рН = 7,40 ± 0,05) 2)Субкомпенсированный (рН = 7,40 ± 0,15)
3) Декомпенсированный (рН = 7,40 ± 0,25)
По механизму развития нарушений ацидозы и алкалозы делят на газовые (дыхательные) и негазовые (метаболические). Если первопричиной возникновения ацидоза или алкалоза является газообмен, то это газовые ацидоз или алкалоз. Если первопричина – нарушение обмена, то это метаболический (негазовый) ацидоз или алкалоз. Газовый (дыхательный) ацидоз – возникает при затруднение удаления СО2. Такое заболевание развивается при бронхиальной астме, отёке, эмфиземе, ателектазе лёгких, механической асфиксии и т.д. Все эти состояния ведут к гиповентиляции лёгких и гиперкапнии (т.е. повышению давления СО2 крови). Как следствие повышается содержание Н2СО3, которая при диссоциации поставляет в кровь Н+, что приводит к возникновению газового ацидоза. Метаболический ацидоз – обусловлен накоплением в тканях и крови органических кислот (например лактата), различных кислых продуктов (кетоновых тел и т.д.). Этот вид ацидоза связан с нарушением обмена веществ. Метаболический ацидоз возможен при сахарном диабете, голодании, лихорадке, заболеваниях ЖКТ, шоках, интенсивной физической нагрузке. Дыхательный (газовый) алкалоз – возникает при резко усиленной вентиляции лёгких, сопровождающейся быстрым выделением из организма СО2. При этом развивается гипокапния (низкое давление СО2). Этот вид алкалоза возможен при вдыхании чистого О2, компенсаторной одышке, сопровождающей ряд заболеваний, пребывании в разряженной атмосфере, при повышение температуры, при черепно-мозговых травмах и других состояниях. При дыхательном алкалозе снижается щелочной резерв крови, т.к. меньше NaHCO3 в бикарбонатной буферной системе. Метаболический алкалоз – развивается при потере большого количества кислых продуктов (например, неукротимая рвота, ожоги и т.д.), при изменение обмена в-в в сторону образования щелочных продуктов, при гиперпродукции альдостерона и т.д. При метаболическом алкалозе повышена концентрация NaHCO3 в крови, т.е. увеличивается щелочной резерв крови. Различают газовый и негазовый ацидоз или алкалоз по содержанию кислоты и бикарбонатов (при газовом ацидозе эти показатели увеличиваются, при негазовом уменьшаются). При алкалозах – наоборот (при газовом бикарбонаты и углекислота уменьшаются, при негазовом эти показатели возрастают). Для диагностики используют специальные аппараты: АСТРУП, АЗИВ и дт. На практике чаще встречаются сочетанные формы ацидозов и алкалозов.
Свёртывание крови
Для выполнения транспортной функции кровь должна сохранять текучесть и вместе с тем должна быть способной переходить в состояние твёрдого тела, чтобы не излиться из сосуда при его повреждении. Прекращение кровотечения после различных повреждений называют гемостазом. Выделяют 4 фаза гемостаза:
1) Сокращение повреждённого сосуда,
2) Образование в месте повреждения рыхлой тромбоцитарной пробки или белого тромба (образуется из тромбоцитов и фибрина),
3) Образование красного тромба – кровяного сгустка (состоит из эритроцитов и фибрина),
4) Частичное или полное растворение сгустка.
В системе гемостаза взаимодействуют три функционально-структурных компонента:
1) интима кровеносных сосудов, 2) клетки крови (преимущественно тромбоциты),
3)плазменные ферментные системы.
Роль эндотелия сводится к образованию противосвёртывающих факторов, синтезу и выделению ингибитора агрегации тромбоцитов. Тромбоциты высвобождают вазоактивные вещества (серотонин, гистамин, катехоламины), образуют первичную пробку, приклеиваясь к субэндотелию в месте его повреждения (адгезия) и склеиваясь в комья (агрегация). Коагуляционные факторы тромбоцитов обозначают буквами Р (от 1 до 11) – Р1, Р2, Р3… Р11.
Плазменные факторы свёртывания носят следующие обозначения (их 15):
Фактор I – (фибриноген) – фибриллярный белок, образующий основу сгустка, который состоит из фибрина – полимера.
Фактор II – (протромбин) – кальцийзависимый белок, предшественник тромбина – фермента, катализирующего превращение фибриногена в фибрин.
Фактор III – (тканевый тромбопластин) – содержит фрагменты клеточных мембран, в кровоток поступает при разрушение клеток крови (главным образом моноцитов) и эндотелия сосудов. Является катализатором активации белков-предшественников факторов свёртывания.
Фактор IV – (Са++) – обеспечивает сближение и оптимальную ориентацию ферментов свёртывания.
Фактор V – (проакцелерин) – липопротеид, который вместе с Са++ и фосфолипидами обеспечивает оптимальную ориентацию фактора II и фактора Х-А, служит своего рода рецептором для фактора Х-А, связывающегося с протромбином.
Фактор VII – (проконвертин) – в присутствии ионов кальция активирует фактор Х.
Фактор VIII – (антигемофилический глобулин) – включает две субъединицы – коагулирующую и агрегационную (фактор Виллебрандта).
Фактор IX – (фактор Кристмаса) – является активатором фактора VIII.
Фактор X – (фактор Стюарта) – в активной форме катализирует переход протромбина в тромбин.
Фактор XI – (фактор Розенталя) – активатор фактора IX.
Фактор XII – (Хагемена) – рассматривается как фактор, активация которого запускает процесс свёртывания.
Фактор XIII – (фибринстабилизирующий фактор) – участвует в формировании фибринового сгустка.
Фактор Флетчера – один из каллекреинов плазмы – катализирует образование кининов (в крови циркулирует в виде прекаллекреина).
Фактор Фитцджеральда – один из кининов, повышает чувствительность фактора XI к действию фактора XII.
С позиции патофизиологии различают первичный (сосудисто-тромбоцитарный) и вторичный (коагуляционный) гемостаз. Пусковой момент первичного гемостаза – повреждение эндотелия, сопровождающееся обнажением субэндотелия. При контакте с коллагеном субэндотелия тромбоциты прилипают к стенке (адгезия), единовременно происходит и агрегация тромбоцитов. Вторичный гемостаз – это многоэтапный ферментативный процесс, конечная цель которого – формирование фибринового сгустка. В активации фактора II, фактора VII, фактора IX, фактора X большую роль играет витамин К (нафтохинон). Этот витамин катализирует реакцию карбоксилирования глютамата с образованием γ-карбоксилглютамата:
+CO2


 COOH – CH – (CH2)2 – COOH COOH – CH – CH2 – CH
COOH – CH – (CH2)2 – COOH COOH – CH – CH2 – CH
| |
NH2 NH2 COOH COOH
глютомат гамма-карбоксилглютомат
Такое соединение содержится в N-концевой части протромбина и такой протромбин, связываясь с ионами кальция, закрепляется на фосфолипидных мембранах тромбоцитов, скапливающихся в месте повреждения. При этом он оказывается в непосредственной близости от фактора X-A и фактора V, а это ускоряет его активацию в 104 раз. В результате фрагмент протромбина, содержащий участки связывания кальция отщепляется и высвобождается активный тромбин. Инициация образования сгустка в ответ на повреждение ткани осуществляется по внешнему пути свёртывания. Инициация формирования красного тромба в области замедленного кровотока или на аномальной (повреждённой) сосудистой стенке при отсутствии повреждения ткани происходит по внутреннему пути свёртывания. Внешний и внутренний пути свёртывания завершаются общим конечным путём. На этом этапе происходит переход протромбина в тромбин и катализируемое тромбином превращение фибриногена в фибрин.
I. Общий путь свёртывания крови.
Фибриноген (фактор I) – это растворимый гликопротеид плазмы, синтезируемый в печени (молекулярная масса 340000). Тромбин – это протеаза (молекулярная масса 34000), он гидролизует 4 пептидных связи в фибриногене между аргинином и глицином. При этом как бы «вырезаются» два низкомолекулярных пептида А и В с концов молекулы фибриногена и образуется мономер фибрина. Длинные растворимые мономеры спонтанно ассоциируются в зигзагообразные регулярные структуры, в результате образуется нерастворимый полимерный фибриновый сгусток. Он захватывает эритроциты, тромбоциты, другие компоненты крови, в результате чего и образуется красный или белый тромб. Тромбин, помимо перевода фибриногена в фибрин, переводит в активную форму фактор XIII (фибринстабилизирующий фактор), который сшивает мономеры фибрина путём образования специфической пептидной связи между глютамином и лизином разных молекул. При недостаточности этого фактора отмечается повышенная кровоточивость. Активность тромбина должна тщательно контролироваться (чтобы не произошёл внезапный тромбоз сосудов). Есть два механизма контроля:
1) существует антагонист тромбина – антитромбин III (о нём ниже),
2) Тромбин вырабатывается в неактивной форме – протромбин (фактор II) – гликопротеид – синтезируется в печени (молекулярная масса 72000). Активация протромбина происходит на тромбоцитах. В этом участвует тромбоцитарный фосфолипид, Са++, факторы V-A и X-A. Фосфолипиды связывают ионы кальция и протромбин (при этом активация более чем в 50-100 раз). Тромбоциты также содержат фактор V-A (образующийся из неактивной формы - фактор V, фактор V‑A – акцелерин, V – проакцелерин), который служит рецептором для фактора X-A, связывающегося с протромбином. Фактор X-A является протеазой, он отщепляет N-концевую часть протромбина, при этом образуется тромбин. Фактор V-A (усиливает активацию протромбина в 350 раз), впоследствии тем же тромбином и инактивируется. Таким путём ограничивается процесс активации протромбина в тромбин. Схематично общий путь выглядит так:

 Фибриноген (ф-1) фибрин (мономер) фибрин (полимер)
Фибриноген (ф-1) фибрин (мономер) фибрин (полимер)
Ф13
 Тромбин протромбин
Тромбин протромбин
 Проакцелерин (ф5) акцелерин Са++ ф10 – а (ф. Стюарта)
Проакцелерин (ф5) акцелерин Са++ ф10 – а (ф. Стюарта)
На этапе активации фактора Х происходит соединение внешнего и внутреннего путей и образуется общий конечный путь свёртывания крови. Фактор Х – протеаза (молекулярная масса 55000). Большое значение в активации этого фактора играет витамин К, который также влияет на образование протромбина, активацию факторов VII, IX. При отсутствии витамина К свёртываемость крови падает.
II. Внешний путь образования фактора Х-А.
Активация фактора Х на внешнем пути осуществляется совместно фактором VII-A и тканевым фактором. Фактор VII-A функционирует только на внешнем пути, который быстро включается после повреждения ткани. Фактор VII-A синтезируется в печени и может активироваться тромбином или фактором Х-А. Тканевой фактор (фактор III), а это тромбопластины тканевые, имеющие липопротеидную природу, действуют на фактор Х превращая его в активную форму Х-А. В этом процессе также участвуют фосфолипиды и Са++. Схематично:


 Ф 10 (ф.Стюарта) ф 10 - А
Ф 10 (ф.Стюарта) ф 10 - А

 Ф 3 (тканевой тромбопластин) ф 7 – А ф 7 (проконвертин)
Ф 3 (тканевой тромбопластин) ф 7 – А ф 7 (проконвертин)
Тромбин (ф. 2 - А)
III. Внутренний путь образования фактора Х-А.
В результате действия калликреина (протеолиз) фактор XII превращается в активную форму XII-A, которая в свою очередь индуцирует переход прекалликреина в калликреин. Фактор XII-A высвобождает из высокомолекулярного компонента брадикинин и с его пощью активируют фактор ХI в XI-A. В свою очередь, фактор XI-A активирует фактор IX. Активный фактор IX-А в присутствии ионов кальция и кислых фосфолипидов активирует фактор Х по тому же механизму, как его активировал и фактор 7-A на внешнем пути. Рецептором для фактора IX-А для его связи с фактором Х, является фактор VIII, который сам активируется тромбином (фактор VIII-А повышает активацию фактора Х в 500 раз). Схематично:
 Ф10 ф 10 – А
Ф10 ф 10 – А
 | |||||
 | |||||
 |

 Ф 7 ф.7 –А Са++ ф 9 – А ф 9
Ф 7 ф.7 –А Са++ ф 9 – А ф 9
фосфолипиды
Тромбин

 Ф 11 ф 11 – А
Ф 11 ф 11 – А


 Ф 12 ф 12 – А кинин
Ф 12 ф 12 – А кинин
 Каллекреин
Каллекреин
 |
Прекаллекреин кининоген
Внешний и внутренний процесс свёртывания действуют одновременно. Образование Х-А фактора происходит примерно за несколько минут, дальше всё происходит за доли секунды.