МОДУЛЬ 1
Тема №1 Водород и его соединения.
ВОПРОСЫДЛЯ САМОСТОЯТЕЛЬНОЙ ПОДГОТОВКИ К ТЕМЕ:
1. Дайте общую характеристику элементу «водород»:
1.1. Открытие;
1.2. Распространение в природе;
1.3. Методы получения;
1.4. Физические и химические свойства;
1.5. Применение.
2. Изотопы водорода и изотопные разновидности воды.
3. Соединения водорода:
3.1. Методы получения;
3.2. Физические и химические свойства
ВОПРОСЫДЛЯ САМОСТОЯТЕЛЬНОЙ ПОДГОТОВКИ К ЛАБОРАТОРНОЙ РАБОТЕ:
1. Техника безопасности при работе с водородом.
2. Исходя из методических указаний к лабораторной работе, составить список приборов и реактивов.
ЛАБОРАТОРНАЯ РАБОТА «ВОДОРОД»
ОПЫТ 1. ПОЛУЧЕНИЕ ВОДОРОДА ИЗ ВОДЫ
1.1. С помощью цинка. В пробирку налить 1 мл воды, добавить 3 капли фенолфталеина, и поместить кусочек очищенного (с помощью наждачной бумаги) цинка. Нагреть пробирку. Что наблюдается? ……………………………………………………………………………………………………………………………………………………
1.2. С помощью кальция. Собрать установку (рис. 1), заполнить кристаллизатор и пробирку водой.
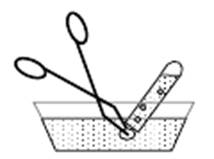
Рис. 1. Установка для получения водорода из воды с помощью кальция.
Завернуть кусочек металлического кальция (размером с полспички) в марлю и с помощью щипцов быстро подвести к отверстию пробирки. Что наблюдается? ……………………………………………………………………………………………………………………………………………………
После полного вытеснения воды из пробирки закрыть (не переворачивая!) ее отверстие пальцем и собранный газ перелить в другую пробирку, перевернутую вверх дном (переливать в течение примерно 40 с). Поднося по очереди обе пробирки к огню, выяснить, перелит ли газ.
…………………………………………………………………………………………………………………………………………………….
Повторить опыт и продемонстрировать процесс переливания, а также доказательство того, что газ перелит (хотя бы частично).
…………………………………………………………………………………………………………………………………………………….
Что обнаруживается при разворачивании марли, в которой был кальций? (Оставить для демонстрации).
……………………………………………………………………………………………………………………………………………………
Подвергнуть анализу жидкость в кристаллизаторе. Для чего отобрать в пробирку 1 мл ее и добавить две капли фенолфталеина. Что наблюдается? Почему?
……………………………………………………………………………………………………………………………………………………
1.3. С помощью натрия. В стакан на 100 мл налить 30 мл воды, добавить 6 капель фенолфталеина и перемешать. Затем осторожно прилить 20 мл бензина или керосина и опустить в стакан кусочек очищенного натрия (величиной с горошину) [В кристаллизатор налить 0,3 л воды и добавить 12 капель фенолфталеина, затем (под тягой, опустив максимально стекло) поместить в воду кусочек натрия (не более горошины) и спичкой поджечь газ, выделяющийся в месте нахождения натрия; или положить на воду маленький конверт, сделанный из фильтровальной бумаги с кусочком натрия (величиной с горошину)]. Что наблюдается и почему?
……………………………………………………………………………………………………………………………………………………
Как меняется цвет воды в ходе эксперимента? Почему?
……………………………………………………………………………………………………………………………………………………
Сравнить интенсивность окраски фенолфталеина в растворах после опытов 1.1, 1.2, 1.3 и объяснить различия.
……………………………………………………………………………………………………………………………………………………
ОПЫТ 2. ВОССТАНОВЛЕНИЕ ОКСИДА МЕДИ(II)
(Опыт выполняется под тягой!)
2.1. Получение водорода. Собрать установку, представленную на рис. 2.
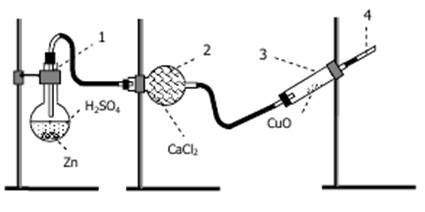
Рис. 2. Установка для восстановления оксида меди(II).
Предварительно заполнить хлоркальциевую трубку (2) гранулированным хлоридом кальция (зачем?),
……………………………………………………………………………………………………………………………………………………
в трубку (3) поместить (с помощью длинного бумажного «ковшика») 0,1 г оксида меди(II), а в отверстие выходной трубки (4) вставить тонкую медную проволоку. Проверить герметичность прибора. Затем в колбу (1) внести 30 гранул цинка, прилить 80 мл 2М серной кислоты и закрыть колбу пробкой. (Проследить, чтобы газоотводная трубка была близка к поверхности раствора).
2.2. Проверка водорода на чистоту. Собрать газ из газоотводной трубки (4) в сухую пробирку, объемом не более 10 мл (собирать в течение примерно 1-2 минут). Затем закрыть пробирку пальцем (не переворачивая ее) и поднести, отняв палец, ее отверстие к огню. Что наблюдается и почему?
……………………………………………………………………………………………………………………………………………………
Пункт 2.2. повторять до тех пор, пока собранный газ не начнет сгорать без резкого звука, что и укажет на его сравнительную чистоту от кислорода.
кислорода.
2.3. Горение водорода. Убедившись в отсутствии кислорода (во взрывоопасных количествах) в выделяющемся водороде, поджечь его у выхода из прибора. Отметить цвет пламени и в присутствии группы определить качественный состав продуктов сгорания.
……………………………………………………………………………………………………………………………………………………
Для этого опрокинуть над пламенем холодную стеклянную воронку. Что наблюдается и почему?
……………………………………………………………………………………………………………………………………………………
Как объяснить, что если направить пламя на кусочек льда, то стекающая со льда жидкость вызывает посинение йодкрахмального подкисленного раствора?
……………………………………………………………………………………………………………………………………………………
2.4. Восстановление меди(II). С помощью спиртовки осторожно прогреть трубку (3) по всей длине, а потом сильно нагреть ту ее часть, где находится оксид меди(II). Зачем?
……………………………………………………………………………………………………………………………………………………
Когда оксид меди восстановится полностью, закончить нагревание и оставить прибор остывать, не прекращая тока водорода. Затем слить кислоту с гранул цинка в специальную банку, промыть их водой и сдать лаборанту.
ОПЫТ 3. ПОЛУЧЕНИЕ ВОДОРОДА ИЗ ЩЕЛОЧНОГО РАСТВОРА. СРАВНЕНИЕ АКТИВНОСТИ МОЛЕКУЛЯРНОГО И АТОМАРНОГО ВОДОРОДА
(Опыт выполняется под тягой!)
3.1. Получение водорода. Собрать установку, схема которой представлена на рис. 3.
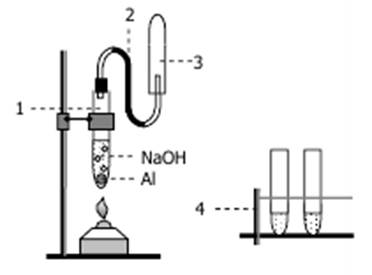
Рис. 3. Установка для получения водорода из щелочного раствора
Положить в пробирку (1) 3-4 кусочка алюминия и прилить 4 мл 1M гидроксида натрия. Заткнуть пробирку пробкой с газоотводной трубкой (2) и на последнюю надеть пробирку (3). Осторожно нагреть пробирку (1) спиртовкой и собирать выделяющийся газ в течение примерно 3-4 минут. Доказать, что собранный газ содержит водород (как?).
……………………………………………………………………………………………………………………………………………………
3.2. Восстановление перманганата калия. В две чистые пробирки налить по 3 мл 20%-ной серной кислоты, и добавить по 2 капли 0,1M перманганата калия. В одну пробирку поместить 4 гранулы цинка, а через раствор во второй – пропускать водород из газоотводной трубки (2), опустив ее до дна пробирки; следить, чтобы жидкость не засосало в трубку. Через 10 минут сравнить окраску растворов в обеих пробирках и сделать вывод.
……………………………………………………………………………………………………………………………………………………
3.3. Определение изменения щелочности раствора. Из пробирки (1) (рис. 3) с помощью пипетки отобрать 1 мл раствора в стакан на 50 мл. (Гранулы Al сразу же промыть водопроводной водой и сдать препаратору.) В другой такой же стакан поместить 1 мл исходной 1M щелочи. Затем в оба стакана добавить по 20 мл воды и измерить рН полученных растворов.
……………………………………………………………………………………………………………………………………………………
Рассчитать и объяснить изменение концентрации гидроксильных ионов в результате реакции с Al.
……………………………………………………………………………………………………………………………………………………