Вопросы для написания контрольной работы по дисциплине «Термодинамика, теплотехника и гидравлика»
Задача: при решении задачи данные берутся из таблицы.
Газ объемом V1м3, находится под давлением Р1МПа, при температуреt1оС, в результате осуществления термодинамического процесса расширяется до конечного объема V2м3.
Найти конечное давление, на конечную температуру, работу, произведенную газом, тепло и изменение внутренней энергии, если расширение происходит по одному из термодинамических процессов, указанных в таблице. Учесть зависимость теплоемкости от температуры. При решении тех вариантов, где встречается политропный процесс, следует принять показатель политропы 1,3. Для вариантов, где дан адибатный процесс, принять показатель адиабаты для двухатомных газов 1,4, для трех- и многоатомных 1,3.
| № варианта | Вид газа | Вид процесса | V1 м3 | Р1 МПа | T1 оС | V2 м3 |
| кислород | изобарный | 0,15 | 1,5 | 0,5 | ||
| азот | изотермический | 0,2 | 0,7 | |||
| оксид углерода | изобарный | 0,25 | 2,5 | 0,8 | ||
| диоксид углерода | адиабатный | 0,3 | 0,9 | |||
| диоксид серы | политропный | 0,35 | 3,5 | 1,1 | ||
| воздух | изобарный | 0,4 | 1,3 | |||
| кислород | изотермический | 0,45 | 4,5 | 1,5 | ||
| азот | изобарный | 0,5 | 1,6 | |||
| оксид углерода | адиабатный | 0,55 | 5,5 | 1,7 | ||
| диоксид углерода | политропный | 0,6 | 1,8 |
Контрольные вопросы: ответ может быть представлен в виде доклада или презентации по вариантам.
- Устройство и работа паросиловой установки.
- Прямой и обратный цикл Карно.
- Устройство и работа поршневого компрессора.
- Устройство и работа турбокомпрессора.
- Устройство и работа воздушной холодильной машины.
- Устройство и работа паровой холодильной машины.
- Классификация и устройство теплообменных аппаратов.
- Закон Паскаля и его применение в технике.
- Устройство и принцип действия поршневого насоса.
- Устройство и принцип действия струйного насоса.
Рекомендуемая литература для выполнения задания:
Брюханов О.Н. Основы гидравлики и теплотехники. – М. Академия – 2008
Бурдаков В.П. Термодинамика, специальный курс. – М. Дрофа – 2009, в двух частях.
Ещин А.В. Гидроструйные насосы и установки – М. Агропромиздат – 2007.
Кудинов А.В., Карташов Э.М. Техническая термодинамика – М. Колос – 2001.
Материал в помощь (теоретический базис и пример решения).
Расчет параметров и процессов идеального газа.
Основными параметрами состояния являются: удельный объем, абсолютная температура, абсолютное давление.
Удельный объем v, м3/кг:
v =V/m = 1/ρ,
где V, м3 – объем, m, кг –масса, ρ, кг/м3 –плотность.
Абсолютная температура Т, К:
Т = 273,15 + t.
Абсолютное давление р, Па:
р = ратм + ризб,
р = ратм – рвак.
где: ратм – атмосферное давление,
ризб – избыточное давление,
рвак – вакуумное давление.
Связь между единицами измерения:
1кПа = 103 Па; 1МПа = 106 Па,
1бар = 105 Па = 100 кПа,
1ат = 1 кгс/см2 = 98000 Па = 98 кПа,
1мм. рт. ст. =133,3 Па.
В технической термодинамике рассматривают следующие основные термодинамические процессы:
изохорный – при постоянном объеме (v = const),
изобарный - при постоянном давлении (р = const),
изотермический – при постоянной температуре (Т = const),
адиабатный – без внешнего теплообмена (δq = 0),
политропный – при постоянной теплоемкости.
Характеристики, относящиеся к 1 кг вещества, называются удельными, они обозначаются строчными буквами, а характеристики, относящиеся к полной массе – заглавными. Полные характеристики получаются умножением удельных на величину массы:
Q =m∙q, L = m∙ℓ.
Уравнение состояния идеального газа:
p×v = R×T для 1 кг идеального газа;
p×V=m×R×T при расчетах с произвольной массой m,
где R, Дж/(кг×К) – удельная газовая постоянная (таблица 1 Приложения).
R=Rμ /μ = 8,31451×103/μ.
1 закон термодинамики: q = Δu + ℓ.
В таблице 1 приведены формулы для расчета процессов.
Таблица 1
| Процесс | Связь параметров | Работа изменения объема | Теплота |
| Изохорный | p2/p1 = T2/T1 | ℓ = 0 | q = cv (T2-T1) |
| Изобарный | v2/v1 = T2/T1 | ℓ = p (v2 -v1) | q = cp (T2-T1) |
| Изотермический | p2/p1 = v1/v2 | ℓ =RT ln (v2/v1) ℓ =RT ln (p1/p2) | q = ℓ |
| Адиабатный | р2/ р1 = (v1/v2)k T2/T1 = (v1/v2)k-1 T2/T1 = (р2/р1)(k-1)/k | ℓ= 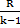 (T1-T2) (T1-T2)
| q = 0 |
| Политропный | р2/ р1 = (v1/v2)n T2/T1 = (v1/v2)n-1 T2/T1 = (р2/р1)(n-1)/n | ℓ= 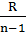 (T1-T2) (T1-T2)
| q = cv 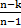 (T2-T1) (T2-T1)
|
Изменение внутренней энергии идеального газа в термодинамическом процессе:
Δu = cv∙(T2-Т1).
Изменение энтальпии идеального газа в термодинамическом процессе:
Δh = cp∙(T2-Т1).
Массовые теплоемкости идеального газа cp и cv можно определить по формулам:
cp = k·R/(k-1); cv = R/(k-1),
или как отношение мольной теплоёмкости газов к молекулярной массе (таблица 2 Приложения):
cv = mсv/m, cp= mcр/m,
k = cp/cv - показатель адиабаты или коэффициент Пуассона.
Задачи
Задача 3.1. При температуре t1 = 20ºС 2 кг углекислоты сжимается изотермически до десятикратного уменьшения объема. Определить конечное давление р2, работу сжатия и отводимую теплоту, если начальное давление р1 =0,1 МПа. Принять, что газ идеальный.
Решение.
Конечное давление:
p2/p1 = V1/V2,
p2 = p1 (V1/V2) = 0,1∙(10/1) = 1,0 МПа.
Так как для идеального газа в изотермическом процессе нет изменения внутренней энергии, то по первому закону термодинамики теплота процесса равна работе:
L =Q =m∙R∙T ln (v2/v1).
L = 2∙189 ∙293 ln (1/10) = -254,6 кДж.
Задача 3.2. 1 кг воздуха адиабатно расширяется от начального состояния с температурой t1 = 20ºС и давлением р1 =0,8 МПа до давления р2 =0,2 МПа. Определить параметры газа в конце расширения, работу процесса и изменение внутренней энергии газа.
Решение. Температура в конце адиабатного расширения:
T2 = T1 (р2/ р1)(k-1)/k = 293 (0,2/0,8)(1,4-1)/1,4 =198 К = - 75ºС.
Удельный объем воздуха в конце расширения:
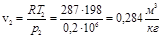 .
.
Работа адиабатного процесса:
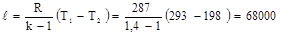 Дж/кг
Дж/кг
Изменение внутренней энергии:
∆u = u2 – u1 = -ℓ = - 68000 Дж/кг.
Таблицы.
Таблица 2.
Теплофизические свойства некоторых газов
| Газ | Химическая формула | Молекулярная масса | Газовая постоянная R, Дж/(кг×К) | Плотность, кг/м3 |
| Воздух | - | 28,96 | 286,4 | 1,293 |
| Кислород | О2 | 32,00 | 259,8 | 1,429 |
| Азот | N2 | 28,02 | 296,7 | 1,251 |
| Водород | Н2 | 2,016 | 4124,0 | 0,0899 |
| Окись углерода | СО | 28,00 | 297,0 | 1,250 |
| Двуокись углерода | СО2 | 44,00 | 189,0 | 1,977 |
| Метан | СН4 | 16,04 | 518,3 | 0,717 |
| Аммиак | NH3 | 17,03 | 488,16 | 0,771 |
| Водяной пар | Н2О | 18,02 | (461,5) | (0,598) |
Таблица 3. Мольная теплоёмкость газов, кДж/(кмоль·К) и показатель адиабаты
| Газ | mсv | mcр | k |
| Одноатомный | 12,6 | 20,9 | 1,67 |
| Двухатомный (в том числе воздух) | 20,9 | 29,3 | 1,4 |
| Трёх -и многоатомный | 29,3 | 37,7 | 1,29 |