Тема занятия: Ковалентная, ионная, металлическая химическая связь.
Уважаемые студенты, самостоятельно разберите теоретический материал по теме, составьте краткий конспект в тетради и выполните тест после конспекта.
План:
Определение химической связи. Причины образования химической связи.
Ковалентная связь.
Ионная связь.
Металлическая связь
1. Определение химической связи. Причины образования химической связи.
Известны ковалентная связь, ионная связь, металлическая связь, водородная связь. Типы кристаллических решеток — ионная, атомная, молекулярная.
Под химической связью понимаются электрические силы притяжения, удерживающие частицы друг около друга. Частицами могут быть атомы, ионы, молекулы.
Причиной образования химической связи между частицами является стремление системы к минимуму энергии. Энергия образующейся системы — химической связи — меньше энергии, которой обладают изолированные частицы. Идет выигрыш в энергии.
Среди частиц самые устойчивые те, у которых внешний энергетический уровень завершен. Благородные газы на внешнем энергетическом уровне имеют октет электронов, у Не — 2е-. Таким образом, атомы, имеющие на внешнем энергетическом уровне меньше 8 электронов, стремятся приобрести структуру инертных газов, т. е. иметь октет электронов на внешнем энергетическом уровне.
Различают три случая образования химической связи.
а) Между атомами элементов, электроотрицательность которых одинакова;
б) Между атомами в металле, электроотрицательность которых также одинакова.
2. Между атомами элементов, электроотрицательность которых отличается, но не сильно.
3. Между атомами элементов, электроотрицательность которых резко отличается.
2. Ковалентная связь
Химическая связь, возникающая в результате образования общих электронных пар, называют ковалентной связью. Она возникает между атомами неметаллов. (Например: H2, HCl, H2O).
Н + Н →Н: Н – неполярная (между атомами одного элемента)
Ковалентная химическая связь бывает полярной и неполярной
Н + CI→ H: CI (между атомами неметаллов разных элементов)
По степени смещённости общих электронных пар к одному из связанных ими атомов ковалентная связь может быть полярной и неполярной.
Вспомним что такое электроотрицательность?
Электроотрицательность (ЭО) - это свойство атомов одного элемента притягивать к себе электроны от атомов других элементов.
Какой самый электроотрицательный химический элемент?
Самый электроотрицательный элемент – фтор F
Если связь образуется между двумя одинаковыми атомами или между атомами с одинаковым значением ЭО, то смещения общей электронной пары нет и такая связь носит название неполярной.
КОВАЛЕНТНАЯ НЕПОЛЯРНАЯ СВЯЗЬ(КНС) - образуют атомы одного и того же химического элемента - неметалла (Например: H2, O2, О3).
Механизм образования связи.
(Составление электронных формул молекул простых веществ неметаллов)
Число неспаренных электронов =8 – номер группы элемента
Например, у серы число неспаренных электронов равно 8 – 6 = 2.
Ковалентная связь – это химическая связь между атомами, осуществляемая при помощи общих электронных пар.. Электронная пара принадлежит в равной мере обоим атомам.
Рассмотрим механизм образования молекулы хлора: Cl2 – кнс.
Электронная схема образования молекулы Cl2:
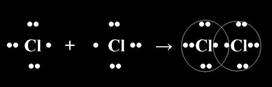 Структурная формула молекулы Cl2:.
σ
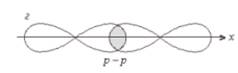
Cl – Cl, σ (p – p) - одинарная связь
Структурная формула молекулы Cl2:.
σ
Cl – Cl, σ (p – p) - одинарная связь
 Образование молекулы водорода
Атомы образуют связь, осуществляемую общей для них электронной парой, для достижения наиболее стабильной электронной конфигурации, которая может быть представлена следующим образом (электроны обозначены точками):
Образование молекулы водорода
Атомы образуют связь, осуществляемую общей для них электронной парой, для достижения наиболее стабильной электронной конфигурации, которая может быть представлена следующим образом (электроны обозначены точками):
 Электронную пару можно обозначить черточкой:
Электронную пару можно обозначить черточкой:
 Связь между двумя атомами образуется тогда, когда они приближаются друг к другу на расстояние, достаточное для того, чтобы электроны каждого из них оказались в пределах взаимодействия с ядром другого атома.
КОВАЛЕНТНАЯ ПОЛЯРНАЯ СВЯЗЬ (КПС)- образуют атомы разных неметаллов, отличающихся по значениям электроотрицательности (Например: HCl, H2O).
Механизм образования связи.
Каждый атом неметалла отдает в общее пользование другому атому свои наружные не спаренные электроны. Образуются общие электронные пары. Общая электронная пара смещена к более электроотрицательному элементу.
Рассмотрим механизм образования молекулы хлороводорода: НCl – кпс.
Электронная схема образования молекулы НCl:
Связь между двумя атомами образуется тогда, когда они приближаются друг к другу на расстояние, достаточное для того, чтобы электроны каждого из них оказались в пределах взаимодействия с ядром другого атома.
КОВАЛЕНТНАЯ ПОЛЯРНАЯ СВЯЗЬ (КПС)- образуют атомы разных неметаллов, отличающихся по значениям электроотрицательности (Например: HCl, H2O).
Механизм образования связи.
Каждый атом неметалла отдает в общее пользование другому атому свои наружные не спаренные электроны. Образуются общие электронные пары. Общая электронная пара смещена к более электроотрицательному элементу.
Рассмотрим механизм образования молекулы хлороводорода: НCl – кпс.
Электронная схема образования молекулы НCl:
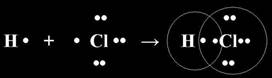 Общая электронная пара смещена к хлору, как более электроотрицательному. Значит это ковалентная связь. Она образована атомами, электроотрицательности которых несильно отличаются, поэтому это ковалентная полярная связь.
Структурная формула молекулы НCl:
σ
Н → Cl,
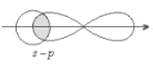
σ (s – p)
- одинарная связь σ, смещение электронной плотности в сторону более электроотрицательного атома хлора (→)
Общая электронная пара смещена к хлору, как более электроотрицательному. Значит это ковалентная связь. Она образована атомами, электроотрицательности которых несильно отличаются, поэтому это ковалентная полярная связь.
Структурная формула молекулы НCl:
σ
Н → Cl,
σ (s – p)
- одинарная связь σ, смещение электронной плотности в сторону более электроотрицательного атома хлора (→)
 Составление электронных формул молекул йодоводорода и воды:
электронная формула молекулы йодоводорода,
••
H •• J ••
••
структурная формула молекулы йодоводорода.
H → J
электронная формула молекулы воды,
••
H •• O ••
••
H
структурная формула молекулы воды.
Н →О
↑
Н
По степени смещенности общих электронных пар к одному из связанных ими атомов ковалентная связь может быть полярной и неполярной. При этом особую актуальность приобретает такое понятие как электроотрицательность.
Вещества с ковалентной связью характеризуются кристаллической решеткой 2-х типов (демонстрирую модели кристаллических решеток алмаза, графита, иода): атомной (алмаз, графит), молекулярная (хлор, иод и др.)
3. Ионная связь.
Химическую связь, возникающую между ионами (между металлами и неметаллами) называют ионной связью. При этом, поскольку заряд ядра атома имеет положительное значение, атом, который почти полностью отдал свои валентные электроны, превращается в положительно заряженную частицу — положительный ион, или катион. Атом, получивший электроны, превращается в отрицательно заряженную частицу — отрицательный ион, или анион:
Составление электронных формул молекул йодоводорода и воды:
электронная формула молекулы йодоводорода,
••
H •• J ••
••
структурная формула молекулы йодоводорода.
H → J
электронная формула молекулы воды,
••
H •• O ••
••
H
структурная формула молекулы воды.
Н →О
↑
Н
По степени смещенности общих электронных пар к одному из связанных ими атомов ковалентная связь может быть полярной и неполярной. При этом особую актуальность приобретает такое понятие как электроотрицательность.
Вещества с ковалентной связью характеризуются кристаллической решеткой 2-х типов (демонстрирую модели кристаллических решеток алмаза, графита, иода): атомной (алмаз, графит), молекулярная (хлор, иод и др.)
3. Ионная связь.
Химическую связь, возникающую между ионами (между металлами и неметаллами) называют ионной связью. При этом, поскольку заряд ядра атома имеет положительное значение, атом, который почти полностью отдал свои валентные электроны, превращается в положительно заряженную частицу — положительный ион, или катион. Атом, получивший электроны, превращается в отрицательно заряженную частицу — отрицательный ион, или анион: 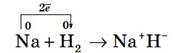 Ион — это одноатомная или многоатомная отрицательно либо положительно заряженная частица, в которую превращается атом в результате потери или присоединения электронов.
Между разноименно заряженными ионами при их сближении возникают силы электростатического притяжения — положительно и отрицательно заряженные ионы сближаются, образуя молекулу вещества.
Процесс присоединения электронов в ходе химических взаимодействий атомами с большей электроотрицательностью называется восстановлением, а процесс отдачи электронов атомами с меньшей электроотрицательностью — окислением.
Схему образования ионной связи между атомами натрия и хлора можно представить следующим образом:
Ион — это одноатомная или многоатомная отрицательно либо положительно заряженная частица, в которую превращается атом в результате потери или присоединения электронов.
Между разноименно заряженными ионами при их сближении возникают силы электростатического притяжения — положительно и отрицательно заряженные ионы сближаются, образуя молекулу вещества.
Процесс присоединения электронов в ходе химических взаимодействий атомами с большей электроотрицательностью называется восстановлением, а процесс отдачи электронов атомами с меньшей электроотрицательностью — окислением.
Схему образования ионной связи между атомами натрия и хлора можно представить следующим образом: 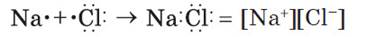 Ионная химическая связь присутствует в оксидах, гидроксидах и гидридах щелочных и щелочноземельных металлов, в солях, а также в соединениях металлов с галогенами.
Ионы могут быть как простыми (одноатомными): Cl–, Н+, Na+, так и сложными (многоатомными): NH4–. Заряд иона принято записывать вверху после знака химического элемента. Вначале записывается величина заряда, а затем его знак.
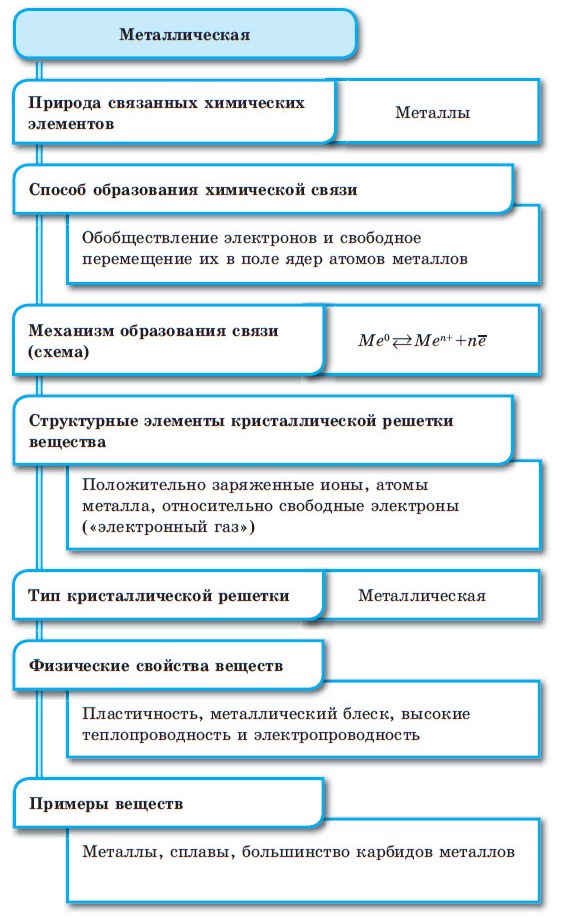
Металлическая связь
Между атомами металлов возникает особый вид химической связи, которая называется металлической. Образование этой связи обусловлено тремя особенностями строения атомов металлов:
· на внешнем энергетическом уровне присутствуют 1—3 электрона (исключения: атомы олова и свинца (4 электрона), атомы сурьмы и висмута (5 электронов), атом полония (6 электронов));
· атом имеет сравнительно большой радиус;
· атом имеет большое количество свободных орбиталей (например, у Na один валентный электрон располагается на 3-м энергетическом уровне, который имеет десять орбиталей (одну s-, три р- и пять d-орбиталей).
При сближении атомов металлов происходит перекрытие их свободных орбиталей, и валентные электроны получают возможность перемещаться на близкие по значениям энергии орбитали соседних атомов. Атом, теряющий электрон, превращается в ион. Таким образом, в металле формируется совокупность электронов, свободно перемещающихся между ионами. Притягиваясь к положительным ионам металла, электроны восстанавливают их, а затем снова отрываются, переходя к другим ионам. Такой процесс превращения атомов в ионы и обратно происходит в металлах непрерывно. Частицы, из которых состоят металлы, называют атом-ионами.
4. Металлическая связь
Металлическая связь — это связь, образующаяся между атом-ионами в металлах и сплавах посредством постоянного перемещения между ними валентных электронов:
Ионная химическая связь присутствует в оксидах, гидроксидах и гидридах щелочных и щелочноземельных металлов, в солях, а также в соединениях металлов с галогенами.
Ионы могут быть как простыми (одноатомными): Cl–, Н+, Na+, так и сложными (многоатомными): NH4–. Заряд иона принято записывать вверху после знака химического элемента. Вначале записывается величина заряда, а затем его знак.
Металлическая связь
Между атомами металлов возникает особый вид химической связи, которая называется металлической. Образование этой связи обусловлено тремя особенностями строения атомов металлов:
· на внешнем энергетическом уровне присутствуют 1—3 электрона (исключения: атомы олова и свинца (4 электрона), атомы сурьмы и висмута (5 электронов), атом полония (6 электронов));
· атом имеет сравнительно большой радиус;
· атом имеет большое количество свободных орбиталей (например, у Na один валентный электрон располагается на 3-м энергетическом уровне, который имеет десять орбиталей (одну s-, три р- и пять d-орбиталей).
При сближении атомов металлов происходит перекрытие их свободных орбиталей, и валентные электроны получают возможность перемещаться на близкие по значениям энергии орбитали соседних атомов. Атом, теряющий электрон, превращается в ион. Таким образом, в металле формируется совокупность электронов, свободно перемещающихся между ионами. Притягиваясь к положительным ионам металла, электроны восстанавливают их, а затем снова отрываются, переходя к другим ионам. Такой процесс превращения атомов в ионы и обратно происходит в металлах непрерывно. Частицы, из которых состоят металлы, называют атом-ионами.
4. Металлическая связь
Металлическая связь — это связь, образующаяся между атом-ионами в металлах и сплавах посредством постоянного перемещения между ними валентных электронов: 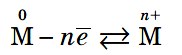 Металлы (вещества с металлической связью) очень разнообразны по своим физическим свойствам. Среди них есть жидкость (Hg), очень мягкие (Na, K) и очень твердые металлы (W, Nb).
Характерными физическими свойствами металлов является их высокая электропроводность (в отличие от полупроводников, уменьшается с ростом температуры), высокая теплоемкость и пластичность (у чистых металлов).
В твердом состоянии почти все вещества состоят из кристаллов. По типу строения и типу химической связи кристаллы ("кристаллические решетки") делят на атомные (кристаллы немолекулярных веществ с ковалентной связью), ионные (кристаллы ионных веществ), молекулярные (кристаллы молекулярных веществ с ковалентной связью) и металлические (кристаллы веществ с металлической связью).
Металлы (вещества с металлической связью) очень разнообразны по своим физическим свойствам. Среди них есть жидкость (Hg), очень мягкие (Na, K) и очень твердые металлы (W, Nb).
Характерными физическими свойствами металлов является их высокая электропроводность (в отличие от полупроводников, уменьшается с ростом температуры), высокая теплоемкость и пластичность (у чистых металлов).
В твердом состоянии почти все вещества состоят из кристаллов. По типу строения и типу химической связи кристаллы ("кристаллические решетки") делят на атомные (кристаллы немолекулярных веществ с ковалентной связью), ионные (кристаллы ионных веществ), молекулярные (кристаллы молекулярных веществ с ковалентной связью) и металлические (кристаллы веществ с металлической связью).
|
Закрепление
Выполнение тестовых заданий
1. Выписать вещества в столбик, определить вид связи, если связь ковалентная, определить полярная или неполярная.
K2O,
Na2S,
H2O
H2S
Cl2
F2
Fe,
HCl
N2
NaCl
K
Ca
2. Напишите схему образования химической связи в молекуле Н2S, F2
3. Найти соответствие между количеством не спаренных электронов и химическим элементом (в основном состоянии):
1) Cl а) 1
2) O б) 4
3) C в) 2