ЛИПЕЦКИЙ ГОСУДАРСТВЕННЫЙ
ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ
Кафедра управления автотранспортом
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
К самостоятельной расчётно-графической работе
по курсам «теплотехника»
«Термодинамика и рабочие процессы двигателей»
Составитель: Сундеева Н. М.
Липецк - 2000
Требования к выполнению практических заданий
1. Задания выполняются на бумаге формата А4.
2. Все расчёты выполняются с точностью до трёх знаков.
3. Графическое построение выполняется на миллиметровой бумаге формата А4.
4. Все расчёты производятся в системе СИ.
5. Результаты расчётов приводятся в виде таблиц.
Практическое задание № 1
«Газовая смесь»
Под газовой смесью понимают механическую смесь отдельных газов, не вступающих между собой ни в какие химические реакции. Каждый газ в смеси, независимо от других газов, полностью сохраняет все свои свойства и ведёт себя так, как если бы он один занимал весь объём смеси.
Газовая смесь может быть задана массовыми, объёмными и мольными долями.
Массовой долей называют отношение массы каждого газа к общей массе смеси:
gi = mi / mcм ,
где: gi – массовая доля компонента,
mi – масса газа,
mcм – масса смеси газов.
Объёмной долей называют отношение парциального объёма каждого газа к общему объёму смеси:
ri = Vi / VcM,
где: ri – объёмная доля,
Vi – парциальный объём газа,
VcM – объём смеси газов.
Мольной долей называется отношение числа киломолей каждого газа к числу киломолей смеси газов:
mi = Мi / Мcм ,
Отношение элементарной теплоты dq, полученной единицей количества вещества к бесконечно малому изменению температуры dT называют истиной теплоёмкостью тела в заданном процессе:
С = dq / dT,
Теплоёмкость, отнесённую к единице количества вещества, называют удельной теплоёмкостью тела в заданном процессе:
С х = (dq / dT)х,
где х показывает,что изменение температуры происходит при р = const или
v = const.
Различают массовую, объёмную и мольную удельные теплоёмкости.
Теплоёмкость, отнесённую к 1кг вещества, называют массовой, С х , [кДж/ (кг*град)].
Теплоёмкость, отнесённую к 1 м3 газа при нормальных физических условиях, т. е. р = 101325 Н/м2 и То = 273 0К, называют объёмной, С¢х, [кДж/ (м3*град)].
Теплоёмкость, отнесённую к 1 кмоль газа, называют мольной, mСх, [кДж / (кмоль*град)].
Между указанными теплоёмкостями существует следующая связь:
С х = С¢х v0 = mСх / m
где: v0 – удельный объём газа в нормальных физических условиях;
m - молекулярная масса.
Методика выполнения задания № 1
1. Массовая доля газов, составляющих смесь, находят по формулам:
gi = (mi ri) / mcм,
где: mi – молекулярная масса компонента:
mн2о = 18,016 кг / кмоль;
mco2 = 44 кг / кмоль;
mo2 = 32 кг / кмоль;
m N2 = 28,02 кг / кмоль;
ri - объёмная доля;
mcм – кажущаяся молекулярная масса смеси:
mcм = S mi × ri.
2. Газовая постоянная компонентов:
Ri = mR / mi;
где: mR – универсальная газовая постоянная,
mR = 8314,20 Дж / (кмоль. град).
Газовая постоянная смеси:
Rcм = mR / mcм .
3. Удельные веса газов, составляющих данную смесь:
gi = g (mi /v0),
где: g – ускорение свободного падения, g = 9,81 м/с2,
v0 – удельный объём 1 кмоль газа при нормальных условиях, v0 = 22,414 м3 / кмоль.
4. Парциальные давления компонентов, составляющих смесь при нормальных условиях:
рi = pcм × ri;
где: pcм – давление смеси при нормальных условиях, pcм = 760 мм рт. ст.
Удельные веса при их парциальных давлениях в смеси при t = 55 0С:

|
 gi = gсм рi Т0
gi = gсм рi Т0
6. Средняя мольная теплоёмкость каждого газа в процессе при постоянном объёме в интервале температур от T1 до T2:
 |  |  |


 mCvmiô = (m Cviô× T2 - m Cviô× T1) / (T2 – T1) (кДж/кмоль ×град),
mCvmiô = (m Cviô× T2 - m Cviô× T1) / (T2 – T1) (кДж/кмоль ×град),
где: mCvmi – средняя мольная теплоемкость каждого газа в процессе при постоянном объёме.
Средняя мольная теплоёмкость каждого газа при постоянном давлении в интервале в интервале температур от T1 до T2:
 |  |  |


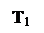 mCpiô = (mCpiô× T2 - mCpiô× T1) / (T2 – T1) (кДж/кмоль ×град),
mCpiô = (mCpiô× T2 - mCpiô× T1) / (T2 – T1) (кДж/кмоль ×град),
где mCрi – мольная теплоемкость каждого газа при постоянном давлении.
Средняя мольная теплоёмкость смеси при постоянном объёме и постоянном давлении:
mCvсмm = åmCvim×ri (кДж/кмоль ×град);
mCрсмm = åmCрim×ri (кДж/кмоль ×град).
Массовая теплоёмкость смеси в процессе при постоянном объёме и постоянном давлении:
mCvсмm = mCvсмm / mсм (кДж / кг град);
mCрсмm = mCрсмm / mсм (кДж / кг град).
Объёмная теплоемкость смеси в процессе при постоянном объёме и постоянном давлении:
mC¢vсмm = mCvсмm / 22,4 (кДж / м3 град);
mC¢рсмm = mCрсмm / 22,4 (кДж / м3 град) .
7. Количество тепла, которое отдаёт один кмоль в процессе при постоянном объёме:
qv = mCvсмm (T2 – T1) (кДж/кмоль);
при постоянном давлении:
qр = mCрсмm (T2 – T1) (кДж/кмоль).
Количество тепла, которое отдаёт один килограмм в процессе при постоянном давлении:
qv = mCvсмm (T2 – T1) (кДж/кг);
qр = mCрсмm (T2 – T1) (кДж/кг).
Количество тепла, которое отдаёт один кубический метр в процессе при постоянном объёме и постоянном давлении:
qv = mC¢vсмm (T2 – T1) (кДж/м3);
qр = mC¢рсмm (T2 – T1) (кДж/м3).
Контрольные вопросы к заданию № 1
1. Что называется молекулярной массой газа?
2. Характеристическое уравнение состояния для идеального газа.
3. Уравнение Клапейрона для любого количества газа.
4. Размерность газовой постоянной и её физический смысл.
5. Что называется киломолем газа?
6. Дать определение универсальной газовой постоянной и её размерность.
7. Для чего вводится в термодинамику понятие об идеальном газе?
8. Что такое газовая смесь?
9. Что называется парциальным давлением?
10. Что называется массовой, объёмной и мольной долями?
11. Что называется парциальным или приведённым объёмом?
12. Какая существует зависимость между удельным объёмом, плотностью, молекулярной массой и газовой постоянной?
13. Почему молекулярная масса смеси называется средней молекулярной массой?
14. Как определяется кажущаяся (средняя) молекулярная масса смеси газов?
15.Истиная, удельная, средняя теплоёмкости.
ИСХОДНЫЕ ДАННЫЕ
| № варианта | Объёмный состав продуктов сгорания топлива | T1 | T2 | |||
| rco2 | rн2о | ro2 | rN2 | |||
| 0,09 0,10 0,11 0,12 0,13 0,14 0,15 0,16 0,17 0,18 0,19 0,18 0,17 0,16 0,15 0,14 0,13 0,12 0,11 0,10 0,09 0,09 0,10 0,11 0,12 0,13 0,14 0,15 0,16 0,17 0,18 0,19 0,19 0,18 0,16 0,17 | 0,04 0,05 0,06 0,07 0,08 0,09 0,10 0,11 0,11 0,10 0,09 0,08 0,07 0,06 0,05 0,04 0,04 0,05 0,06 0,07 0,08 0,09 0,10 0,11 0,11 0,10 0,09 0,08 0,07 0,06 0,05 0,04 0,04 0,05 0,06 0,07 | 0,01 0,02 0,03 0,04 0,05 0,06 0,06 0,05 0,04 0,03 0,02 0,01 0,01 0,02 0,03 0,04 0,05 0,06 0,06 0,05 0,04 0,03 0,02 0,01 0,01 0,02 0,03 0,04 0,05 0,06 0,06 0,05 0,04 0,03 0,04 0,05 | 0,86 0,83 0,80 0,77 0,74 0,71 0,69 0,68 0,68 0,69 0,70 0,73 0,75 0,76 0,77 0,78 0,78 0,77 0,77 0,78 0,79 0,79 0,78 0,77 0,76 0,75 0,74 0,73 0,72 0,71 0,71 0,72 0,73 0,74 0,74 0,71 | |||
| 0,15 0,14 0,12 0,13 0,11 0,10 0,09 0,09 0,10 0,11 0,12 0,13 0,14 0,15 0,16 0,17 0,18 0,19 0,19 0,18 0,17 0,16 0,15 0,14 0,13 0,12 0,11 0,10 0,09 0,11 0,13 0,15 0,17 0,19 | 0,08 0,09 0,10 0,11 0,11 0,10 0,09 0,08 0,07 0,06 0,05 0,04 0,04 0,05 0,05 0,06 0,06 0,07 0,07 0,08 0,08 0,09 0,09 0,10 0,10 0,11 0,11 0,09 0,08 0,07 0,06 0,05 0,04 0,04 | 0,06 0,01 0,05 0,04 0,03 0,02 0,01 0,02 0,03 0,04 0,05 0,06 0,06 0,05 0,06 0,05 0,04 0,03 0,04 0,05 0,06 0,03 0,02 0,01 0,01 0,02 0,04 0,03 0,06 0,05 0,02 0,06 0,04 0,01 | 0,71 0,76 0,73 0,72 0,75 0,77 0,81 0,81 0,80 0,79 0,78 0,77 0,76 0,75 0,73 0,72 0,72 0,71 0,70 0,69 0,69 0,72 0,74 0,75 0,76 0,75 0,74 0,78 0,77 0,77 0,79 0,74 0,75 0,76 |
Практическое задание №2
«Основные термодинамические процессы»
К основным процессам, имеющим большое значение, как для теоретических исследований, так и для практических работ в технике, относятся: изохорный, изобарный, изотермный, адиабатный.
Кроме того, существует группа процессов, являющихся при определённых условиях обобщающими для основных процессов. Эти процессы называются политропными.
Для всех процессов устанавливается общий метод исследования, заключающейся в следующем:
1. Выводится уравнение кривой процесса на pv и TS – диаграммах;
2. Устанавливается зависимость между основными параметрами рабочего тела в начале и конце процесса.
3. 

 Определяется изменение внутренней энергии по формуле:
Определяется изменение внутренней энергии по формуле:
DU = U2 – U1 = ò Cv dT = Cv m ôT2 – CVm ô T1,
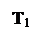 |  |  |
при постоянной теплоёмкости:
DU = U2 – U1 = Cv (Т2 – Т1).
4. Вычисляется работа изменения объема по основной формуле:
 |
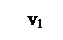 l = ò pdv;
l = ò pdv;
 располагаемая или полезная внешняя работа:
располагаемая или полезная внешняя работа:
 l = ò vdp;
l = ò vdp;
5. Определяется количество теплоты участвующее в процессе:
 |  |  |
q1-2 = ò CxdT = Cxm ô×T2 – Cxm ô× T1,
 |  |  |
6. Определяется изменение энтальпии в процессе по формуле, справедливой для всех процессов:
 | 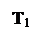 |

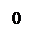 Di = i2 – i1 = Cpm ô×T2 – Cpm ô ×T1,
Di = i2 – i1 = Cpm ô×T2 – Cpm ô ×T1,
при постоянной теплоёмкости:
Di = i2 – i1 = Cp(Т2 – Т1);
7. Определяется изменение энтропии:
S2 – S1 = C ln(T2 – T1) + R ln(v2 – v1),
S2 – S1 = C p ln(T2 – T1) + R ln(p2 – p1),
S2 – S1 = C p ln(v2 – v1) + C ln(p2 – p1).
Методика расчёта задания №2
1. Основные термодинамические параметры состояния во всех характерных точках цикла рассчитывается в зависимости от процессов, из которых состоит данный цикл.
Соотношения между основными параметрами состояния:
для изобарного процесса, p = const:
v1/ v2 = T1/T2;
для изохорного процесса, v = const:
p2/p1 = T2/T1;
для изотермного процесса, Т = const:
p1/p2 = v2/v1;
для адиабатного процесса, dQ = 0, pvk = const:
p1/p2 = (v2/v1) k; v2/v1 = (p1/p2)1/k; T1/T2 = (v2/v1) k-1 = (p1/p2)(k-1)/k;
где k – показатель адиабаты, k = Cp/Cv.
для политропного процесса, pvn = const:
p1/p2 = (v2/v1) n; T2/T1 = (v1/v2) n-1 = (p2/p1)(n-1)/n;
где n – показатель политропы, n = (Cn – Cp) / (Cn – Cv);
Cn – теплоёмкость политропного процесса.
для изохорного процесса n = ±¥, Cn = Cv;
изобарного процесса n = 0, Cn = Cp = k C;
изотермного процесса n =1, Cn = ±¥;
адиабатного процесса n = k, Cn = 0.
Для определения недостающих параметров можно воспользоваться уравнением Клапейрона:
pV = mRT, где m – масса компонента.
Для удобства дальнейших расчетов полученные результаты свести в таблицу, по полученным данным построить цикл в pv – координатах:
Таблица 1