ИЗМЕНЕНИЕ ЭНТРОПИИ В ПРОЦЕССАХ ТЕПЛООБМЕНА
Цель работы: Экспериментальное определение изменения энтропии в процессах теплообмена между телами.
Приборы и принадлежности:
1. Калориметр.
2. Технические весы.
3. Разновес.
4. Термометры.
5. Плитка.
6. Химический стакан.
7. Мешалка.
8. Набор испытуемых тел.
10.1. Теоретическое введение
Первое начало термодинамики или закон сохранения энергии для термодинамических систем не исключает возможности процессов, которые в действительности не реализуются. Например, с помощью воздуха холодного помещения нельзя увеличить температуру горячей батареи водяного отопления, хотя такой процесс не противоречил бы первому началу термодинамики. Действительно, с точки зрения первого начала термодинамики батарея получит столько тепла, насколько уменьшится внутренняя энергия воздуха. Но самопроизвольно такой процесс не пройдет.
На направленность реально протекающих процессов указывает второе начало термодинамики: возможны процессы, единственным результатом которых являлся бы переход тепла от тел, менее нагретых к более нагретым.
Второе начало термодинамики может быть сформулировано также следующим образом: невозможны такие процессы, единственным конечным результатом которых явилось бы отнятие от тел некоторого количества тепла и превращение этого тепла полностью в работу.
Третья формулировка дает математическую интерпретацию второго начала термодинамики на основе некоторой функции состояния тел, называемой энтропией S. Приращение энтропии определяется приращенным теплом  . Приведенным теплом называется отношение теплоты, полученной системой тел, к температуре, при которой эта передача осуществляется. Итак, в изолированных системах все процессы самопроизвольно могут протекать в направлении
. Приведенным теплом называется отношение теплоты, полученной системой тел, к температуре, при которой эта передача осуществляется. Итак, в изолированных системах все процессы самопроизвольно могут протекать в направлении  , где знак равенства справедлив для обратимых процессов, а для необратимых процессов – приращение энтропии всегда больше нуля.
, где знак равенства справедлив для обратимых процессов, а для необратимых процессов – приращение энтропии всегда больше нуля.
Процесс называется обратимым, если система может вернуться в первоначальное состояние, пройдя в обратном порядке все промежуточные состояния, причем после окончания процесса не должно остаться никаких изменений в окружающей среде (процесс обратим даже, если обратный ему процесс не осуществлен, а только в принципе возможен). Реальные процессы связаны с обратимыми потерями. Процесс выравнивания температур тем ближе к обратному (dS – оставаясь всегда положительным, уменьшается), чем быстрее во всем объеме тел исчезают местные, локальные неоднородности температур соприкасающихся тел, рассчитанная на единицу объема, обратно пропорциональна теплоемкости тела.
Если в калориметр, содержащий определенное количество воды при заданной температуре, опустить нагретое тело, то произойдет теплообмен и установится общая температура. Если повторить опыт с теми же исходными данными, уменьшив теплоемкость погружаемого тела, то получим более близкий к обратному процесс. Степень его обратимости в изолированной системе определяется на основе измерения приращения энтропии dS.
Изменение энтропии системы запишем из следующих соображений: энтропия системы в начальном состоянии S0 (воде, калориметр, термометр с начальной температурой Т0 и нагретое до температуры Т1 тело), а затем в конечном – S (тело погрузили в калориметр с водой и система приняла температуру Т, где T0 < T < T1). Тогда ∆S = S – S0 и энтропия любого тела с температурой Т
 (10.1)
(10.1)
где dQ = mcdT – количество тепла, которое пошло на нагревание тела массой m, причем удельная теплоемкость тела С – некоторая функция температуры.
Итак, энтропия в начальном состоянии равна сумме энтропией всех тел, составляющих систему. Непосредственно перед опытом
 (10.2)
(10.2)
где  энтропия воды;
энтропия воды;
 энтропия калориметра;
энтропия калориметра;
 энтропия термометра;
энтропия термометра;
 энтропия тела.
энтропия тела.
В начальном состоянии с учетом (10.1)
 (10.3)
(10.3)
В конечном состоянии энтропия системы
 (10.4)
(10.4)
По второму закону термодинамики при выравнивании температур в системе энтропия возрастает, т.е. dS > 0. Таким образом,
 (10.5)
(10.5)
где dQ – для каждого тела определяется его теплоемкостью.
Для металлов теплоемкость растет по кубическому закону до температур порядка 150 К, затем медленнее, а при температурах 250 – 270 К практически постоянна. При дальнейшем возрастании температуры теплоемкость твердых тел очень медленно растет, меняясь в четвертом знаке после запятой. Поэтому в работе можно принять СК, СТЕРМ, СТ постоянными (табл.1).
Теплоемкость жидкостей в большинстве случаев выражается так: С = С0 + αТ, где t – температура по шкале Цельсия, имеет порядок 10-3. Поэтому при нагревании воды в процессе опыта на несколько градусов, можно не учитывать зависимость ее теплоемкости от температуры (табл.1).
С учетом вышесказанного имеем
 (10.6)
(10.6)
Таблица 1
| Вещество | Вода | Калориметр | Термометр | Латунь | Сталь | Медь | Олово | Свинец |
| С (Дж/кг·К) |
Произведя опыт с различными телами, вычислите изменение энтропии ∆S и удостоверьтесь, что второй закон термодинамики выполняется, т.е. в процессе выравнивания температур энтропия возрастает (∆S >0).
10.2.Порядок выполнения работы
10.2.1.Взвесьте калориметрический стакан и налейте в него 150 – 200 см3 воды.
10.2.2.Взвесьте стакан с водой, определите массу воды. (Данные занесите в табл.2).
10.2.3.Включите плитку с химическим стаканом. В стакан опустите тело и термометр.
10.2.4.Поместите калориметр подальше от нагревателя и определите температуру воды Т0 в калориметре.
10.2.5.После того, как термометр в химическом стакане покажет температуру 65 0С, плитку выключите, и следите за ходом температуры. Как только рост температуры прекратиться, отметьте температуру Т и быстро переносите тело в калориметр, предварительно пододвинув его к нагревателю.
10.2.6.Калориметр закройте, отодвиньте от нагревателя и следите за ростом температуры.
10.2.7.Зафиксируйте максимальное значение температуры Т в калориметре и найдите ∆S.
Таблица 2
| № | mТЕРМ, кг | mв, кг | mК, кг | mT, кг | T0, K | T1, K | T, K | S0, Дж/К | S, Дж/К | ∆S, Дж/К |
Примечания:
1. Важно, чтобы в каждом опыте количество и начальная температура воды в калориметре были одинаковыми.
2. Мешалкой пользуйтесь только в конце процесса роста температуры, делая не более 3 – 5 помешиваний.
3. Натуральные логарифмы вычислите с точностью до четырех знаков, пользуясь таблицами.
10.3.Контрольные вопросы
10.3.1.Сформулируйте первое и второе начала термодинамики.
10.3.2.Какое начало термодинамики говорит о направлении процессов, протекающих вокруг нас?
10.3.3.Что такое энтропия? В каких единицах она измеряется?
10.3.4.Дайте определение обратимого и необратимого процессов.
10.3.5.что является мерой обратимости данного реального процесса? В каком случае процесс ближе к обратимому?
Литература
1. Путилов К.А. «Курс физики», т.1, М., 1963.
2. Зисман Г.А., Тодес О.М. «Курс общей физики», т.1, М., 1974.
3. «Физический практикум» под редакцией проф. Ивероновой, «Наука», М., 1976.
ЛАБОРАТОРНАЯ РАБОТА № 11
ОПРЕДЕЛЕНИЕ СРЕДНЕЙ ДЛИНЫСВОБОДНОГО ПРОБЕГА
И ЭФФЕКТИВНОГО ДИАМЕТРА МОЛЕКУЛ ВОЗДУХА
Цель работы: Определение средней длины пробега молекул и эффективного диаметра молекул воздуха.
Приборы и принадлежности:
1. Сосуд с краном и капилляром.
2. Секундомер.
3. Весы с разновесом.
4. Линейка.
5. Стакан.
11.1.Теоретическое введение
Хаотическое движение молекул, согласно молекулярно – кинетической теории, является физической причиной наблюдаемых в газах и жидкостях явлений переноса: диффузии (перенос массы при выравнивании концентраций), теплопроводности (перенос энергии при выравнивании температур), вязкости (перенос импульса).
Хотя скорости молекул могут достигать нескольких сотен метров в секунду, процессы переноса совершаются сравнительно медленно. Причиной этому является столкновение между молекулами, в результате которых их движение происходит по ломаной линии, а не прямолинейно.
Расстояние, пройденное молекулой между двумя последовательными столкновениями, называется длиной свободного пробега (λ). Длина свободного пробега – случайная величина.
Каждый раз молекула проходит различные расстояния между двумя столкновениями, поэтому целесообразно рассчитывать среднюю длину свободного пробега < λ >.
Известно, что силы межмолекулярного взаимодействия становятся заметными лишь на достаточно малых расстояниях, поэтому путь между столкновениями пройдет молекула в равномерном и прямолинейном движении.
Отклонение молекул от прямолинейных траекторий происходит при столкновениях. Минимальное расстояние между центрами двух молекул при их столкновении называется эффективным диаметром молекул d.
В данной работе путем коэффициента внутреннего трения проводится определение длины свободного пробега и эффективного диаметра молекул воздуха.
Для определения < λ > и d используется установка, изображенная на рис.1. Сосуд на три четверти заполнен водой. Сверху закрыт пробкой, в которую вставлен капилляр.
Если снизу сосуда открыть кран, то вода будет выливаться из сосуда непрерывной струей, а потом сериями отдельных капель. В то же время, через верхний капилляр в сосуд будет насасываться воздух. Так как капилляр очень узок и воздух просачивается очень медленно, то его концы будут находиться под разным давлением: верхний – под атмосферным, нижний – меньше атмосферного. Объем газа V, прошедшего сквозь узкую трубку с круглым внутренним сечением за время τ определяется формулой Пуазейля

 , (11.1)
, (11.1)
где r и ℓ - соответственно радиус и длина капиллярной трубки;
∆р – разность давлений на концах капилляра, которая обуславливает течение газа (или жидкостей).
Из уравнения (11.1) коэффициент внутреннего трения (вязкости) выразится соотношением:
 . (11.2)
. (11.2)
Здесь все величины доступны непосредственному измерению.
С другой стороны, молекулярно-кинетическая теория устанавливает связь между коэффициентами вязкости, средней длиной свободного пробега <λ> и средней арифметической скоростью их движения (<υ>)
 , (11.3)
, (11.3)
где ρ – плотность газа.
Средняя скорость молекул газа может быть найдена по формуле молекулярно-кинетической теории
 , (11.4)
, (11.4)
где R – универсальная газовая постоянная, равная 8,31∙103 Дж/кмоль;
Т – абсолютная температура;
μ – масса одного моля газа (для воздуха ≈ 29 кг/кмоль).
Плотность газа можно найти из уравнения Менделеева - Клапейрона
 . (11.5)
. (11.5)
Откуда
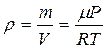 , (11.6)
, (11.6)
где Р – давление газа.
Подставляя формулы (11.2), (11.4), (11.6) в (11.3) и производя элементарные преобразования, получим формулу для определения <λ>
 . (11.7)
. (11.7)
Средняя длина свободного пробега связана с эффективным диаметром молекулы (d) соотношением
 , (11.8)
, (11.8)
где n – число молекул в единице объема, которое определяем из уравнения состояния идеального газа
 , (11.9)
, (11.9)
где n0 – число Лошмидта, т.е. число молекул в единице объема (1 см3) при нормальных условиях (Р0 = 1,013∙105 Н/м2, n0 = 2,69∙1025 м-3, Т0 = 273 К).
Применяя формулы (11.8) и (11.9), получаем выражение для эффективного диаметра молекул газа
 . (11.10)
. (11.10)
11.2Порядок выполнения работы
11.2.1Открыть кран и подождать, когда вода начнет вытекать из сосуда каплями, подставить предварительно взвешенный стаканчик.
11.2.2.Когда в стаканчике воды будет около 50 – 70 см3 перекрыть кран, записать время истечения жидкости и сделать отсчет по шкале нового уровня воды в сосуде (h2).
11.2.3.По весу стаканчика с водой определить ее объем, который будет равен объему воздуха, вошедшего в сосуд через капилляр.
11.2.4.Средняя разность давлений, под действием которой воздух входит в сосуд, может быть найдена по формуле
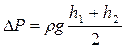 .
.
11.2.5.Температуру определить по комнатному термометру, атмосферное давление – по барометру.
11.2.6.Вычислить среднюю длину свободного пробега и найти, используя эти данные, эффективный диаметр молекулы воздуха.
11.2.7.Радиус капилляра и его длину возьмите по указанию преподавателя.
11.2.8.Вычислить погрешности измерений <λ> и <d> по формулам
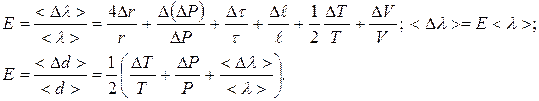 (11.11);(11.12)
(11.11);(11.12)
Записать окончательный результат в виде

11.3.Контрольные вопросы
11.3.1.Какие явления называются явлениями переноса? Почему они так называются?
11.3.2.Дайте определение средней длины свободного пробега молекул и получите формулу (11.7) для определения <λ>.
11.3.3.Что понимают под эффективным диаметром молекул? Получите расчетную формулу для определения <λ>.
11.3.4.Исходя из уравнения состояния идеального газа, выведите формулу (11.9).
11.3.5.Какая связь между величинами, определяющими скорость молекул, среднюю длину свободного пробега их, и числом соударений в единицу времени.
11.3.6.Что называется коэффициентом вязкости, каков его физический смысл и каковы единицы измерения его в системе «СИ» и «СГС».
11.3.7.Докажите справедливость формул (11.11) и (11.12).
Литература
1. Лабораторный практикум по физике под редакцией В.А.Базакуцы, издательство Харьковского университета, 1969.
2. Описание к лабораторной работе «Определение длины свободного пробега и эффективного диаметра молекул воздуха». Издательство Московского станкостроительного института, 1967.
3. И.В. Савельев. «Курс общей физики», ч.1, 1977.
4. Яворский Б.М., Детлаф А.А. и др. «Курс физики», ч.1, 1973.
Оглавление
Стр.
| Лабораторная работа № 1 – // – № 2 – // – № 3 – // – № 4 – // – № 5 – // – № 6 – // – № 7 – // – № 8 – // – № 9 – // – № 10 – // – № 11 | Определение плотности твердого тела правильной формы. Определение ускорения силы тяжести по способу Бесселя. Определение ускорения силы тяжести наблюдением свободного падения тела. Изучение основного закона динамики вращательного движения. Определение момента инерции махового колеса динамическим методом. Определение длины звуковой волны и скорости звука по фазовым соотношениям. Изучение затухающих колебаний. Определение отношения удельной теплоемкости газа при постоянном давлении и удельной теплоемкости при постоянном объеме методом Клемана и Дезорма. Определение коэффициента вязкости жидкости. Изменение энтропии в процессах теплообмена. Определение средней длины свободного пробега и эффективного диаметра молекул воздуха. |