Галогены.
Хлор. Соединения хлора.
I. Хлор - простое вещество
Получение
· В промышленности хлор получают электролизом расплава или раствора хлорида натрия:
2NaCl 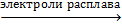 2Na + Cl2↑
2Na + Cl2↑
2NaCl + 2H2O 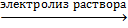 H2↑ + 2NaOH + Cl2↑
H2↑ + 2NaOH + Cl2↑
· В лаборатории хлор получают взаимодействием соляной кислоты с сильными окислителями, например:
MnO2 + 4HCl = MnCl2 + Cl2↑ + 2H2O
2KMnO4 + 16HCl = 2MnCl2 + 2KCl + 5Cl2↑ + 8H2O
KClO3 + 6HCl = KCl + 3Cl2↑ + 3H2O
K2Cr2O7 + 14HCl = 2CrCl3 + 2KCl + 3Cl2↑ + 7H2O
Химические свойства. Свободный хлор реагирует со всеми простыми веществами, за исключением кислорода, азота и благородных газов. Хлор проявляет сильные окислительные свойства в реакциях как с простыми веществами – неметаллами и металлами, так и со сложными веществами:
· С неметаллами
Cl2 + H2 = 2HCl 3Cl2+ 2P = 2PCl3 5Cl2 + 2P = 2PCl5
2Cl2 + Si = SiCl4 2Cl2 + C (кокс) + 2H2O (пар)= CO2 + 4HCl
· С металлами
Cl2 + 2Na = 2NaCl Cl2 + Mg = MgCl2 3Cl2 + 2Fe = 2FeCl3
· Со сложными веществами
Cl2 + H2O↔ HCl + HClO (хлорная вода)
2Cl2 + 2H2O = 4HCl + O2 (на свету или кип.)
Сl2 + 2NaOH(хол.) = NaCl + NaClO + H2O
3Cl2 + 6NaOH(гор.) = 5NaCl + NaClO3 + 3H2O
2Сl2 + 2Са(OH)2 (хол.) = СaCl2 + Сa(ClO)2 + 2H2O хлорная известь
Cl2 + 2NaI = 2NaCl + I2 Cl2 + H2S = S + 2HCl
Cl2 + 3H2O2 = 2HCl + 2H2O + O2
Cl2 + H2O + Na2SO3 = 2HCl + Na2SO4
II. Соединения хлора
1) Хлороводород. Хлороводород получают действием концентрированной соляной кислоты на твердый хлорид натрия:
H2SO4(конц.) + NaCl(тверд.) = NaHSO4 + HCl↑
Хлороводород получают также прямым взаимодействием простых веществ:
Cl2 + H2 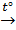 2HCl
2HCl
2) Кислоты
Соляная кислота. В химических реакциях соляная кислота проявляет все свойства сильных кислот: взаимодействует с металлами, стоящими в ряду напряжений левее водорода, с оксидами (основными, амфотерными), основаниями, амфотерными гидроксидами и солями:
2HCl + Fe = FeCl2 + H2
2HCl + CaO = CaCl2 + H2O
6HCl + Al2O3 = 2AlCl3 + 3H2O
HCl + NaOH = NaCl + H2O
2HCl + Cu(OH)2 = CuCl2 + 2H2O
2HCl + Zn(OH)2 = ZnCl2 + 2H2O
HCl + NaHCO3 = NaCl + CO2↑ + H2O
HCl + AgNO3 = AgCl↓ + HNO3 (качественная реакция на галогенид-ионы)
6HCl(конц.) + 2HNO3(конц.) = 3Cl2 + 2NO + 4H2O
Кислородсодержащие кислоты:
HClO HClO2 HClO3 HClO4
Хлорноватистая хлористая хлорноватая хлорная
Усиление кислотных свойств
2HClO 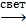 2HCl + O2 HClO + 2HI = HCl + I2 + H2O
2HCl + O2 HClO + 2HI = HCl + I2 + H2O
HClO + H2O2 = HCl + H2O + O2
3) Соли
Соли соляной кислоты – хлориды.
AgCl + 2(NH3∙ H2O) = [Ag(NH3)2]Cl + 2H2O
2AgCl 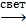 2Ag + Cl2
2Ag + Cl2
Соли кислородсодержащих кислот.
| Кислота | название солей |
| HClO | гипохлориты |
| HClO2 | хлориты |
| HClO3 | Хлораты |
| HClO4 | перхлораты |
NaClO + 2HCl = NaCl + Cl2 + H2O
Ca(ClO)2 + H2SO4 = CaSO4 + 2HCl + O2
Ca(ClO)2 + CO2 + H2O = CaCO3 + 2HCl + 2O2
Ca(ClO)2 + Na2CO3 = CaCO3 + 2NaClO
Ca(ClO)2 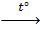 CaCl2 + O2
CaCl2 + O2
4KClO3 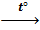 3KClO4 + KCl
3KClO4 + KCl
Бертолетова соль
2KClO3 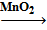 2KCl + 3O2↑
2KCl + 3O2↑
KClO4 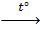 2O2 + KCl
2O2 + KCl
III. Бром. Соединения брома. По химической активности бром занимает промежуточное положение между хлором и иодом.
Br2 + H2 = 2HBr 3Br2 + 2Fe = 2FeBr3
Br2 + H2O = НBr + НBrO – бромная вода
3Br2 + 6NaOH(конц.) = 5NaBr + NaBrO3 + 3H2O при нагревании
Br2 + 2NaOH(конц.) = NaBr + NаBrO + H2O без нагревания
3Br2 + 3Na2CO3 = 5NaBr + NaBrO3 + 3CO2
3Br2 + S + 4H2O = 6HBr + H2SO4
Br2 + SO2 + 2H2O = 2HBr + H2SO4
Br2 + 2NaI = 2NaBr + I2 Br2 + H2S = S + 2HBr
4Br2 + Na2S2O3 + 10NaOH = 2Na2SO4 + 8NaBr + 5H2O
14HBr + K2Cr2O7 = 2KBr + 2CrBr3 + 3Br2 + 7H2O
4HBr + MnO2 = MnBr2 + Br2 + 2H2O
2HBr + H2O2 = Br2 + 2H2O
2KBr + 2H2SO4 (конц.) = 4K2SO4 + 4Br2 + SO2 + 2H2O
2KBrO3 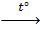 3O2 + 2KBr
3O2 + 2KBr
2KBrO4 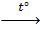 O2 + 2KBrO3 (до 275°С)
O2 + 2KBrO3 (до 275°С)
KBrO4 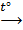 2O2 + KBr (выше 390°С)
2O2 + KBr (выше 390°С)
IV. Йод. Соединения йода.
Йод существенно отличается по химической активности от остальных галогенов. Он не реагирует с большинством неметаллов, а с металлами медленно реагирует только при нагревании.
3I2 + 3P = 2PI3 I2 + H2 = 2HI I2 + Fe = FeI2
Йод практически в воде не растворим и не способен ее окислять даже при нагревании; по этой причине не существует «йодной воды».
3I2 + 6NaOH(гор.) = 5NaI + NaIO3 + 3H2O
I2 + 2NaOH(хол) =NaI + NaIO + H2O
3I2 + 10HNO3(разб) = 6HIO3 + 10NO + 2H2O
I2 + 10HNO3(конц.)= 2HIO3 + 10NO2 + 4H2O
I2 + 5NaClO + 2NaOH = 5NaCl + 2NaIO3 + H2O
I2 + 5Cl2 + 6H2O = 10HCl + 2HIO3
I2 + Na2SO3 + 2NaOH = 2NaI + Na2SO4 + H2O
2HI + 2FeCl3 = I2 + 2FeCl2 + 2HCl
2HI + Fe2(SO4)3 = 2FeSO4 + I2 + H2SO4
2HI + NO2 = I2 + NO + H2O
2HI + S = I2 + H2S
8KI + 5H2SO4 (конц.) = 4K2SO4 + 4I2 + H2S + 4H2Oили
8KI + 9H2SO4(конц.) = 4I2↓ + H2S↑ + 8KHSO4 + 4H2O
KI + 3H2O + 3Cl2 = HIO3 + KCl + 5HCl
10KI + 8H2SO4 + 2KMnO4 = 5I2 + 2MnSO4 + 6K2SO4 + 8H2O
6KI + 7H2SO4 + K2Cr2O7 = Cr2(SO4)3 + 3I2 + 4K2SO4 + 7H2O
2KI + H2SO4 + H2O2 = I2 + K2SO4 + 2H2O
2KI + Fe2(SO4)3 = I2 + 2FeSO4 + K2SO4
2KI + 2CuSO4 + K2SO3 + H2O = 2CuI + 2K2SO4 + H2SO4
2HIO3 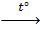 I2O5 + H2O
I2O5 + H2O
2HIO3 + 10HCl = I2 + 5Cl2 + 6H2O
2HIO3 + 5Na2SO3 = 5Na2SO4 + I2 + H2O
2HIO3 + 5H2SO4 + 10FeSO4 = Fe2(SO4)3 + I2 + 6H2O
I2O5 + 5CO 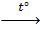 I2 + 5CO2
I2 + 5CO2
2KIO3 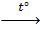 3O2 + 2KI
3O2 + 2KI
2KIO3 + 12HCl(конц.) = I2 + 5Cl2 + 2KCl + 6H2O
KIO3+ 3H2SO4 + 5KI = 3I2 + 3K2SO4 + 3H2O
KIO3 + 3H2O2 = KI + 3O2 + 3H2O
2KIO4 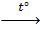 O2 + 2KIO3
O2 + 2KIO3
5KIO4+ 3H2O + 2MnSO4 = 2HMnO4 + 5KIO3 + 2H2SO4
Галогены.
1. Вещество, полученное на аноде при электролизе расплава иодида натрия с инертными электродами, выделили и ввели во взаимодействие с сероводородом. Газообразный продукт последней реакции растворили в воде и к полученному раствору добавили хлорное железо. Образовавшийся осадок отфильтровали и обработали горячим раствором гидроксида натрия. Напишите уравнения описанных реакций.
2. Вещество, полученное на аноде при электролизе раствора иодида натрия с инертными электродами, ввели в реакцию с калием. Продукт реакции нагрели с концентрированной серной кислотой и выделившийся газ пропустили через горячий раствор хромата калия. Напишите уравнения описанных реакций.
3. Хлорная вода имеет запах хлора. При подщелачивании запах исчезает, а при добавлении соляной кислоты – становится более сильным, чем был ранее. Напишите уравнения описанных реакций.
4. Бесцветные газы выделяются при выдерживании концентрированной кислоты, как с хлоридом натрия, так и с иодидом натрия. При пропускании этих газов через водный раствор аммиака образуются соли. Напишите уравнения описанных реакций.
5. При термическом разложении соли А в присутствии диоксида марганца образовались бинарная соль Б и газ, поддерживающий горение и входящий в состав воздуха, при нагревании этой соли без катализатора образуются соль Б и соль кислородсодержащей кислоты. При взаимодействии соли А с соляной кислотой выделяется жёлто-зелёный газ (простое вещество) и образуется соль Б. соль Б окрашивает пламя в фиолетовый цвет, при её взаимодействии с раствором нитрата серебра выпадает осадок белого цвета. Напишите уравнения описанных реакций.
6) При добавлении раствора кислоты А к диоксиду марганца происходит выделение ядовитого газа жёлто-зелёного газа. Пропустив выделившийся газ через горячий раствор едкого кали, получают вещество, которое используется при изготовлении спичек и некоторых других зажигательных составов. При термическом разложении последнего в присутствии диоксида марганца образуется соль, из которой при взаимодействии с концентрированной серной кислотой можно получить исходную кислоту А, и бесцветный газ, входящий в состав атмосферного воздуха. Напишите уравнения описанных реакций.
7) Йод нагрели с избытком фосфора, и продукт реакции обработали небольшим количеством воды. Газообразный продукт реакции полностью нейтрализовали раствором едкого натра и добавили в полученный раствор нитрат серебра. Напишите уравнения описанных реакций.
8) Газ, выделившийся при нагревании твердой поваренной соли с концентрированной серной кислотой, пропустили через раствор перманганата калия. Газообразный продукт реакции поглотили холодным раствором едкого натра. После добавления в полученный раствор йодоводородной кислоты появляется резкий запах и раствор приобретает тёмную окраску. Напишите уравнения описанных реакций.
9) Через раствор бромида натрия пропустили газ, выделяющийся при взаимодействии соляной кислоты с перманганатом калия. После окончания реакции раствор выпарили, остаток растворили в воде и подвергли электролизу с графитовыми электродами. Газообразные продукты реакции смешали друг с другом и осветили. В результате произошел взрыв. Напишите уравнения описанных реакций.
10) К пиролюзиту осторожно прибавили раствор соляной кислоты, и выделившийся газ пропустили в химический стакан, наполненный холодным раствором едкого кали. После окончания реакции стакан накрыли картонкой и оставили, при этом стакан освещали солнечные лучи; через некоторое время в стакан внесли тлеющую лучинку, которая ярко вспыхнула. Напишите уравнения описанных реакций.
11) Вещество, выделяющееся на катоде и аноде при электролизе раствора йодида натрия с графитовыми электродами, реагируют друг с другом. Продукт реакции взаимодействуют с концентрированной серной кислотой с выделением газа, который пропустили через раствор гидроксида калия. Напишите уравнения описанных реакций.
12) К оксиду свинца (IV) при нагревании добавили концентрированную соляную кислоту. Выделяющийся газ пропустили через нагретый раствор едкого кали. Раствор охладили, соль кислородсодержащей кислоты отфильтровали и высушили. При нагревании полученной соли с соляной кислотой выделяется ядовитый газ, а при нагревании её в присутствии диоксида марганца – газ, входящий в состав атмосферы. Напишите уравнения описанных реакций.
13) Йод обработали концентрированной азотной кислотой при нагревании. Продукт реакции осторожно нагрели. Образовавшийся при оксид вступил в реакцию с угарным газом. Выделившееся простое вещество растворили в теплом растворе гидроксида калия. Напишите уравнения описанных реакций.
14) Раствор иодида калия обработали избытком хлорной воды, при этом сначала наблюдали образование осадка, а затем – его полное растворение. Образовавшуюся при этом йодсодержащую кислоту выделили из раствора, высушили и осторожно нагрели. полученный оксид прореагировал с угарным газом. Напишите уравнения описанных реакций.
15) Йод обработали хлорноватой кислотой. Продукт реакции осторожно нагрели. Продукт реакции осторожно нагрели. Образующийся оксид реагирует с угарным газом с образованием двух веществ – простого и сложного. Простое вещество растворяется в теплом щелочном растворе сульфита натрия. Напишите уравнения описанных реакций.
16) Перманганат калия обработали избытком раствора соляной кислоты, образовался раствор и выделился газ. Раствор разделили на две части: к первой добавили гидроксид калия, а ко второй – нитрат серебра. Выделившийся газ прореагировал газ прореагировал с гидроксидом калия при охлаждении. Напишите уравнения описанных реакций.
17) Расплав хлорида натрия подвергли электролизу. Газ, выделившийся на аноде, прореагировал с водородом с образованием нового газообразного вещества с характерным запахом. Его растворили в воде и обработали расчетным количеством перманганата калия, при этом образовался газ желто-зеленого цвета. Это вещество вступает при охлаждении с гидроксидом натрия. Напишите уравнения описанных реакций.
18) Перманганат калия обработали концентрированной соляной кислотой. Выделившийся при этом газ собрали, а к реакционной массе по каплям прибавили раствор гидроксида калия до прекращения выделения осадка. Собранный газ пропустили через горячий раствор гидроксида калия, при этом образовалась смесь двух солей. Раствор выпарили, твердый остаток прокалили в присутствии катализатора, после чего в твердом остатке осталась одна соль. Напишите уравнения описанных реакций.
17) Расплав хлорида натрия подвергли электролизу. Газ, выделившийся на аноде, прореагировал с водородом с образованием нового газообразного вещества с характерным запахом. Его растворили в воде и обработали расчетным количеством перманганата калия, при этом образовался газ желто-зеленого цвета. Это вещество вступает при охлаждении с гидроксидом натрия. Напишите уравнения описанных реакций.
18) Перманганат калия обработали концентрированной соляной кислотой. Выделившийся при этом газ собрали, а к реакционной массе по каплям прибавили раствор гидроксида калия до прекращения выделения осадка. Собранный газ пропустили через горячий раствор гидроксида калия, при этом образовалась смесь двух солей. Раствор выпарили, твердый остаток прокалили в присутствии катализатора, после чего в твердом остатке осталась одна соль. Напишите уравнения описанных реакций.
Галогены.
1) 2NaI 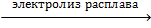 2Na + I2
2Na + I2
на катоде на аноде
I2 + H2S = 2HI↑ + S↓
2HI + 2FeCl3 = I2 + 2FeCl2+ 2HCl
I2 + 6NaOH (гор.) = NaIO3 + 5NaI + 3H2O
2) 2NaI + 2H2O 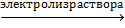 2H2 + 2NaOH + I2
2H2 + 2NaOH + I2
на катоде на аноде
I2 + 2K = 2KI
8KI + 8H2SO4(конц.) = 4I2↓ + H2S↑ + 4K2SO4 + 4H2O или
8KI + 9H2SO4(конц.) = 4I2↓ + H2S↑ + 8KHSO4 + 4H2O
3H2S + 2K2CrO4 + 2H2O = 2Cr(OH)3 + 3S + 4KOH
3) Cl2 + H2O ↔HCl + HClO
HCl + NaOH = NaCl+ H2O
HClO + NaOH = NaClO+ H2O
NaClO + 2HCl = NaCl + Cl2 + H2O
4) H2SO4(конц.) + NaCl(тверд.) = NaHSO4 + HCl↑
9H2SO4(конц.) + 8NaI(тверд.) = 8NaHSO4 + 4I2↓ + H2S + 4H2O
NH4OH + HCl = NH4Cl + H2O
NH4OH + H2S = NH4HS + H2O
5) 2KClO3 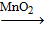 2KCl + 3O2↑
2KCl + 3O2↑
4KClO3 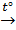 KCl + 3KClO4
KCl + 3KClO4
KClO3 + 6HCl = KCl + 3Cl2↑+ 3H2O
KCl + AgNO3 = AgCl↓ + KNO3
6) 4HCl + MnO2 = MnCl2 + Cl2↑ + 2H2O
3Cl2 + 6KOH(гор.) = 5KCl + KClO3 + 3H2O
2KClO3 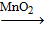 2KCl + 3O2↑
2KCl + 3O2↑
H2SO4(конц.) + NaCl(тверд.) = NaHSO4 + HCl↑
7) 3I2 + 2P = 2PI3
PI3 + 3H2O = H3PO3 + 3HI
HI + NaOH = NaI + H2O
NaI + AgNO3 = AgI↓ + NaNO3
8) H2SO4(конц.) + NaCl(тверд.) = NaHSO4 + HCl↑
16HCl + 2KMnO4 = 5Cl2 + 2KCl + 2MnCl2 + 8H2O
Cl2 + 2NaOH(хол.) = NaCl + NaClO + H2O
NaClO + 2HI = NaCl + I2 + H2O
9) 16HCl + 2KMnO4 = 5Cl2 + 2KCl + 2MnCl2 + 8H2O
2NaBr + Cl2 = 2NaCl + Br2
2NaCl + 2H2O 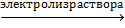 2H2 + 2NaOH + Cl2
2H2 + 2NaOH + Cl2
на катоде на аноде
H2 + Cl2 = 2HCl
10) 4HCl+ MnO2 = MnCl2 + Cl2↑ + 2H2O
Cl2 + 2KOH(хол.) = KCl + KClO + H2O
2KClO3 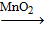 2KCl + 3O2↑
2KCl + 3O2↑
C + O2 = CO2
11) 2NaI + 2H2O 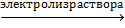 2H2 + 2NaOH + I2
2H2 + 2NaOH + I2
на катоде на аноде
I2 + H2 = 2HI
8HI + H2SO4(конц.) = 4I2↓ + H2S↑ + 4H2Oили
2HI + H2SO4(конц.) = I2↓ + SO2↑ + 2H2O
а) H2S + 2KOH = K2S + 2H2O
H2S + K2S = 2KHSили
б) SO2 + 2KOH = K2SO3 + 2H2O
K2SO3 + SO2 + H2O = 2KHSO3
12) 4HCl+ PbO2 = PbCl2 + Cl2↑ + 2H2O
3Cl2 + 6KOH(гор.) = 5KCl + KClO3 + 3H2O
KClO3 + 6HCl = KCl + 3Cl2 + 3H2O
2KClO3 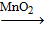 2KCl + 3O2↑
2KCl + 3O2↑
13) I2 + 10HNO3 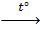 2HIO3 + 10NO2 + 4H2O
2HIO3 + 10NO2 + 4H2O
2HIO3 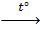 I2O5 + H2O
I2O5 + H2O
I2O5 + 5CO 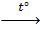 I2 + 5CO2
I2 + 5CO2
3I2 + 6KOH(гор.) = 5KI + KIO3 + 3H2O
14) 2KI + Cl2 = 2KCl + I2
I2 + 5Cl2 + 6H2O = 10HCl + 2HIO3
2HIO3 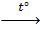 I2O5 + H2O
I2O5 + H2O
I2O5 + 5CO = I2 + 5CO2
15) I2+ 2HClO3 = 2HIO3 + Cl2
2HIO3 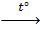 I2O5 + H2O
I2O5 + H2O
I2O5 + 5CO 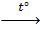 I2 + 5CO2
I2 + 5CO2
I2 + Na2SO3 + 2NaOH = 2NaI + Na2SO4 + H2O
16) 16HCl + 2KMnO4 = 5Cl2 + 2KCl + 2MnCl2 + 8H2O
MnCl2 + 2KOH = Mn(OH)2↓ + 2KCl
KCl + AgNO3 = AgCl↓ + KNO3
Cl2 + 2KOH(хол.) = KCl + KClO + H2O
17) 2NaCl 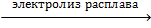 2Na + CL2
2Na + CL2
на катоде на аноде
Cl2 + H2 = 2HCl
16HCl + 2KMnO4 = 5Cl2 + 2KCl + 2MnCl2 + 8H2O
Cl2 + 2NaOH(хол.) = NaCl + NaClO + H2O
18) 16HCl + 2KMnO4 = 5Cl2 + 2KCl + 2MnCl2 + 8H2O
MnCl2 + 2KOH = Mn(OH)2↓ + 2KCl
3Cl2 + 6KOH(гор.) = 5KCl + KClO3 + 3H2O
2KClO3 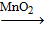 2KCl + 3O2↑
2KCl + 3O2↑