Сущность метода прямой кондуктометрии заключается в том, что концентрацию вещества определяют по результатам измерения электрической проводимости (или сопротивления). При этом используют два приёма нахождения неизвестной концентрации:
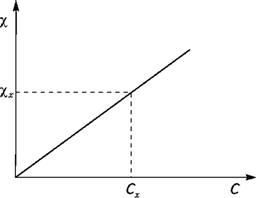
- Метод градуировочного графика.
График строят в координатах ϰ - С.
Он линеен в небольшом диапазоне концентраций.
Расчётный метод. Метод используют для очень разбавленных растворов. В этом случае при С 0:
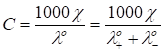
Таким образом, неизвестную концентрацию можно рассчитать по измеренной величине электропроводности и табличным значениям предельных подвижностей ионов.
Прямая кондуктометрия используется в качестве метода аналитического контроля растворов электролитов. Поскольку в величину аналитического сигнала вносят вклад все ионы, присутствующие в растворе, то применение метода ограничено из-за малой селективности.
· Кондуктометрическое титрование.
При кондуктометрическом титровании в ячейку с электродами помещают анализируемый раствор, ячейку помещают на магнитную мешалку и титруют соответствующим титрантом. Титрант добавляют равными порциями. После добавления каждой порции титранта замеряют электрическую проводимость раствора и строят график зависимости между электрической проводимостью и объемом титранта. Различные ионы в растворах имеют отличающиеся друг от друга подвижности. Наиболее высокой подвижностью обладают Н+ (319,8) и ОН- (198,3) От подвижности ионов зависит электрическая проводимость раствора: чем выше подвижность ионов, тем больше электрическая проводимость раствора.
Графическая зависимость электропроводности от объема титранта
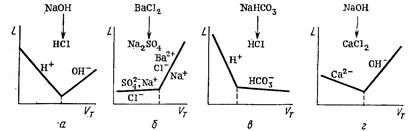
Характер кривых кондуктометрического титрования различеные зависимости от величины подвижности ионов определяемого вещества и титранта.
Рассмотрим основные типы кривых кондуктометрического титрования:
-титруемое вещество и титрант имеют ионы с высокой подвижностью.
При титровании, например, НСl раствором NaOH (рисунок, а) в растворе сначала присутствуют Н+ – ионы, имеющие высокую подвижность, по мере титрования их концентрация уменьшается и электрическая проводимость раствора падает.
В точке эквивалентности электрическая проводимость раствора минимальна. При добавлении избытка NaOH в растворе появляются свободные ОН- – ионы, имеющие высокую подвижность, и электрическая проводимость раствора снова возрастает. Восходящий участок кривой титрования имеет меньший угол наклона вследствие более низкой подвижности ионов ОН-.
-титруемое вещество и титрант имеют ионы с низкой подвижностью.
Например, при титровании Na2SO4 раствором ВаСl2 электрическая проводимость раствора до точки эквивалентности практически неизменна (рисунок, б), так как малоподвижные SO42- -ионы связываются в сульфат бария и заменяются Сl- – ионами с близкой подвижностью, количество Na+ остается неизменным. После точки эквивалентности вследствие появления избытка Ba2+– и Сl- – ионов электрическая проводимость раствора возрастает.
-титруемое вещество имеет ионы с высокой подвижностью, титрант – с низкой.
В этом случае до точки эквивалентности электрическая проводимость раствора снижается, после точки эквивалентности – изменяется незначительно (рисунок, в). Примером здесь может служить титрование НСl раствором NaHCO3.
-титруемое вещество имеет ионы с низкой подвижностью, титрант –высокой.
Например, при титровании СаСl2 раствором NaOH электрическая проводимость раствора сначала несколько уменьшается вследствие замены ионов Са2+, связываемых в осадок Са(ОН)2 на Na+, затем возрастает при появлении избытка ОН –ионов (рисунок, г).
Кривые кондуктометрического титрования могут искажаться вследствие гидролиза и других причин.
Кондуктометрическое титрование обладает рядом преимуществ:
-его можно проводить в мутных и окрашенных средах, в отсутствие химических индикаторов.
-метод обладает повышенной чувствительностью и позволяет анализировать разбавленные растворы веществ (до 10-4 моль/дм3).
-кондуктометрическим титрованием анализируют смеси веществ, так как различия в подвижности различных ионов существенны и их можно дифференцирование оттитровывать в присутствии друг друга.
-точность кондуктометрического титрования находится в пределах точности титриметрического анализа.
-кондуктометрический анализ легко автоматизировать, если раствор титранта подавать из бюретки с постоянной скоростью, а изменения электрической проводимости раствора регистрировать на самописце. Эта разновидность кондуктометрии получила название хронокондуктометрического анализа, так как по времени титрования до точек перегиба кривой титрования можно рассчитать результат.
В кондуктометрии используют практически все аналитические реакции, и диапазон определяемых веществ здесь необычайно широк.
В кислотно-основном титровании кондуктометрическим путем можно определять сильные кислоты, слабые кислоты (имеющие значения рН до 8…10), смеси сильных и слабых кислот (с 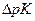 > 4), соли слабых оснований и сильных кислот. В осадительном кондуктометрическом титровании электрическая проводимость титруемых растворов сначала уменьшается или остается на некотором постоянном уровне вследствие связывания титруемого электролита в осадок, после точки эквивалентности при появлении избытка титранта – снова возрастает.
> 4), соли слабых оснований и сильных кислот. В осадительном кондуктометрическом титровании электрическая проводимость титруемых растворов сначала уменьшается или остается на некотором постоянном уровне вследствие связывания титруемого электролита в осадок, после точки эквивалентности при появлении избытка титранта – снова возрастает.
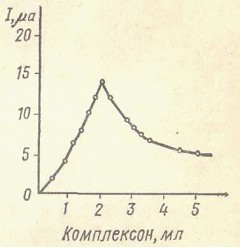
В комплексонометрическом кондуктометрическом титровании изменения электрической проводимости раствора наступают вследствие связывания катионов металла в комплекс с ЭДТА (или другими лигандами). При этом для каждого катиона с помощью буферных растворов регулируют рН среды, влияющий на характер кривых титрования. Титрованию подвергают 0,01  0,005 М растворы солей металлов. Комплексонометрическим путем можно определять Cu2+, Ni2+, Zn2+, Co2+, Cd2+, А13+, Са2+ и др.
0,005 М растворы солей металлов. Комплексонометрическим путем можно определять Cu2+, Ni2+, Zn2+, Co2+, Cd2+, А13+, Са2+ и др.
Окислительно-восстановительное кондуктометрическое титрование основано на изменении концентрации реагирующих ионов и появлении в растворе новых ионов, что изменяет электрическую проводимость раствора. Например, при титровании арсенитов раствором иода в присутствии гидрокарбоната натрия из раствора исчезает АsО33- и появляются АsО43- и I-. До точки эквивалентности электрическая проводимость раствора возрастает, после точки эквивалентности изменяется мало.
К недостаткам метода следует отнести малую селективность.
· Высокочастотное кондуктометрическое титрование
Высокочастотное кондуктометрическое титрование отличается от обычного кондуктометрического титрования отсутствием непосредственного контакта исследуемого раствора с электродами и использованием тока очень высокой частоты (1–100 МГц).
Данный метод основан на регистрации изменений слагаемого высокочастотной электропроводности (G) в зависимости от концентрации определяемого электролита в процессе титрования. В свою очередь G есть сложная функция от электропроводности раствора и частоты тока.
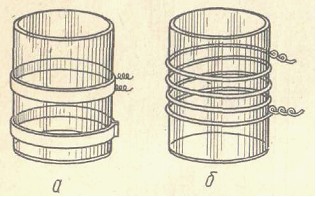
Наибольшее распространение в высокочастотном титровании нашли два вида ячеек:
-емкостные
- индуктивные.
В емкостных ячейках в процессе титрования изменяется электрическое поле, в индуктивных – магнитное.
Емкостные ячейки целесообразно использовать при титровании в растворах с низкими величинами электропроводности, индуктивные – с относительно высокой электропроводностью.
В процессе титрования происходит изменение состава раствора, который влияет на диэлектрическую проницаемость и определяет проводимость ячейки. При применении токов высокой частоты проводимость будет обуславливаться не только реальным перемещением заряда, но и потерями электрической энергии на индуктивность и емкость цепи.
Форма кривой высокочастотного титрования зависит от частоты тока, диэлектрической проницаемости растворителя, концентрации электролита, подвижности ионов и др. Успешное проведение высокочастотного титрования возможно лишь при точном знании характеристических кривых соответствующих ячеек, зависящих от измеряемого параметра, типа ячейки и измерительного прибора.
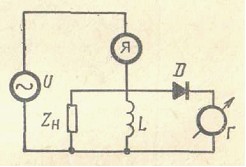
Для измерения электропроводности электроды погружают в исследуемый раствор. В случае высокочастотных методов (Рис.) ячейку с анализируемым раствором помещают между металлическими пластинками (ячейки конденсаторного типа) или внутрь индукционной катушки (индуктивные ячейки). Электроды подключаются к сетчатому или анодному контуру высокочастотного генератора. Ячейка в цепи переменного тока является емкостью и не препятствует прохождению электрического тока.
В случае применения высокочастотных токов электрохимические процессы на электродах не протекают и зависимость между силой тока и напряжением определяется электрохимическими свойствами всей химической системы, заключенной между электродами. Возникающие в ходе титрования химические изменения влияют на диэлектрическую проницаемость и удельную электропроводность раствора, определяя величину полной проводимости ячейки.
Кривая титрования по данному методу представлена на рисунке. Основные преимущества применения высокочастотного титрования следующее:
а) отсутствует контакт металлических электродов с исследуемым раствором. Это исключает поляризационное и каталитическое влияние материалов электродов на химические реакции, что дает возможность работать в агрессивных средах, избавляет от необходимости применять платину;
б) выделяющиеся в ходе реакции на внутренней стенке ячейки осадки, не препятствует прохождению через раствор высокочастотного тока, что делает возможным точное установления конечной точки титрования;
в) титрование можно проводить не только в водных, но и в неводных средах, что используется при контроле синтеза органических веществ
· Примеры решения задач
Пример 1. Определить молярную и массовую концентрацию NaCl в растворе, если сопротивление электрохимической ячейки R, заполненной этим раствором, составляет 34,7Ом. Постоянная ячейки k равна 1,46м–1, молярная электрическая проводимость 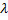 – 0,0085 См*м2 · моль–1.
– 0,0085 См*м2 · моль–1.
Решение.
Зная сопротивление и постоянную ячейки, находим удельную электрическую проводимость раствора электролита:
ϰ=  =
= 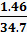 =0.042 См*м-1
=0.042 См*м-1
Находим молярную концентрацию
СNaCl = 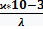 =
= 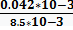 =0.005моль/л
=0.005моль/л
Находим массовую концентрацию хлорида натрия
MNaCl = 36.5г/моль
m(NaCl) = СNaCl*MNaCl=0.005*36.5=0.18г/л
Ответ: m(NaCl) = 0.18г/л
Пример 2
. При кондуктометрическом титровании 50 мл раствора HCl 0,01 моль-экв/л NaOH были получены следующие данные
VNaOH,мл 0 2,0 4,0 6,0 8,0 10,0
ϰ См. м-1 1,50 1,09 0,67 0,63 0,99 1,35
Рассчитать концентрацию HCl по данным кондуктометрического титрования.
Решение: Постройте график кондуктометрического титрования в координатах:
ϰ V - (удельная электрическая проводимость – объем раствора титранта) и определяем по графику точку эквивалентности, 5,0 мл раствора NaOH. Рассчитываем молярную концентрацию эквивалента раствора HCl из соотношения:
С HCl. V HCl = СNaOH. VNaOH
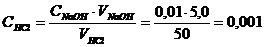 моль /л
моль /л
Ответ: 0,001 моль /л.
Пример 3
Какой объем раствора хлорида бария с удельным сопротивлением 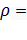 14 Ом и молярной электрической проводимостью
14 Ом и молярной электрической проводимостью  =0.045 См*м2*моль-1 нужно взять для осаждения ионов SO42- содержащихся в 50 мл 0.001н сульфата калия K2SO4
=0.045 См*м2*моль-1 нужно взять для осаждения ионов SO42- содержащихся в 50 мл 0.001н сульфата калия K2SO4
Решение.
K2SO4 +BaCl2 = BaSO4 +2KCl
Находим удельную электропроводность раствора BaCl2
ϰ =  =
= 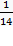 =7.1*10-2 См*м-1
=7.1*10-2 См*м-1
рассчитываем молярную концентрацию эквивалента раствора BaCl2
С(1/2 BaCl2)= 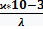 =
= 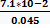 =0.16*10-2моль/л
=0.16*10-2моль/л
VBaCl2= 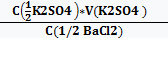 =
= 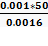 =31.25 мл
=31.25 мл
Ответ: VBaCl2=31.25 мл
Пример 4
Предельная электрическая проводимость водного раствора хлорида аммония
λ∞(NH4Cl)=130*10-4 См*м2*моль-1
Подвижности ионов
λа (OH-) = 174*10-4 См*м2*моль-1
λа (Cl-)=65.4*10-4 См*м2*моль-1
Рассчитать предельную электрическуюя проводимость водного раствора гидроксида аммония
Решение.
По закону Кольрауша
λ∞ = λк + λа
λ∞(NH4Cl) =λ∞(NH4+) +λ∞(Cl-)
λ∞(NH4+)= λ∞(NH4Cl)- λ∞(Cl-)= 130*10-4 - 65.4*10-4 =65.4*10-4 См*м2*моль-1
λ∞(NH4OH) =λ∞(NH4+) +λ∞(OH-) = 65.4*10-4 +174*10-4 =239*10-4 См*м2*моль-1
Ответ: λ∞(NH4OH) =239*10-4 См*м2*моль-1