Химические знаки позволяют изобразить состав сложного вещества в виде формул.
Химическая формула — это условная запись состава вещества посредством химических знаков и индексов.
Химические формулы составляют на основании валентности атомов.
Формулы различают молекулярные, структурные, электронные и другие.
Молекулярные формулы (H3PO4, Fe2O3, Al(OH)3, Na2SO4, O2 и т.д.) показывают качественный (т.е. из каких элементов состоит вещество) и количественный (т.е. сколько атомов каждого элемента имеются в веществе) состав.
Структурные формулы показывают порядок соединения атомов в молекуле, соединяя атомы черточками (одна черточка — одна химическая связь между двумя атомами в молекуле).

Рассмотрим составление структурных формул кислот.
1)Составление структурных формул бескислородных кислот.
При составлении структурных формул бескислородных кислот следует учитывать, что в молекулах этих кислот атомы водорода связаны с атомами неметалла:

2)Составление структурных формул кислородсодержащих кислот.
При составлении структурных формул кислородсодержащих кислот нужно помнить, что водород связан с центральным атомом посредством атомов кислорода:
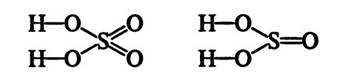
Следует помнить, что в кислородсодержащих кислотах центральным атомом всегда будет неметалл (S, P, N и т.д.).
Если, например, требуется составить структурные формулы серной и ортофосфорной кислот, то поступают так:
а) пишут один под другим атомы водорода данной кислоты:

б) затем через атомы кислорода черточками связывают их с центральным атомом:

в) к центральному атому (с учетом валентности) присоединяют остальные атомы кислорода:

Электронные формулы так же, как и структурные, показывают порядок соединения атомов в молекуле (связь показана посредством электронной пары, в которой один электрон принадлежит одному атому, а другой электрон — другому атому):

Итак:

По химической формуле можно:
1) определить, к какому классу соединений относится данное вещество;
2) прогнозировать строение и свойства вещества;
3) вычислять молекулярную массу вещества и молярную массу его; массу его молекулы в а.е.м.; массовые доли (%) элементов вещества.
Химические формулы веществ дают возможность записать результат любой химической реакции в виде уравнения:

Представим, что встретились два атома: атом щелочного металла и атом галогена. У атома металла на внешнем энергетическом уровне — единственный электрон, а атому неметалла как раз не хватает одного электрона, чтобы завершить свой внешний уровень.
Атом металла легко отдаст свой слабо связанный с ядром валентный электрон атому неметалла, который предоставит ему свободное место на внешнем энергетическом уровне. Оба в результате получат заполненные внешние уровни.
Атом металла при этом приобретёт положительный заряд, а атом галогена превратится в отрицательно заряженнуючастицу. Такие частицы называются ионами.
Ионы— заряженные частицы, в которые превращаются атомы в результате отдачи или принятия электронов.
Образовавшиеся разноимённо заряженные ионы притягиваются друг к другу, и возникает химическая связь, которая называется ионной.