Лекция №8
Кислотность почв, ее виды. Кислотность почв обусловлена наличием в ней минеральных и органических кислот и гидролитически кислых соединений. Различают актуальную и потенциальную кислотность.
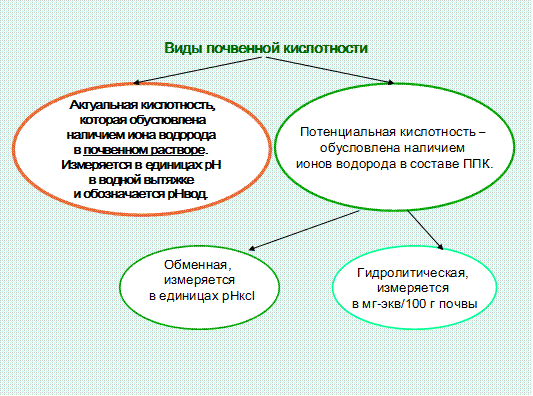
Актуальная (активная ) кислотность обусловлена наличием ионов водорода в почвенном растворе, определяется в водной вытяжке, выражается в единицах рН. От величины актуальной кислотности непосредственно зависят условия произрастания растений, оптимальными для большинства культур являются значения рН, близкие к нейтральным.
Потенциальная кислотность обусловлена наличием ионов водорода и алюминия в почвенном поглощающем комплексе, она подразделяется на обменную и гидролитическую. Обменная кислотность характеризуется количеством ионов водорода и алюминия, находящихся в обменном состоянии ППК, т.е. в диффузном слое коллоидных мицелл. Обнаруживается при воздействии на почву 1н. раствором КСl, измеряется величиной рН солевой вытяжки (рНКСl).
Гидролитическая кислотность (Нг) – это общее количество ионов водорода и алюминия в ППК, находящихся как в обменном, так и необменном состоянии. Определяется при воздействии на почву гидролитически основной соли (уксуснокислого натрия), при этом происходит полное вытеснение ионов водорода и алюминия из ППК. Измеряется в мг-экв. на 100г почвы. Гидролитическая кислотность является наиболее полной, поэтому ее показатели используют в расчетах доз извести для нейтрализации кислых почв.
Для большинства сельскохозяйственных культур оптимальные значения величины рН составляют: для пшеницы и ячменя рН=6-7; кукурузы рН=6-7, овса 5-6, картофеля– 5, люпина – 4-5; клевер, люцерна предпочитают слабощелочные почвы – 7-8 единиц рН.
Негативное влияние повышенной кислотности на растения проявляется через недостаток кальция, повышенную концентрацию токсичных для растений ионов Al3+, Mn2+, Н+, изменение доступности для растений элементов питания, ухудшение физических свойств почвы, снижение ее биологической активности. В кислых почвах увеличивается растворимость соединений Fe, Mn, Al, B, Cu, Zn, избыток которых отрицательно влияет на растения. Высокая кислотность снижает доступность молибдена. Усвояемость фосфора максимальна при рН 6,5, в более кислой и более щелочной среде она снижается.
Кислая среда ухудшает азотный режим почвы, угнетая процессы аммонификации, нитрификации, азотфиксации. Для этих процессов оптимум рН лежит в интервале 6,5…8,0. Особо негативную роль в кислых почвах играет алюминий. При рН 4 содержание алюминия в почвенных растворах достигает токсичных концентраций для большинства растений. Аналогичное действие при низких рН оказывает марганец.
К кислым почвам относятся подзолистые, болотно-подзолистые, серые лесные, буроземы и другие.
Кислую реакцию среды обуславливают:
- хвойная растительность;
- мхи и лишайники (до рН менее 4,0);
- микроорганизмы (например, грибная микрофлора, нитрификаторы);
- внесение гидролитически кислых минеральных удобрений;
- фульвокислоты и органические (яблочная, щавелевая и др.) и минеральные кислоты (например, HNO3, которая появляется в почвенном растворе вследствие нитрификации).
Для нейтрализации кислых почв вносят известковые материалы, такие как известь и доломит.
Щелочность почв обусловлена наличием в почвенном растворе соды, а в составе ППК обменного натрия. Щелочность почв определяют по значения рН водной вытяжки. Различают слабощелочные почвы (рН 7,0-7,5), щелочные (рН 7,5-8,5) и сильнощелочные (рН >8,5).
Щелочные почвы характеризуются низким плодородием из-за неудовлетворительных физических свойств, так как наличие иона натрия в ППК способствует пептизации коллоидов, это приводит к разрушению почвенной структуры и выносу илистых и коллоидных частиц из верхнего горизонта в нижние, которые за счет этого сильно уплотняются.
На щелочных почвах ухудшается фосфатный режим, возникает дефицит некоторых микроэлементов (Zn, Fe, Mn, Cu). При высокой щелочности возрастает растворимость гумусовых веществ. Сильнощелочная реакция неблагоприятна для большинства растений.
Для нейтрализации щелочных почв вносят гипс, применяют гидролитически кислые минеральные удобрения и отходы промышленного производства (пиритные огарки, сульфат железа и другие).
Условия, определяющие реакцию почвы.
ÚНейтральную реакцию почвенного раствора создают соли сильных кислот и сильных оснований: сульфат кальция, нитрат натрия, хлористый кальций и т.д. Нейтральную реакцию создает также растительность луговых степей, богатая основаниями.
Ú Кислую реакцию обеспечивают соли сильных кислот и слабых оснований: сульфат железа и алюминия, хлористый аммоний, а также угольная кислота, фульвокислоты, другие кислоты, появляющиеся в почвенном растворе вследствие почвообразования.
Ú Щелочную реакцию создают соли сильных оснований и слабых кислот: карбонаты кальция, натрия, бикарбонат кальция (сода), а также растительность аридной зоны, содержащая в своем составе натрий.
Буферностью почв называется способность почв противостоять изменению реакции почвенного раствора. Различают два вида буферности: против подщелачивания и против подкисления. Она определяется составом почвенного раствора и ППК. Почвы, содержащие в почвенном растворе гидролитически кислые соли, а в ППК водород и алюминий, обладают повышенной буферностью к подщелачиванию и пониженной к подкислению (например, подзолистые почвы).
И наоборот почвы, насыщенные основаниями, обладают буферностью против подкисления (черноземы, солонцы, каштановые почвы):
Ca(HCO3)2 +HNO3 → Ca(NO3)2 +H2CO3
ППК)Са2+ +H2SO4 → ППК)Н+Н+ +CaSO4
Буфернось почв зависит от гранулометрического состава (она выше в тяжелых почвах), емкости поглощения и состава ППК, содержания гумуса.
Буферность почв определяется кривыми титрования и площадью титрования путем сравнения результатов титрования почвы с кварцевым песком (буферность которого равна = 0).