Самостоятельная работа №5
В самостоятельной работе даны задания для проверки знаний, умений и навыков студентов по теме: «Электрохимические процессы».
Для выполнения самостоятельной работы по этой теме необходимо предварительно изучить соответствующие главы учебника (главы 9, 10), теоретический лекционный материал и примеры решения задач в «Рабочей тетради». Самостоятельная работа №5 содержит три задачи по трем темам электрохимических процессов: задача 1 по темегальванический элемент содержит два задания, задача 2 - электролиз, содержит два задания,задача 3 - коррозия и защита металлов от коррозии.
Самостоятельная работа выполняется письменно на отдельных листах формата А-4 с титульным листом, на котором указываются номер и тема самостоятельной работы, номер варианта, фамилия и группа студента, фамилия, имя и отчество преподавателя, ведущего лабораторные занятия в подгруппе. Работу следует оформлять аккуратно, разборчиво, необходимо предварительно переписать общее задание и задание собственного варианта, приведенное в соответствующей таблице, и только потом отвечать на поставленный вопрос. Номер нужного Вам варианта соответствует Вашему номеру в списке группы (уточните у старосты). Следует помнить, что от правильного решения одного из пунктов в задании могут зависить результаты следующих пунктов.
Необходимые знания: законы Фарадея, электродные потенциалы, гальванический элемент, электролиз растворов и расплавов, понятие о коррозии, виды, коррозии, защита металлов от коррозии.
Необходимые умения: составлять уравнения электродных процессов, пользоваться уравнением Нернста для газовых и металлических электродов, уравнением, выражающим законы Фарадея для расчета, времени, силы тока и количества вещества в электрохимических процессах.
Задача 1.
Электродный потенциал и гальванический элемент.
Задание 1. Вычислите потенциал водородного электрода в растворе электролита CH3COOH с концентрацией 1%.
Решение:
Для выполнения данного задания необходимо повторить тему «Растворы» (см. самостоятельную работу №4): расчет концентраций растворов, определение водородного показателя слабых кислот.
Рассчитаем молярную концентрацию электролита, зная его массовую долю ω= 1%
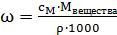 =>сМ=с0= 0,01 моль/л. (ρ=1)
=>сМ=с0= 0,01 моль/л. (ρ=1)
Равновесный водородный потенциал рассчитаем по уравнению Нернста для водородного электрода:
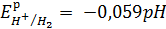
Уравнение диссоциации уксусной кислоты:
CH3COOH↔ CH3COO-+ H+
Водородный показатель раствора слабого электролита уксусной кислоты pH = –lg 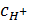
Равновесная концентрация ионов водорода: 
Степень диссоциации CH3COOH по приближенному уравнению закона разведения Оствальда: 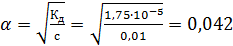 ;
;
Следовательно,
 моль/л
моль/л
pH = –lg0,0042 = 2,37
Потенциал водородного электрода:
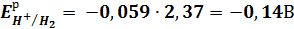
Задание 2.
2.1. Составьте схему концентрационного ГЭ, одним из электродов которого будет электрод задания 1, а второй подберите сами. Рассчитайте ЭДС и Аmax этого гальванического элемента.
Решение:
Концентрационным называется гальванический элемент, состоящий из электродов одинаковой природы, опущенных в растворы разной концентрации, в данном случае водородные электроды, опущены в растворы с разной активностью ионов водорода:
0,01 0,01
H2, Pt|CH3COOH||HCl|H2, Pt
Электродные процессы:
K: 2H+ + 2e→H2 – восстановление на катоде;
A: H2→ 2H+ + 2e – окисление на аноде.
в растворе 0,01М CH3COOH равновесный потенциал водородного электрода задания 1:
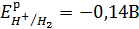 (см.задание 1)
(см.задание 1)
Рассчитаем равновесный потенциал водородного электрода в растворе 0,01М HCl
(НCl→ Н+ + Cl-):
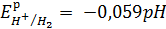
Водородный показатель рН сильных кислот (см. самостоятельную работу №4):
pH = –lg 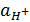
активность иона водорода
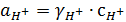 , где γ – коэффициент активности, зависящий от ионной силы раствора I:
, где γ – коэффициент активности, зависящий от ионной силы раствора I:
I= 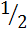 ∑cizi2 = ½ (0,01+0,01) = 0,01
∑cizi2 = ½ (0,01+0,01) = 0,01
По таблице
| Ионы | Коэффициент активности  для ионной силы для ионной силы
| |||||
| 0,001 | 0,01 | 0,02 | 0,05 | 0,07 | 0,1 | |
| водорода Однозарядные Двухзарядные Трёхзарядные | 0,98 0,98 0,77 0,73 | 0,92 0,92 0,58 0,47 | 0.90 0,89 0,50 0,37 | 0,88 0,85 0,50 0,37 | 0,86 0,83 0,36 0,25 | 0,84 0,80 0,30 0,21 |
Находим коэффициент активности => 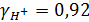
Подставляем в выражение для водородного показателя
pH = –lg 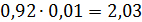
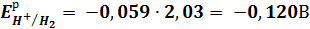
Сравнивая величины равновесных потенциалов водородных электродов в уксусной и соляной кислотах, определяем на каком из них идет процесс восстановления ионов водорода, он будет катодом, а на каком – процесс окисления молекул водорода, он будет анодом.Так как -0,14B< -0,12B =>электрод в раствореHCl – анод, в раствореCH3COOH - катод
(К) H2, Pt|CH3COOH||HCl|H2, Pt (А)
Электродвижущая сила ГЭ равна разности между потенциалами катода и анода:
EЭ = EК – EА = 
Максимальная работа данного гальванического элемента:
Аmax = n∙F∙ EЭ = 2∙96500∙0,02 = 3860Дж (здесь n – число электронов, участвующих в окислительно-восстановительном процессе, F – число Фарадея).
2.2. Составьте схему гальванического элемента, катодом в котором будет электрод задания 1, а анод подберите сами.
Решение:
Потенциал анода должен быть меньше потенциала катода. По таблице стандартных электродных потенциалов подбираем соответствующий электрод. Пусть этим электродом будет барий.
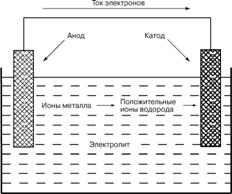
ГЭK: H2 
A: Вa
2.2.1. Напишите электродные процессы и токообразующую реакцию.
Решение:
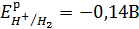
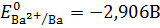
K: 2H+ + 2e→H2 – восстановление ионов водорода
A: Вa→ Вa 2++2e – окисление атомов бария
ТОР: 2H+ + 2e+ Вa→ Вa 2++2e + H2
2H+ + Вa→ Вa 2++ H2
2.2.2. Вычислите ЭДС гальванического элемента, исходя из: а) термодинамических; б) электрохимических данных. Объясните небольшое различие в величинах ЭДС.
Решение:
а) по термодинамическим данным:
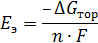
Энергия Гиббса токообразующей реакции рассчитывается по уравнению как следствие из закона Гесса
Δ rGT = ∑ν i Δ fGT,i продуктов - ∑ν j Δ fGT,j исх веществ
Используя справочные данные
∆rGТОР.= –560,8-0= –560,8 кДж = –560800 Дж
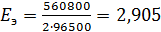 В
В
б) электрохимический метод расчета эдс ГЭ основан на разности между потенциалами катода и анода:
EЭ= EК – EА = 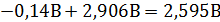
Различие между значениями ЕЭ рассчитанными разными методами объясняется тем, что энергия Гиббса рассчитывалась по табличным данным для стандартного состояния компонентов, но концентрация раствора уксусной кислоты не равна 1.
2.2.3. Определите температурную зависимость ЭДС Вашего гальванического элемента.
Решение:
Изменение энтропии токообразующей реакции описывается выражением:
 =>
=>
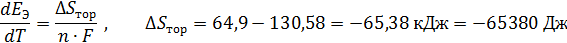


 E
E
∆S< 0
 T
T
2.2.4. Покажите графически ход поляризационных кривых.
Поляризационные кривые – это зависимость потенциала от плотности тока.
 Е,В
Е,В


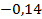 - i,мА/см2
- i,мА/см2
Катодная кривая
EЭ
 Анодная кривая
Анодная кривая
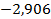 -
-
2.2.5. Как можно увеличить напряжение Вашего ГЭ?
Увеличить напряжение можно, увеличив ЭДС.
Для этого
- увеличить температуру,
- уменьшить активности ионов обоих электродов.
Уменьшить омические потери, уменьшив сопротивление и поляризацию электродов.
Задача 2. Электролиз водных растворов
Таблица 4.1
| Ме | I, A | Bj, % | ρ, г/см3 | Раствор | d, см | h, см | V, мл |
| Sn | 7,3 | NaNO3 | 22,4 |
Таблица 4.2
| Задание 2 | Задание 3 | |||||
| 2.1 | 2.2 | 2.3 | 3.1 | 3.2 | 3.3 моль/л | 3.4 |
| ZnSO4 | Zn | C | Cd-Cu | CuCl2 | 0,03 | 0,19 |
Задание 1.
Для электролиза раствора ZnSO4 на Zn электродах:
1.1. Напишите уравнения возможных электродных процессов при электролизе.
Решение:
1) Определим ионный состав раствора сульфата цинка: это соль, все соли сильные электролиты, в растворе диссоциирует необратимо на ионы цинка и сульфат ионы:
ZnSO4 → Zn2++ SO42-
Вода – слабый электролит, диссоциирует обратимо на ионы водорода и гидроксид-ионы:
H2O ↔ H+ + OH-
2)Распределение ионов по электродам: катод – отрицательно заряженный электрод, к нему стремятся катионы – положительно заряженные ионы:
– К: Zn2+, H+
Анод – положительно заряженный электрод, к нему стремятся анионы, отрицательно заряженные ионы:
+ А: OH-, (SO42- не окисляется на аноде, как и все кислородсодержащие кислотные остатки)
3) Возможность восстановления катионов в условиях конкуренции: возможны оба процесса восстановления ионов (Zn2+ и H+), если их потенциалы различаются на величину, меньшую единицы.
Стандартный электродный потенциал цинка определяем по таблице «Стандартные электродные потенциалы металлических и газовых электродов»:
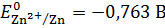
Потенциал водородного электрода в растворе рассчитаем по уравнению Нернста:
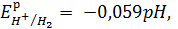
В данном случае в растворе соли ZnSO4, образованной слабым основанием Zn(ОН)2 и сильной кислотой Н2SO4, происходит процесс гидролиза (реакция обмена с водой слабой части соли), при этом водородный показатель раствора рН становится меньше 7, кислая среда (см. самостоятельную работу №4). В этом случая для расчета примем рН=5:

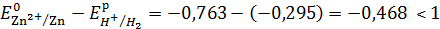
Разница потенциалов частиц меньше единицы, на катоде возможно одновременное протекание обеих реакций: восстановление ионов Zn2+ и H+:
К: 2H+ +2е → H2
Zn2++2е → Zn
В условиях конкурентного восстановления на катоде в первую очередь восстанавливается ион, потенциал которого больше, то есть сначала водород, а потом цинк.
4) На аноде протекает процессы окисления ионов ОН-, а также материала электрода-анода, так как в данном случае цинковый анод является активным электродом, который окисляется при электролизе раствора.
Стандартный электродный потенциал цинка по табличным данным:
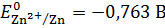
Равновесный кислородный потенциал рассчитываем по уравнению Нернста для кислородного электрода:
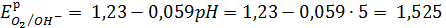
А: 4ОН-→О2↑+2 H2O+ 4е
Zn→ Zn2++2е
1.2. Рассчитайте теоретическое значение Umin разложения и покажите графически ход поляризационных кривых.
Umin= EА – EК =1,525  В
В
Е,В
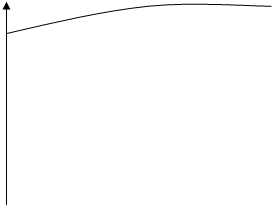
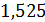
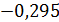

 i,мА/см2
i,мА/см2


1.3. Изменятся ли электродные процессы, если заменить электроды на C электроды? Ответ обоснуйте.
Если мы заменим активные цинковые ионы на инертные графитные, то в данном случае не будет происходить окисления самих электродов, и тогда на аноде будет протекать только один процесс – окисление гидроксид ионов. На катоде процессы не изменятся.
Задание 2.
Решите задачу (см. табл.4.1).
Определите время (t), необходимое для электрохимической прошивки в заготовке из Sn отверстия диаметром (d) 1 см и глубиной (h) 3 см. Процесс проводят в растворе NaNO3 при силе тока (I) 10 А и анодном выходе металла по току равном Bi = 60%.
Решение:
Начальный ионный состав электролита: Na+, NO3-, H+, OH-.
Основные электродные процессы:
К: 2H+ +2е → H2
А: Sn → Sn2+ +2е
Электрохимические превращения веществ количественно подчиняются законам Фарадея:
- для массы вещества:
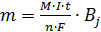 , где
, где
М – молярная масса цинка, 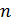 – количество электронов,
– количество электронов, 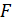 – число Фарадея.
– число Фарадея.
С другой стороны масса равна произведению плотности на объем: 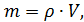
Объем отверстия в заготовке:
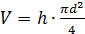 , тогда
, тогда
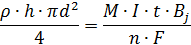
Отсюда время, необходимое для электрохимической прошивки в заготовке:
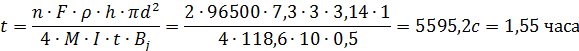
Ответ: 1,55 часа