В химии все многообразие неорганических веществ: принято разделять на две группы – простые и сложные. Простые вещества подразделяются на металлы и неметаллы. А сложные – на производные от простых, образованные путем их взаимодействия с кислородом, водой и между собой. Эту классификацию неорганических веществ в виде схемы изображают следующим образом:
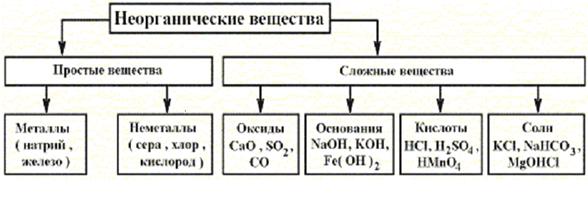
Рис. 2.1. Классификация неорганических соединений.
Классификация реакций в неорганической химии. В неорганической химии различают реакции: 1)соединения, 2)разложения (и те и другие могут быть окислительно-восстановительными реакциями, а могут и не быть таковыми), 3)обмена, 4)замещения, которые всегда являются окислительно-восстановительными. Схемы реакций и примеры даны в таблице 2.1.
Таблица 2.1
Классификация реакций
| Тип реакции | Схема реакции | Примеры реакций |
| Соединение | А +В = АВ | 1) Ca0 + Cl20= Ca2+Cl2- (ОВР) 2) CaO + CO2 = CaCO3 |
| Разложение | АВ = А + В | 1) 2Ag2O = 4Ag +O2 (ОВР) 2) Cu(OH)2 = CuO + H2O |
| Обмен | AB +CD=AD + CB | BaCl2 + Na2SO4 = BaSO4↓ +2NaCl |
| Замещение | AB + C = CB + A | Zn + Pb(NO3)2 = Pb + Zn(NO3)2 (ОВР) |
Рассмотрим получение и свойства наиболее важных классов неорганических соединений.
ОКСИДЫ (окислы) - сложные вещества, состоящие из двух элементов, одним из которых является кислород в степени окисления, равной -2. Общая формула любого оксида - ЭхОу-2. Различают солеобразующие (основные: Li2O, CaO, MgO,FeO; амфотерные: ZnO, Al2O3, SnO2, Cr2O3, Fe2O3; кислотные: B2O3, SO3, CO2, P2O5 Mn2O7) и несолеобразующие: N2O, NO, CO оксиды. Элементы с переменной степенью окисления образуют несколько оксидов (MnO, MnO2, Mn2O7, NO, N2O3, NO2, N2O5). В высшем оксиде, как правило, элемент находится в степени окисления, равной номеру группы.
По современной международной номенклатуре названия оксидов составляют следующим образом: слово «оксид», далее русское название элемента в родительном падеже, степень окисления элемента (если она переменна). Например: FeO – оксид железа (II), P2O5 – оксид фосфора (V).
Основные оксиды это те, которым соответствуют гидроксиды – основания. Основными называют оксиды, взаимодействующие с кислотами с образованием соли и воды. Основные оксиды образуются только металлами в степени окисления +1,+2 (иногда +3), например: BaO, SrO, FeO, MnO, CrO, Li2O, Bi2O3, Ag2O.
Получение основных оксидов:
1) Окисление металлов при нагревании в атмосфере кислорода:
2Mg+O2=2MgO;
2Cu+O2=2CuO.
Этот метод практически неприменим для щелочных металлов, которые при окислении обычно дают пероксиды, поэтому оксиды Na2O, K2O крайне труднодоступны.
2) Обжиг сульфидов:
2СuS+3O2=2CuO+2SO2;
4FeS2+11O2=2Fe2O3+8SO2.
3) Разложение гидроксидов:
Cu(OH)2=CuO+H2O.
Этим методом нельзя получить оксиды щелочных металлов.
4) Разложение солей некоторых кислородсодержащих кислот:
t
BaCO3=BaO+CO2,
t
2Pb(NO3)2=2PbO+4NO2+O2
Свойства основных оксидов. Большинство основных оксидов представляет собой твердые кристаллические вещества ионного характера; в узлах кристаллической решетки расположены ионы металлов, достаточно прочно связанные с ионами O2-, поэтому оксиды типичных металлов обладают высокими температурами плавления и кипения.
Отметим одну характерную для оксидов особенность. Близость ионных радиусов многих ионов металлов приводит к тому, что в кристаллической решетке оксидов часть ионов одного металла может быть заменена на ионы другого металла. Это приводит к тому, что для оксидов часто не выполняется закон постоянства состава, и могут существовать смешанные оксиды переменного состава.
1) Отношение к воде.
Процесс присоединения воды называется гидратацией, а образующееся вещество – гидроксидом. Из основных оксидов с водой взаимодействуют только оксиды щелочных (Li, Na, K, Rb, Cs, Fr) и щелочноземельных металлов (Ca, Sr, Ba, Ra).
Li2O+H2O=2LiOH;
BaO+H2O=Ba(OH)2.
Большинство же основных оксидов в воде не растворяются и не взаимодействуют с ней. Соответствующие их гидроксиды получают косвенным путем – действием щелочей на соли (см. ниже).
2) Отношение к кислотам.
CaO+H2SO4=CaSO4+H2O;
FeO+2HCl=FeCl2+H2O.
3) Отношение к кислотным и амфотерным оксидам.
Основные оксиды щелочных и щелочноземельных металлов при сплавлении взаимодействуют с твердыми кислотными и амфотерными оксидами, а также с газообразными кислотными оксидами при обычных условиях.
CaO+CO2=CaCO3;
3BaO+P2O5=Ba3(PO4)2;
сплавление
Li2O+Al2O3=2LiAlO2.
сплавление
Основные оксиды менее активных металлов взаимодействуют только с твердыми кислотными оксидами при сплавлении.
Кислотные оксиды - оксиды, которые при взаимодействии с основаниями образуют соль и воду. Кислотным оксидам соответствуют гидроксиды – кислоты. Кислотные оксиды – это оксиды неметаллов в различных степенях окисления, либо оксиды металлов в высокой степени окисления (+4 и выше). Примеры: SO2, SO3, Cl2O7, Mn2O7, CrO3.
Химическая связь в кислотных оксидах – ковалентная полярная. При обычных условиях кислотные оксиды неметаллов могут быть газообразными (CO2, SO2), жидкими (N2O3, Cl2O7), твердыми (P2O5, SiO2).
Получение кислотных оксидов.
1) Окисление неметаллов:
S+O2=SO2
2) Окисление сульфидов:
2ZnS+3O2=2ZnO+2SO2
3) Вытеснение непрочных слабых кислот из их солей:
CaCO3+2HCl=CaCl2+CO2 +H2O.
Свойства кислотных оксидов.
1) Отношение к воде.
Большинство кислотных оксидов растворяются в воде, вступая с ней в химическое взаимодействие и образуя кислоты:
SO3+H2O=H2SO4,
CO2+H2O=H2CO3.
2) Отношение к основаниям.
Кислотные оксиды взаимодействуют с растворимыми основаниями – щелочами, образуя соль и воду.
SO2+2NaOH=Na2SO3+H2O;
P2O5+6NaOH=2Na3PO4+3H2O
сплавление
3) Отношение к основным и амфотерным оксидам.
Твердые кислотные оксиды взаимодействуют с основными и амфотерными оксидами при сплавлении. Жидкие и газообразные оксиды взаимодействуют с оксидами щелочных и щелочноземельных металлов при обычных условиях.
P2O5+3CuO=Cu3(PO4)2;
сплавление
3SiO2+Al2O3=Al2(SiO3)3
сплавление
Амфотерные оксиды взаимодействуют и с кислотами и со щелочами, проявляя свойства кислотных и основных оксидов. Им соответствуют амфотерные гидроксиды. Все они твердые вещества, нерастворимые в воде. Примеры амфотерных оксидов: ZnO, BeO, SnO, PbO, Al2O3, Cr2O3, Sb2O3, MnO2.
Свойства амфотерных оксидов.
Амфотерные оксиды реагируют с кислотами как основные:
Al2O3+6HCl=2AlCl3+3H2O,
а со щелочами – как кислотные. Состав продуктов реакции зависит от условий. При сплавлении:
ZnO+2NaOH=Na2ZnO2+H2O;
Цинкат натрия
В растворе щелочи образуется растворимая комплексная соль, содержащая гидроксокомплексный ион:
ZnO+2NaOH+H2O=Na2[Zn(OH)4]
Тетрагидроксоцинкат натрия
Несолеобразующие оксиды – это оксиды неметаллов, которым не соответствуют гидроксиды и соли. Примеры: CO, N2O, NO, SiO.
Оксиды широко распространены в природе. Так вода – самый распространенный оксид покрывает 71% поверхности планеты. Оксид кремния (IV) в виде 400 разновидностей кварца составляет 12% от массы земной коры. Оксид углерода (IV) (углекислый газ) содержится в атмосфере - 0,03% по объему, а также в природных водах. Важнейшие руды: гематит, магнетит, бурый железняк состоят из различных оксидов железа. Бокситы содержат оксид алюминия, и т.д.
ОСНОВАНИЯ – сложные вещества, в которых на атом металла приходится одна или несколько гидроксогрупп ОН-. Степень окисления атомов металла обычно +1, +2 (реже +3). Общая формула оснований Ме(ОН)х, где х – число гидроксогрупп – кислотность основания. (МеОН – однокислотное, Ме(ОН)2 – двухкислотное, Ме(ОН)3 – трехкислотное основание).
Названия основаниям дают следующим образом: «гидроксид», затем русское название металла в родительном падеже, а в скобках римскими цифрами – степень окисления, если она переменная. Например: KOH –гидроксид калия, Ni(OH)2 – гидроксид никеля(II).
При обычных условиях основания – твердые вещества, кроме гидроксида аммония – водного раствора аммиака NH4OH (NH4+ - ион аммония, входящий в состав солей аммония).
Классификация оснований. В зависимости от отношения к воде основания делятся на растворимые (щелочи) и нерастворимые. К растворимым основаниям - щелочам относятся только гидроксиды щелочных и щелочноземельных металлов (LiOH, NaOH, KOH, CsOH, RbOH, FrOH, Ca(OH)2, Sr(OH)2, Ba(OH)2, Ra(OH)2) а также водный раствор аммиака. Все остальные основания практически нерастворимы в воде.
С точки зрения теории электролитической диссоциации основания – электролиты, диссоциирующие в водном растворе с образованием в качестве анионов только гидроксид-ионов:
Ме(ОН)х Û Мех+ + хОН-.
Наличие в растворе ионов гидроксида определяют с помощью индикаторов: лакмуса (синий), фенолфталеина (малиновый), метилоранжа (желтый). Нерастворимые основания не меняют окраски индикаторов.