Самостоятельная работа №2.
Химическая термодинамика
Для выполнения самостоятельной работы по этой теме следует предварительно изучить соответствующие главы [1] (главы 5 и 6), теоретический лекционный материал и примеры решения задач и упражнений в [3], [6], [9].
Самостоятельная работа №1 содержит три задания. Основными справочными материалами к данной теме являются справочники по физико-химическим свойствам веществ [5]. Необходимые справочные материалы по большинству веществ содержатся в соответствующих таблицах в приложениях в конце учебника [1], [2], [4].
Задание 1.
Основные знания и умения: общие понятия об энтальпии, энтропии, энергии Гиббса, умение рассчитывать тепловой эффект химической реакции и энтропию с использованием следствия из закона Гесса, проводить расчеты энергии Гиббса по табличным данным и формулам, определять возможность самопроизвольного протекания процесса на основании значений Энергии Гиббса, проводить расчеты указанных величин как при стандартном состоянии веществ, так и при любых отличных от стандартных.
1.1. Вычислите тепловой эффект реакции SO2г + Cl2г®SO2Cl2г при Т=298 К, стандартных состояниях веществ и при: а) p=const, б) при V=const.
Решение:
Согласно принятой термодинамической системе знаков, тепловой эффект реакции отождествляется с изменением энтальпии или внутренней энергии системы. Теплота, поглощенная системой, считается положительной и соответствует положительному тепловому эффекту и положительному изменению энтальпии, а теплота, отданная системой в окружающую среду, - отрицательной и соответствует тепловому эффекту и энтальпии со знаком «минус». Тепловые эффекты химических реакций подчиняются законам Гесса, а следствием этого закона является то, что тепловой эффект процесса можно рассчитать как разность суммарной энтальпии продуктов реакции и суммарной энтальпии исходных веществ:
Δ rН 0 = ∑ν i Δ fН 0продуктов – ∑ν j Δ fН 0исх. в-в
Стандартные энтальпии образования табулированы при 298,15К(Δ fН 0 i 298, кДж/моль). Следует помнить, что стандартное состояние вещества отвечает нахождению газообразных веществ в виде идеальных газов с относительным парциальным давлением, равным 1, растворов – в виде идеальных растворов с концентрацией 1 моль/л.
Стандартную энтальпию образования вещества определяем по таблице «Термодинамические характеристики некоторых веществ (при 298)», имеющейся в приложениях учебника, задачника, сборника лабораторных работ или справочниках по физико-химическим свойствам веществ.
Для термодинамических расчетов в данной работе следует выписать из таблицы все необходимые термодинамические характеристики веществ Вашей реакции:
Таблица 1. Термодинамические характеристики веществ.
| Вещество | Δ fН 0298, кДж/моль | S 0298, Дж/(моль∙K) | Δ fG 0298, кДж/моль | C 0298, Дж/(моль∙K) | Область Т,К |
| SO2г | -296,9 | 248,07 | -300,21 | 39,87 | 298÷2000 |
| Cl2г | 222,96 | 33,93 | 298÷3000 | ||
| SO2Cl2г | -363,17 | 311,29 | -318,85 | 77,4 | 298÷1000 |
а)при p=const.
Qp = ∆rH0298 = DfH0298(SO2Cl2г) - DfH0298 (SO2г) - DfH0298 (Cl2г) = -363,17-(-296,9) = = -66,27кДж
∆rH0298= -66,27 кДж ∆rH0298˂ 0 – реакция экзотермическая
б) при V=const.
Qv = Qp- ∆nRT, где ∆n - разница между числом молей газообразных продуктов и числом молей газообразных исходных веществ (разность стехиометрических коэффициентов в уравнении реакции): ∆n = 2-1 = 1моль
Qv = -66,27- 1∙8,31∙298 = -2542,65кДж
1.2. Определите количество теплоты, которое выделяется (поглощается) при взаимодействии вещества SO2 объемом 100м3.
Решение:
Рассчитаем количество вещества SO2 в объеме 100м3(или 100∙103л), зная, что один моль любого газа при н.у. занимает объем 22,4 л
n = V(л)/VM(л/моль) = 100∙103/22,4 = 4464,2 моль
Используя расчетные данные задания 1.1, вычисляем:
Q = n∙∆ r H0298
Q = 4464,2∙(-66,27) = -295842,53 кДж
Выделяется ≈ 296 МДж теплоты.
Определите область температур, в которой возможно самопроизвольное протекание реакции в прямом направлении при стандартных состояниях всех веществ.
Решение:
Направление любого процесса определяется соотношением энтальпийного∆ rH и энтропийного Т ∆ rS факторов реакции. Функцией состояния системы, учитывающей совместное влияние этих факторов является энергия ГиббсаDrG. Реакция протекает самопроизвольно при стандартных состояниях компонентов, если:
 | |||
 | |||
∆ rG 0 Т = [∆ rH 0298+ ∆ rС 0 pdT + Т ∆ rS 0298 + Т (∆rС0p/ T)dT ]< 0
Для расчетов, не требующих высокой точности, можно в первом приближении принять ∆rС0p =0 и ∆ rH 0 Т =DrH0298 и ∆ rS 0 Т =DrS0298не зависят от температуры. Рассчитаем температуру, при которой DrG0T=0:
DrG0T = DrH0298 – T∙DrS0298=0
T =DrH0298/DrS0298
Значение энтальпии реакции рассчитано в задании 1.1. Рассчитаем энтропию∆ rS как разность суммарной энтропии продуктов реакции и суммарной энтропии исходных веществ:
Δ rS 0 = ∑ν iS0 продуктов – ∑ν jS 0исх. в-в
DrS0298 = S0298(SO2Cl2г) - S0298(SO2г) - S0298(Cl2г) = 311,3 - (248,07+ 222,96) =
= -159,73Дж/К
DrS0298=-159,73Дж/К
T=(-66,27)/(-159,73∙10-3)
T=415
Рассчитаем энергию Гиббса при температуре 298Ккак разность между суммарной энергией Гиббса продуктов и суммарной энергией Гиббса исходных веществ, используя табличные данные (см.таблицу 1).
Δ rG0298 = ∑ν i Δ fG0298,i продуктов– ∑ν j Δ fG 0298,j исх веществ
Δ rG0298 = -318,85 – (0 + (-300,21)) = -18,64 кДж
Покажем температурный интервал графически. Зная значение энергии Гиббса при температуре 298К и 415К, проведем на графике зависимости Δ rG0 от Т прямую через две точки.
 |
Как следует из полученных данных, искомой областью температур, в которой возможно самопроизвольное протекание данной реакции при стандартных состояниях, является интервал температур 298÷415. В этом интервале энергия Гиббса DrG0T ˂ 0
1.4. Рассчитайте значения термодинамических характеристик DrH0, DrS0, DrG0 при температуре 800 К, считая DrC0p = const. По полученным значениям сделайте вывод и сравните со значениями при T=298 К.
Решение:
По условию задания DrC0p = const, то есть изменением суммарной стандартной теплоемкости системы в ходе реакции можно пренебречь, тогда для расчета энтальпии и энтропии имеем приближенные выражения зависимости от температуры в виде:
DrH0T= DrH0298 + DrC0p∙(T-298)
DrS0T = DrS0298+ DrC0p∙ln(T/298)
Суммарную стандартную теплоемкость системы в результате реакции рассчитаем как разность суммарной теплоемкости продуктов реакции и суммарной теплоемкости исходных веществ:
DrC0p=∑niC0piпрод - ∑niC0piисход
Из таблицы 1:
DrC0p= 77,4-33,93-39,87 = 3,72 [Дж/К]
Подставим полученное значение в выражения для энтальпии и энтропии:
DrH0800 =-66,27+3,72∙502 = 1801,17[кДж]
DrS0800 =-159,73 + 3,72∙0,986 = -156,06[Дж/K]
DrG0298 = DrH0298 – T∙DrS0298 = -66,27 – (-159,73∙10-3∙298) = -18,67[кДж]
DrG0800 = DrH0800 – T∙DrS0800 = 1801,17 – (800∙(-156,06∙10-3))= 1925,97[кДж]
DrG0298 = -18,67 [кДж] ˂ 0
DrG0800= 1925,97 [кДж] ˃ 0
На основании полученных данных можно сделать вывод, что, если при температуре 298К возможно самопроизвольное протекания данной реакции в прямом направлении, то при температуре 800К энергия Гиббса больше нуля, то есть самопроизвольное протекание процесса в прямом направлении невозможно. Это подтверждается также результатами расчетов задания 1.3.
1.5. Как изменится протекание процесса при температуре Т=800 К, если начальные парциальные давления газообразных веществ левой части уравнения будут по 4,8∙103Па, а правой части – по 3∙103Па.
Решение:
Если начальные парциальные давления газообразных веществ не равны единице, тогда энергию Гиббса будем рассчитывать по уравнению изотермы Вант Гоффа, которое для данной реакции SO2г + Cl2г®SO2Cl2гимеет вид:
DrG800 = DrG0800+RTln( (SO2Cl2)/
(SO2Cl2)/  (SO2)∙
(SO2)∙  (Cl2)
(Cl2)
Здесь под знаком ln - отношение произведения относительных парциальных давлений продуктов реакции на произведение относительных парциальных давлений исходных веществ:  =
=  . Стехиометрические коэффициенты в данном уравнении равны 1.
. Стехиометрические коэффициенты в данном уравнении равны 1.
DrG800 = 1925,95+8,31∙800∙ln( )= 1947,28 кДж
)= 1947,28 кДж
Направление протекания процесса не изменится, т.е. при заданных условиях также невозможно самопроизвольное протекание процесса в прямом направлении, так как DrG800˃ 0.
Задание 2.
В этом задании предлагаются разные задачи для разных вариантов, например, для вариантов 1-15 необходимо определить термодинамические функции для образования вещества, не используя табличные данные.
По данным термохимическим уравнениям рассчитайте при Т = 298 К стандартные энтальпию, энтропию и энергию Гиббса образования вещества А.
Таблица 2. Исходные данные варианта.
| Уравнения | DrH0298, кДж | DrS0298, Дж/К | DrG0298, кДж | Вещество А |
| а)Zrт +ZrCl4г = 2ZrCl2г | +215 | +208 | +153 | ZrCl2 |
| б) Zrт +2Cl2г = ZrCl4г | -867 | -116 | -832 |
Решение:
Задание основано на том, что с уравнениями химических реакций можно производить любые математические действия. Те же самые операции производят и со значениями термодинамических функций.
1) Сложим левую и правую части уравнений (а) и (б):
Zrт +ZrCl4г+ Zrт + 2Cl2г = 2ZrCl2г +ZrCl4г
2) Сократим на одинаковые слагаемые:

 2Zrт + ZrCl4г + 2Cl2г = 2ZrCl2г + ZrCl4г
2Zrт + ZrCl4г + 2Cl2г = 2ZrCl2г + ZrCl4г
3) Разделим левую и праву части на 2:
Zrт +Cl2г= ZrCl2г
Рассчитаем энтальпию образования ZrCl2:
[(а) + (б)]:2=(215-867):2= -326
Рассчитаем энтропию образования ZrCl2:
[(а) + (б)]:2=(208-116):2= 46
Рассчитаем энергию Гиббса образования ZrCl2:
[(а) + (б)]:2=(153-832):2= -226
DfH0298(ZrCl2г)=-326 кДж/моль
S0298(ZrCl2г)= 46Дж/моль∙К
DfG0298(ZrCl2г)=-226 кДж/моль
Задание 3.
Задание 3 содержит материал по теме «Химическое равновесие». В таблице 3 приведены исходные данные одного из вариантов для выполнения всех пунктов задания 3.
Таблица 3
| №№ | Реакция | Т | Кр | Т1, Т2 |
| С2Н2+ Н2↔ С2Н4 | 600, 1000, 1500 | 1,19·109 5·102 3,09·10-1 | 800, 1400 |
3.1. Исходя из приведенных в табл.3 значений констант равновесия Кр при разных температурах, обсудите вопрос о выходе продуктов в ходе Вашей реакции с ростом (уменьшением) температуры. Напишите выражение константы равновесия Вашей реакции, считая, что все вещества находятся в газовой фазе.
Решение:
Данное задание не требует каких либо математических расчетов. Сравним и проанализируем данные по температурам и значениям констант равновесия: с увеличением температуры константа равновесия уменьшается, следовательно, равновесие реакции сдвигается вправо в сторону исходных веществ и выход продуктов уменьшается. Согласно принципу ЛеШательереакция дегидрирования ацетилена является экзотермической реакцией.
Выражение для константы равновесия:
КР = 
3.2. Используя значения Кр при разных температурах, определите термодинамические характеристики реакции (∆ rH0Т, ∆ rS0Т ∆ rG0Т). Какие допущения Вы сделали? Значения температуры выберите сами.
Решение:
Определим термодинамические характеристики данной реакции при 298К, используя значения Кр при температурах 1000К и 1500К. Для расчета воспользуемся выражениями для энергии Гиббса:
DrG0T = DrH0298 – T∙DrS0298 и DrG0T = -RTln(Кp);
Допустим, что DrH0 и DrS0 не зависят от температуры. Составим систему из двух уравнений с двумя неизвестными (Т1=1000; Т2=1500):
DrG0T1 = DrH0298 – T1∙DrS0298 = -RT1ln(Кp1);
DrG0T2 = DrH0298 – T2∙DrS0298 = -RT2ln(Кp2);
Для упрощения записи обозначим DrH0298= х, а DrS0298= у, тогда
(1) х – 1000 у = -8,31∙1000 ln500,
(2) х – 1500 у = -8,31∙1500 ln0,309,
Вычтем из уравнения (2) уравнение (1) и определим у:
500 у = -8,31∙1000∙ln500+8,31∙1500∙ln0,309
у = 
Определим значение х:
х = -8,31∙1000∙ln500 - 1000∙132,56 = -184,2 [кДж]
х = DrH0298= -184,2 кДж
у = DrS0298= -132,56 Дж/К
DrG0298 = DrH0298 – 298∙DrS0298= -184,2 + 39502,88∙10-3 = -144,7 к Дж
DrH0298=-184,2кДж
DrS0298= -132,56Дж/К
DrG0298 = -144,7 кДж
3.3. Рассчитайте значения Кр и Кс при температурах Т1 и Т2 и проанализируйте полученные значения.
Решение:
Константы равновесия Кc и Кp связаны между собой соотношением:
Кc=Кp/(RT)Δν,
где Δν разность между суммой стехиометрических коэффициентов продуктов реакции и суммой стехиометрических коэффициентов исходных веществ.
Константу Кр для одной из температур можно рассчитать двумя способами, например, для Т=800К, из выражения:
DrGT = -RTln(Кp) откуда Кp=exp(DrG0T /(-RT))
Пренебрегая зависимостью энтальпии и энтропии от температуры, энергию Гиббса при Т=800К, можно выразить:
DrG0800 = DrH0298 – 800∙DrS0298
Зависимость константы равновесия от температуры можно выразить уравнением изобары Вант Гоффа:

здесь Т1=1000,  = Кр1000; Т2=800,
= Кр1000; Т2=800, 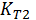 = Кр800; DrH0=DrH0298
= Кр800; DrH0=DrH0298
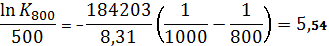
Кр800 =1,27∙105

Кр1400 = 0,89
с ростом температуры Кpуменьшается.
Рассчитаем Кс: Кc=Кp/(RT)Δν
Для данной реакции Δν= 1-2= -1, следовательно

