Лекция № 3.
КИСЛОТА САЛИЦИЛОВАЯ.
ACIDUM SALICYLICUM.
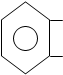 |
COOH
2 – гидроксибензойная кислота
OH о- оксибензойная кислота
ГФ Х ст 21.
Салициловая кислота была открыта в 1838г. Встречается в виде своих производных в ряде растений.
Салициловую кислоту можно получить из гликозида салицина, содержащегося в коре ивы. Практического значения этот способ не имеет.
В химической промышленности салициловую кислоту получают путем карбоксилирования фенола по реакции Кольбе – Шмидта.
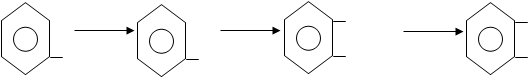 |
NaOH CO2 COONa HCL COOH
ОН ONa OH OH
Выпаренную досуха смесь фенола с эквивалентным количеством едкого натра нагревают в автоклавах (130 оС) с углекислотой под давлением 4,5 – 5 атмосфер. Продукт реакции растворяют в воде, подкисляют хлороводородной кислотой и выделившуюся салициловую кислоту перекристаллизовывают
Механизм реакции заключается во внедрении углекислоты в бензольное ядро в орто и пара положения, активированные наличием фенолята.
Описание:
Белые, мелкие, игольчатые кристаллы или кристаллический порошок без запаха. Мало растворим в воде, растворим в кипящей воде, легко растворим в спирте, эфире, трудно в хлороформе. Летуч с водяным паром. При нагревании возгоняется.
Подлинность.
- С р-ром хлорида окисного железа образуется сине-фиолетовое окрашивание, которое исчезает от прибавления нескольких капель хлороводородной кислоты и сохраняется в присутствии уксусной кислоты. В присутствии хлорида железа происходит реакция по схеме:
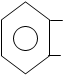 | |||
 | |||
СООН COO
+ FeCL3 FeCL + 2HCL
ОН O
- При нагревании 0,1 препарата с 0.3 цитрата натрия, происходит разложение препарата с образованием фенола (запах) и углекислого газа
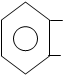 | |||
 | |||
 COOH to
COOH to
 + CO2
+ CO2
OH OH
- При нагревании кислоты салициловой с конц. серной кислотой образуется углекислый газ, при пропускании которого через известковую воду образуется опалесценция.
 Ca(OH)2 + CO2 CaCO3 ↓ + H2O
Ca(OH)2 + CO2 CaCO3 ↓ + H2O
- Нефармакопейная.
При действии на препарат раствором формальдегида в присутствии конц. серной кислоты (реактив Марки) образуется окрашенное в красный цвет соединение - ауриновый краситель.
- t0 плав. 158-161 оС.
Чистота:
1. Спиртовой р-р препарата должен быть бесцветным и прозрачным.
- Не должно быть красящих веществ, фенола, железа.
- Хлориды, сульфаты, тяжелые металлы и органические примеси в пределе
эталона.
Количественное определение.
Метод кислотно – основное титрование.
Точную навеску препарата растворяют в нейтрализованном по ф/ф спирте и титруют 0,1 н р-ром натрия гидроксида до розового окрашивания.
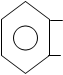 | |||
 | |||
СООН COONa
 + NaOH + H2O
+ NaOH + H2O
ОН OH
Э=Mr
Хранение:
В хорошо укупоренной таре, предохраняющей от действия света.
Применение:
Антисептическое средство и кератолитическое.
Лек. формы: спиртовой р-р 2-5%, присыпки, мази и пасты 1-10%.
НАТРИЯ САЛИЦИЛАТ.
NATRII SALICYLAS.
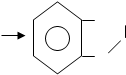
 |
COONa
OH
Получение:
При нейтрализации р-ра салициловой кислоты эквивалентным количеством карбоната натрия или гидрокарбоната натрия.
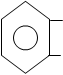 | |||
 | |||
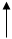 СООН COONa
СООН COONa
 + NaHCO3 + H2O + CO2
+ NaHCO3 + H2O + CO2
ОН OH
Соль перекристаллизовывают из спирта.
Описание:
Белый кристаллический порошок или мелкие чешуйки без запаха. Очень легко растворим в воде, легко в глицерине, растворим в спирте, практически не растворим в эфире.
Подлинность:
- Препарат растворяют в воде. Полученный р-р дает характерные реакции на салицилаты с хлоридом железа (III), образуется сине – фиолетовое окрашивание.
- Препарат растворяют в воде, прибавляют разб. азотную кислоту. Осадок отфильтровывают, промывают водой, высушивают. Определяют to плавления салициловой кислоты. (156-161о С).
- На натрий – окрашивание пламени в желтый цвет.
- Определяют инфракрасный спектр препарата.
Чистота:
- Определяют прозрачность и цветность р-ра. (растворяют в воде).
- Хлориды, сульфаты, тяжелые металлы, органические примеси в пределе эталона.
- Потеря в массе при высушивании не более 0,5 %.
- Определяется микробиологическая чистота.
Количественное определение.