Ферментативный синтез
Установлено, что протеолитические ферменты (химотрипсин папаин термолизин и др.) в специфических буферных растворах (водно-органические смеси) способны катализировать образование пептидных связей.
Полусинтез пептидов и белков
Инсулин свиньи и человека отличается от ним аминокислотным остатком. У свиньи- Ала, у человека - Тре.
Синтез пептидов на полимерной основе.
Общая идея метода заключается в том, что растущая полипептидная цепь связывается на протяжении синтеза ковалентной связью с полимерной частицей, которая настолько крупнее молекулы пептида, что однозначно определяет физико-химические свойства (прежде всего растворимость) всего соединения.
Это дает возможность удалять побочные продукты и непрореагировавшие вещества, а также продукты синтеза простой фильтрацией и промыванием осадка на фильтре без неизбежных потерь при перекристаллизациях и очистках на промежуточных стадиях.
При этом принципиальная основа синтеза остаётся прежней, то есть в синтезе участвует карбоксильные и аминные компоненты, требуется активация карбоксильной группы перед конденсацией.
Синтез на полимерной основе можно проводить двумя путями: вводя полимер в качестве защитной группы (чаще всего на карбоксильную группу аминокомпонента) или активируя карбоксильную группу с помощью полимера. Другими словами, полимеры могут быть использованы в качестве группировок Y или Х в пептидном синтезе.
Наибольшее распространение получило введение полимерных групп для защиты карбоксильного конца пептидной цепи в сочетании с методом ступенчатого удлинения цепи. Этот принцип был разработан Меррифилдом и получил название твердофазный синтез (1962)
В качестве полимерной основы им был выбран сополимер стирола и дивинилбензола, который был подвергнут хлорметилированию.
При взаимодействии хлорметильных групп такого полимера с триэтиламмониевой солью N-трет.бутоксикарбониламинокислоты возникает ковалентная сложноэфирная связь между аминокислотой и полимером. Далее снимают третбутоксикарбонильную защиту и используют образовавшейся полимер как аминный компонент пептидного синтеза. Затем проводят ступенчатое удлинение цепи до тех пор, пока не получится пептид нужной длины и, после чего на последней стадии синтеза разрушают сложноэфирную связь с полимером и выделяют пептид.
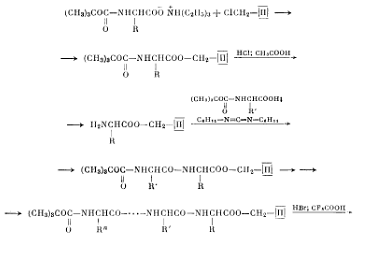
Основными достоинствами метода являются высокие выходы и возможность стандартизации и автоматизации процесса синтеза, что сокращает затраты времени. Пригодность этого метода для синтеза биологически активных пептидов была показана на примере синтеза брадикинина и его аналога метионилбрадикинина. Весь синтез был проведён за 8 дней с высоким выходом до 65%
В настоящее время разработана конструкция автоматической установки для твердофазного синтеза Подробно изучаются различные комбинации защитных групп и методы их удаления а также возможность синтеза длинных аминокислотных последовательностей
Трудности, которые при этом встречаются связаны с образованием так называемых ложных пептидов. Наряду с пептидом обладающим заданной аминокислотной последовательностью, продукт синтеза содержит примеси пептидов, у которых те или иные аминокислотные звенья пропущены. Вследствие различной пространственной доступности центров роста цепи внутри полимерных частиц количество примесей иногда составляет до 10%.
Поэтому нужное вещество выделяют с помощью ионно-обменной хроматографии.
Другой нежелательный процесс - набухание полимеров в процессе синтеза, вызывающее затруднение при фильтрации.
Меррифилд применял твердый полимер, нерастворимый ни в водных, ни в органических средах. Советские исследователи применяли эмульсионный полистирол растворимый в органических растворителях, но нерастворимый в воде. Это позволило обойти такие неприятные явления, как образование ложных пептидов, набухание полимера и затруднения при фильтрации.
Некоторые трудности можно устранить, если заменить сополимер стирола фенол-формальдегидной смолой. Она не набухает в органических растворителях. Или можно проводить синтез путем конденсации фрагментов, что упрощает операции очистки на последней стадии.
Другой вариант - введения полимерных активирующих групп.
Так, например, был получен набор N-защищённых аминокислот, связанных сложноэфирной связью с полинитростиролом.
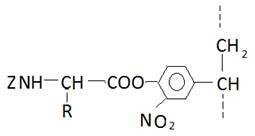
В этих же целях был использован сополимер этилена и N-оксималеиниимида.
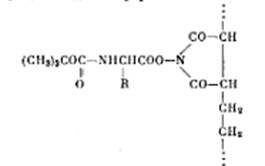 Получаемые при этим полимерные производные кислот напоминают N-оксисунцинилимидные эфиры.
Получаемые при этим полимерные производные кислот напоминают N-оксисунцинилимидные эфиры.
Применение активированных полимерных производных N-защищённых аминокислот при ступенчатом синтезе пептидов позволяет получать пептиды быстро с хорошим выходом и высокой степенью чистоты.