(ПРОТОЛИТОМЕТРИЯ)
Метод основан на протолитической реакции в водном растворе:
Н3О+ + ОН– → 2Н2О.
Реакция протекает между веществами с кислотными и основными свойствами. В соответствии с природой титранта методы протолитометрии делятся на ацидиметрию (титрант – кислота, от латинского слова "acid") и алкалиметрию (титрант – щелочь, от латинского слова "alkaly"). Краткая характеристика методов представлена в табл. 5.
Таблица 5
Характеристика методов протолитометрии
| Метод | Титрант | Стандартное вещество | Объект анализа |
| Алкалиметрия | NaОН | Щавелевая кислота Н2С2О4·2Н2О; янтарная кислота Н6С4О4 | Сильные и слабые кислоты; соли, образованные слабыми основаниями и сильными кислотами |
| Ацидиметрия | НСl | Карбонат натрия Na2СO3; тетраборат натрия Na2В4О7·10Н2О | Сильные и слабые основания; соли, образованные слабыми кислотами и сильными основаниями |
Растворы, применяемые в протолитометрии, не имеют окраски, поэтому для визуального фиксирования конечной точки титрования (точки эквивалентности) применяют кислотно-основные индикаторы.
Кислотно-основные индикаторы (рН-индикаторы) – органические кислоты и основания, изменение окраски которых зависит от рН среды. Молекулярная и ионная формы индикаторов имеют различную окраску. Кроме того, изменение окраски связано с таутомерией молекул индикатора. Существуют одноцветные индикаторы, бесцветные в кислой среде и окрашенные в щелочной (например, фенолфталеин), и двухцветные (например, метиловый оранжевый), характеризующиеся различной окраской в кислых и щелочных растворах (табл. 6).
Таблица 6
Некоторые кислотно-основные индикаторы
| Индикатор | ∆pH | Изменение окраски | Окраска в точке эквивалентности |
| Метиловый фиолетовый | 0–1,8 | Желтая–фиолетовая | Зеленая |
| Тимоловый синий | 1,2–2,8 | Красная–желтая | Оранжевая |
| Метиловый оранжевый | 3,1–4,4 | Красная–желтая | Оранжевая |
| Бромкрезоловый зеленый | 3,9–5,4 | Желтая–синяя | Зеленая |
| Метиловый красный | 4,4–6,2 | Красная–желтая | Оранжевая |
| Бромтимоловый синий | 6,0–7,6 | Желтая–синяя | Зеленая |
| Тимоловый синий | 8,0–9,6 | Желтая –красная | Оранжевая |
| Фенолфталеин | 8,2–9,8 | Бесцветная–красная | Розовая |
| Тимолфталеин | 9,3–10,5 | Бесцветная–синяя | Голубая |
| Ализариновый желтый | 9,7–10,8 | Желтая –красная | Оранжевая |
С точки зрения ионной теории индикаторов окраска молекулярной и ионной форм рН-индикатора существенно отличается. В зависимости от рН среды преобладает одна из форм индикатора. Например, фенолфталеин в молекулярной форме бесцветен, его ионная форма окрашена в малиновый цвет:
НInd ↔ Н+ + Ind–
бесцвет. малинов.
При добавлении кислоты равновесие смещается в сторону образования молекул индикатора, которые не имеют окраски. При добавлении к раствору щелочи равновесие смещается в сторону образования ионов индикатора, которые окрашены в малиновый цвет.
Каждый индикатор характеризуется интервалом перехода окраски – интервалом значений рН, внутри которого индикатор изменяет окраску, за его пределами преобладает одна из форм индикатора. Интервал перехода окраски (∆pH) рассчитывают по формуле:
∆pH = рКi ± 1,
где рКi = – lg Кi; Кi – константа ионизации индикатора.
Интервал перехода окраски зависит от природы индикатора и его свойств. Чем меньше интервал перехода окраски, тем ценнее индикатор. Значение рН, при котором заканчивается титрование в присутствии данного индикатора, называется показателем титрования (рТ). Изменение окраски происходит, как правило, при равных значениях концентраций молекулярной и ионной форм индикатора, поэтому во многих системах рТ= рКi.
Требования к кислотно-основным индикаторам:
¨ резко различная окраска индикатора при близких значениях рН;
¨ минимальный интервал изменения окраски;
¨ контрастный переход окраски;
¨ стабильность окраски индикатора;
¨ обратимость изменения окраски.
 Принцип выбора индикатора: интервал перехода окраски индикатора должен совпадать с точкой эквивалентности. Так, при титровании раствора уксусной кислоты раствором NaOH протекает реакция:
Принцип выбора индикатора: интервал перехода окраски индикатора должен совпадать с точкой эквивалентности. Так, при титровании раствора уксусной кислоты раствором NaOH протекает реакция:
СН3СООН + NaOH СН3СООNa + H2O
или в ионном виде:
 СН3СООН + OH– СН3СОО– + H2O.
СН3СООН + OH– СН3СОО– + H2O.
В точке эквивалентности вся кислота оттитрована, но за счет смещения равновесия влево, рН раствора определяется наличием сопряженного основания (ионов ОН–).
Титрование заканчивается в щелочной среде, поэтому для фиксирования точки эквивалентности необходим индикатор, имеющий интервал перехода окраски ∆рН > 7 (например, фенолфталеин).
Для точного выбора индикатора рассчитывают кривые титрования.
КРИВЫЕ ТИТРОВАНИЯ
Кривая титрования раствора сильной кислоты сильным основанием (или наоборот).
Титрование раствора NаOH раствором соляной кислоты:
NаOH + HCl→ NаCl + Н2О
С(NаOH)=С(HCl)=0,1 моль/дм3 ; объем раствора V=100 см3
Расчет равновесных концентраций основания и кислоты рассчитываем по закону эквивалентов:  .
.
| V,см3 | Состав раствора | Ск | Сосн | Расчет | рН |
| NаOH | 0,1 | рН=14+lg Сосн=14+lg10–1= 14–1 | |||
| NаOH | 0, 1·10 | рН = 14+ lg 10–2 = 14–2 | |||
| 99,9 | NаOH | 0,1·0,1 | рН= 14+lg 10–4= 14–4 | ||
| NаCl | – | – | рН = 7 | ||
| 100,1 | HCl | 0,1·0,1 | рН = –lg Ск = –lg10–4= 4 | ||
| HCl | 0,1·1 | рН = –lg 10–3= 3 | |||
| HCl | 0,1·10 | рН = –lg 10–2= 2 |
 рН
рН
По результатам расчета строим кривую титрования в координатах рН – V титранта. Скачок на кривой титрования равен 10–4= 6 ед.
Индикатор для фиксирования точки эквивалентности выбирают таким образом, чтобы интервал перехода его окраски совпадал со скачком на кривой титрования. Из наиболее распространенных индикаторов здесь подойдет метиловый красный (интервал перехода окраски равен ∆рН=4–6) и фенолфталеин (интервал перехода окраски ∆рН= 8–10).
Кривая титрования раствора слабой кислоты сильным основанием.
Уксусная кислота может быть оттитрована раствором гидроксида натрия:
СН3СООН + NaOH→ СН3СООNa + Н2О
В справочной таблице находим значение рК= 4,76. Расчет равновесных концентраций кислоты, соли и основания рассчитываем по закону эквивалентов:  .
.
| V,см3 | Состав раствора | Ск | Сс | Расчет | рН |
| СН3СООН | 0,1 | – | рН=1/2рКк –1/2 lg Ск= 1/2 4,76– 1/2 lg10–1= 2,38+0,5 | 2,88 | |
| СН3СООН СН3СООNa | 0,1·50 | 0,1·50 | рН = рКк – lg Ск/Сс= 4,2 – lg0,05/0,05= 4,76–0 | 4,76 | |
| 0,1·10 | 0,1·90 | рН = 4,76 – lg 10–2/10–1 = 4,76 +1 | 5,76 | ||
| 99,9 | 0,1·0,1 | 0,1·99,9 | рН = 4,76 – lg 10–4/10–1 = 4,76 + 3 | 7,76 | |
| СН3СООNa | – | 0,1·100 | рН = 7 + 1/2рКк + 1/2 lg Сс=7+1/2·4,76+1/2 lg 10–1 | 8,88 | |
| 100,1 | NaOH | 0,1·0,1 | рН =14 – рОН= 14+lg Сосн =14 + lg 10–4= 14 –4 | ||
| NaOH | 0,1·1 | рН = 14 + lg 10–3= 14-3 | |||
| NaOH | 0,1·10 | рН = 14 + lg 10–2= 14-2 |
По результатам расчета строим кривую титрования в координатах рН – V титранта. Скачок на кривой титрования равен 10 – 7,76= 2,24 ед.
Индикатор для фиксирования точки эквивалентности выбирают таким образом, чтобы интервал перехода его окраски совпадал со скачком на кривой титрования. Из наиболее распространенных индикаторов здесь подойдет фенолфталеин. Интервал перехода окраски равен ∆рН= 8–10. Переход окраски от бесцветного к малиновому.
 рН
рН
 10
10
9 фенолфталеин т.э. скачок
0 50 90 100 110 V,см3
Кривая титрования раствора слабого основания сильной кислотой.
Раствор NН4OH можно оттитровать раствором соляной кислоты:
NН4OH + HCl→ NН4Cl + Н2О
В справочной таблице находим значение рК(NН4OH)=4,75.
С(NН4OH)=С(HCl)=0,1 моль/дм3
Расчет равновесных концентраций основания, соли и кислоты рассчитываем по закону эквивалентов:  .
.
| V,см3 | Состав раствора | Ск | Сс | Расчет | рН |
| NН4OH | 0,1 | – | рН=14 – 1/2рКосн +1/2 lg Сосн= 14–1/2 ·4,75+ 1/2 ·lg1·10–1= 11,625–0,5 | 11,12 | |
| NН4OH NН4Cl | 0,1·50 | 0,1·50 | рН = 14–рКосн + lg Сосн/Сс= 14–4,75+ lg0,05/0,05= 9,25–0 | 9,25 | |
| 0,1·10 | 0,1·90 | рН = 14–4,75+ lg 1·10–2/1·10–1 = 9,25– 1 | 8,25 | ||
| 99,9 | 0,1·0,1 | 0,1·99,9 | рН= 14–4,75+lg 1·10–4/1·10–1= 9,25– 3 | 6,25 | |
| NН4Cl | – | 0,1·100 | рН = 7 – 1/2рКосн – 1/2 lg Сс=7–1/2·4,75–1/2 lg 1·10–1 | 5,12 | |
| 100,1 | HCl | 0,1·0,1 | рН = –lg Ск = –lg 1·10–4= 4 | 4,0 | |
| HCl | 0,1·1 | рН = –lg 1·10–3= 3 | 3,0 | ||
| HCl | 0,1·10 | рН = –lg 1·10–2= 2 | 2,0 |
По результатам расчета строим кривую титрования в координатах рН – V титранта. Скачок на кривой титрования мал и равен 6,25–4= 2,25 ед.
Индикатор для фиксирования точки эквивалентности выбирают таким образом, чтобы интервал перехода его окраски совпадал со скачком на кривой титрования. Из наиболее распространенных индикаторов здесь подойдет метиловый красный. Интервал перехода окраски равен ∆рН= 4–6. Переход окраски от желтого в щелочной среде к красному – в кислой.
 рН
рН
 7
7
0 50 90 100 110 V,см3
РЕДОКСИМЕТРИЯ
Редоксиметрия – группа титриметрических методов анализа, в основе которых находятся реакции, протекающие с изменением степеней окисления реагирующих веществ. Окисление одного вещества неразрывно связано с восстановлением другого, поэтому реакции такого типа называются окислительно-восстановительными. Вещество может существовать в двух формах – окисленной (Ох) и восстановленной (Red), которые образуют сопряженную редокс - пару.
Термин "редокс" произошел в результате сочетания латинских слов reductio – восстановление и oxydatio – окисление.
В растворе протекает окислительно-восстановительная реакция:
Ох1 + Red2 → Red1 + Ох2,
восстановление Ох1 + ne → Red1,
окисление Red2 – ne → Ох2.
Количественной характеристикой способности веществ окисляться или восстанавливаться является стандартный электродный потенциал (ЕО).Для нахождения ЕО измеряют электродвижущую силу гальванического элемента, одним из полуэлементов которого является стандартный водородный электрод, другим – электрод, на котором протекает полуреакция с участием данной редокс-парой.
Стандартный электродный потенциал – равновесный потенциал, измеренный относительно водородного электрода при активностях всех участников полуреакции, равных 1 моль/дм3 и при условии, что система находится в стандартных условиях (Р = 1,013 ·105 Па (1 атм); Т = 297 К); ЕО зависит от температуры, давления и природы растворителя.
В реальных системах электродный потенциал отличается от стандартного, так как изменяются условия измерения. Реальный редокс-потенциал (Е)зависит от природы редокс-пары, активности ионов, температуры. Количественно эта зависимость описывается уравнением Нернста:
 ,
,
где  – стандартный электродный потенциал, В;
– стандартный электродный потенциал, В;  – универсальная газовая постоянная, 8,314 Дж/моль·К; Т – абсолютная температура, К;
– универсальная газовая постоянная, 8,314 Дж/моль·К; Т – абсолютная температура, К;  – постоянная Фарадея, 9,65·104 Кл;
– постоянная Фарадея, 9,65·104 Кл;  – число электронов, принимающих участие в электродной реакции;
– число электронов, принимающих участие в электродной реакции; 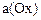 и
и  – активности окисленной и восстановленной форм вещества соответственно.
– активности окисленной и восстановленной форм вещества соответственно.
Если в реакции компоненты находятся в стандартном состоянии (твердые вещества, газы), их активность а= 1. Активности компонентов следует возвести в степени, равные стехиометрическим коэффициентам.
При подстановке всех констант, переходе от натурального логарифма к десятичному и 25 ОС уравнение Нернста принимает вид, в котором применяется для расчета реальных потенциалов окислительно-восстановительных систем:
 .
.
Методы редоксиметрии классифицируются в зависимости от названия титрантов (табл. 7).
Таблица 7
Характеристика методов редоксиметрии
| Метод | Титрант | Стандартное вещество | Индикатор | Объект анализа |
| Перманганатометрия | KMnO4 | Н2С2О4, Nа2С2О4 | – | Восстановители (Fe, Ti, Sn, Pb, Sr) |
| Иодометрия | Nа2S2О3, I2 | К2Сr2О7 | Крахмал | Окислители (Cu), восстановители (Sn, Sb, Hg, As) |
| Дихромато-метрия | К2Сr2О7 | – | Дифенил-амин | Восстановители (Fe, Sn, Mn, Cr,) |
| Броматометрия | КвrО3 | – | Метиловый оранжевый | Восстановители (Fe, Sn, Sb, As) |
Для установления точки эквивалентности применяется несколько способов:
 |
Окислительно-восстановительные (редокс) индикаторы – органические соединения, способные к окислению или восстановлению, причем окисленная и восстановленная формы имеют различную окраску, которая зависит от потенциала системы.
Характеристика важнейших редокс-индикаторов приведена в табл. 8.
Таблица 8
Окислительно-восстановительные индикаторы
| Индикатор |  , В
(при а Н =1) , В
(при а Н =1)
| Окраска | |
| Ох-формы | Red-формы | ||
| Ферроин | 1,06 | Голубая | Красная |
| Фенилантраниловая кислота | 1,02 | Красная | Бесцветная |
| Дипиридил | 0,97 | Голубая | Красная |
| Дифениламин | 0,76 | Фиолетовая | Бесцветная |
| Метиленовый синий | 0,53 | Голубая | Бесцветная |
| Нейтральный красный | 0,24 | Красная | Бесцветная |
Для сопряженной редокс-пары индикатора
Ind(Ox) + ne → Ind(Red)
по уравнению Нернста вычисляют потенциал индикаторной системы:
 ,
,
где  – стандартный потенциал индикатора, зависит от рН среды, ионной силы раствора.
– стандартный потенциал индикатора, зависит от рН среды, ионной силы раствора.
Интервал изменения окраски редокс-индикатора (∆Е) – интервал потенциалов, внутри которого индикатор изменяет окраску, за его пределами преобладает окраска окисленной или восстановленной форм; ∆Е рассчитывают по уравнению:
 .
.
Редокс-индикатор выбирают по кривой титрования.
Требования к редокс-индикаторам:
¨ окраска окисленной и восстановленной форм индикатора должна резко различаться и быть интенсивной;
¨ окраска индикатора должна изменяться в узком интервале потенциалов от одной избыточной капли окислителя или восстановителя;
¨ индикатор должен быть химически устойчив во внешней среде.
ПЕРМАНГАНАТОМЕТРИЯ
Метод основан на полуреакции восстановления перманганат-иона в кислой среде:
MnO4– + 8H+ + 5e → Mn2+ + 4Н2O.
Перманганат калия не является стандартным веществом (препарат содержит примеси MnO2). Готовят рабочий раствор КMnO4, выдерживают его в склянке из темного стекла в течение 7–10 сут, после чего отделяют раствор от осадка MnO2 (фильтрование). Хранят раствор в склянке из темного стекла с пришлифованной пробкой. Раствор стандартизируют по щавелевой кислоте или оксалату натрия.
Условия перманганатометрического титрования.
¨ Реакция восстановления перманганат-иона может протекать в любых условиях (табл. 9), но титрование проводят преимущественно в кислой среде.
Таблица 9
Влияние рН на реакцию восстановления перманганат-иона
| Реакция среды | Реакция титрования |  ,В ,В
| Мэкв (КMnO4), г/моль |
| рН < 7 | MnO4– + 8H+ + 5e→ Mn2+ + 4Н2O | 1,51 | М(1/5КMnO4)= 31,6 |
| 7 ≤ рН ≤ 9 | MnO4– + 2Н2O + 3e→ MnО2 + 4ОH– | 0,60 | М(1/3КMnO4)=52,7 |
| рН > 9 | MnO4– + e→ MnO42– | 0,56 | М(1/1КMnO4)=158 |
В кислой среде в реакции участвует редокс-пара MnO4–/Mn2+, стандартный потенциал которой имеет наибольшее значение, следовательно, скорость реакции в этих условиях максимальна. В кислой среде КMnO4 проявляет себя как более сильный окислитель, что расширяет ассортимент определяемых веществ. Кроме того, продукты восстановления перманганата калия в нейтральной и щелочной средах (аморфные осадки бурого цвета) затрудняют фиксирование точки эквивалентности.
¨ Безиндикаторное фиксирование точки эквивалентности: титрант КMnO4 имеет собственную фиолетовую окраску, которая исчезает при титровании (образуются бесцветные ионы Mn2+). В точке эквивалентности, когда весь восстановитель полностью окислен, избыточная капля титранта окрашивает титруемый раствор в розовый цвет. Чувствительность реакции соответствует концентрации перманганата калия 1·10–5 моль/дм3.
Перманганатометрия применяется для определения восстановителей (прямое титрование) и окислителей с предварительным восстановлением (обратное титрование).
Концентрация раствора перманганата калия при хранении изменяется вследствие окислительно-восстановительной реакции с водой, катализируемой диоксидом марганца на свету:
4MnO4– + 2Н2O → 4MnО2↓+ 3О2↑ + 4ОH–.
Титр раствора KMnO4 еженедельно устанавливают по стандартному раствору щавелевой кислоты.
Реакция между перманганатом калия и щавелевой кислотой автокаталитична (продукт реакции Mn2+ – катализатор), поэтому, несмотря на значительную разность стандартных потенциалов редокс-пар MnO4–/Mn2+ и СО2/С2О42– , для ускорения реакции раствор нагревают.
2КMnO4 + 5H2C2O4 + 3H2SO4 ® 2MnSO4 + K2SO4 + 10CO2 + 8H2O
 MnO4– + 8H+ + 5e → Mn2+ + 4Н2O 2
MnO4– + 8H+ + 5e → Mn2+ + 4Н2O 2
С2О42– – 2e → 2СО2 5
–––––––––––––––––––––––––––––––––––––––––––
2MnO4– +16H+ + 5С2О42– → 2Mn2+ + 8Н2O + 10СО2
Титрование проводят без индикатора. Для установления точки эквивалентности фиксируют момент, когда очередная капля титранта окрасит раствор в неисчезающий в течение 1–2 мин бледно-розовый цвет. В начале титрования титрант обесцвечивается медленно, затем, когда в растворе образуется большое количество Mn2+, обесцвечивание происходит практически мгновенно (Mn2+ – катализатор реакции окисления щавелевой кислоты).
ИОДОМЕТРИЯ
Метод основан на полуреакции:
I2 + 2e→ 2I¯ ( В).
В).
Реакция обратима, ее направление зависит от условий. Иод плохо растворим в воде, но в присутствии иодид-ионов образуется комплекс I3¯, поэтому при титровании протекает реакция:
I3¯ + 2e→ 3I¯ ( В).
В).
I2 – окислитель средней силы, I¯ – средней силы восстановитель, поэтому в иодометрии применяют окислительные свойства иода и восстановительные свойства иодидов. Иодометрия является универсальным методом и применяется для определения и восстановителей, и окислителей.
Условия иодометрического титрования.
¨ Титруют в нейтральной, кислой или слабощелочной средах; рН ≤ 9, так как в щелочной среде образуется гипоиодид:
I2 + 2ОН¯→ IO¯+ I¯ + Н2О.
Гипоиодид – сильный окислитель, окисление титранта приводит к завышенным результатам титрования. Поэтому анализируемый раствор подкисляют серной кислотой.
¨ Титрование проводят на холоде, так как I2 – летучее соединение; кроме того, при повышенной температуре понижается чувствительность индикатора.
¨ Реакция между определяемым веществом и иодидом калия протекает во времени, поэтому выделившийся в результате реакции иод титруют спустя 5–7 мин.
¨ Вследствие плохой растворимости I2 в воде при определении окислителей добавляют избыток КI. Выделившийся в результате реакции замещения иод хорошо растворяется в растворе КI. Кроме того, избыток иодида калия способствует ускорению реакции в требуемом направлении.
¨ Реакция замещения протекает в затемненном месте, без доступа воздуха, так как свет ускоряет окисление I¯ кислородом воздуха до I2, это приводит к завышенным результатам титрования.
¨ Высокая точность титрования обусловлена применением специфического чувствительного индикатора – крахмала; раствор крахмала должен быть свежеприготовленным.
Амилоза, входящая в состав крахмала, образует с иодом адсорбционно-комплексное соединение, окрашенное в синий цвет. Прочность комплекса зависит от концентрации иода в растворе: чем она выше, тем устойчивее комплекс.
Особенность применения крахмала как индикатора заключается в том, что его добавляют в конце титрования, когда концентрация иода в пробе мала, и раствор имеет соломенно-желтую окраску. В присутствии крахмала раствор приобретает синюю окраску, титрование продолжают до обесцвечивания раствора.
Если крахмал добавить в начале титрования, когда концентрация иода в растворе высока, образуется прочный комплекс, для разрушения которого требуется избыток титранта, при этом пробу перетитровывают.
Иодометрическое определение восстановителей выполняют методом прямого титрования. Титрант – раствор иода, который готовят растворением точной навески смеси I2 с КI (I2 + КI → КI3) в дистиллированной воде высокой степени очистки. Приготовленный раствор хранят в склянке из темного стекла во избежание окисления иодида и улетучивания иода.
Прямым иодометрическим титрованием определяют As3+, As5+ (после предварительного восстановления), Sn2+, Hg2+ и другие металлы.
Индикатор – крахмал, который добавляют в начале титрования, точку эквивалентности фиксируют по появлению синего окрашивания раствора от избыточной капли раствора иода.
Иодометрическое определение окислителей выполняют методом замещения по следующей схеме.
1. В колбу для титрования помещают избыток раствора КI, раствор подкисляют серной кислотой и добавляют анализируемый раствор окислителя.
Колбу с реакционной смесью накрывают часовым стеклом и помещают на 5 мин в затемненное место. При этом протекает реакция замещения, в результате образуется эквивалентное количество I2.
2. Окрашенный в бурый цвет раствор иода титруют раствором тиосульфата натрия; индикатор – крахмал, который добавляют в конце титрования.
Препарат Na2S2O3·5Н2О не относится к стандартным веществам, так как может не соответствовать своей химической формуле (кристаллизационная вода при хранении выветривается) и разрушаться ферментными тиобактериями. Кроме того, раствор тиосульфата натрия неустойчив при хранении, подвержен автоокислению. Поэтому готовят рабочий раствор, точную концентрацию которого устанавливают при титровании стандартного раствора дихромата калия.
Титр рабочего раствора тиосульфата натрия устанавливают методом замещения, так как прямое титрование невозможно вследствие нестехиометричности реакции тиосульфата натрия с дихроматом калия. Определение проводят в присутствии серной кислоты и избытка иодида калия. При этом известное количество К2Cr2O7 замещается на эквивалентное количество иода:
К2Cr2O7 + 6KI + 7H2SO4 → Cr2(SO4)3 + 3I2 + 4К2SO4 + 7Н2О.
 |
Cr2O72– + 14Н+ + 6е → 2Cr3+ + 7Н2О 1
2 I¯– 2е → I2 3
––––––––––––––––––––––––––––––––––––––––––
Cr2O72– + 14Н+ + 6I¯→ 2Cr3+ + 3I2 + 7Н2О.
Выделившийся в результате реакции иод оттитровывают раствором тиосульфата натрия:
I2 + 2Na2S2O3 → 2 NaI + Na2S4O6.
 I2 + 2e → 2I¯ 1
I2 + 2e → 2I¯ 1
2S2O32– – 2е → S4O62– 1
–––––––––––––––––––––––––––––-
I2 + 2S2O32– → 2I¯ + S4O62–.
Молярная концентрация эквивалента:
 ;
;
.
КОМПЛЕКСОМЕТРИЯ
Комплексометрия – титриметрический метод анализа, основанный на взаимодействии металлов с моно- или полидентатными лигандами с образованием комплексных соединений. Для решения аналитических задач в комплексометрии в качестве титрантов применяют, как правило, полидентатные органические реагенты, так как только при этом можно получить четкий скачок на кривой титрования и зафиксировать точку эквивалентности.
Метод титрования с применением полидентатных органических реагентов (комплексонов) называется комплексонометрией.
Начало применению комплексонов как аналитических реагентов положил швейцарский химик Г.Шварценбах (1945 г.). Комплексоны относятся к классу полиаминополикарбоновых кислот. Эти соединения называются "хелатоны" (США), "трилоны" (Германия), "комплексоны" (Россия).
Наибольшее распространение и применение в анализе среди комплексонов получили комплексон II (ЭДТУ) – этилендиаминтетрауксусная кислота
НООС –Н2С СН2 –СООН
 N–СН2 –СН2– N
N–СН2 –СН2– N
НООС –Н2С СН2 –СООН
и хорошо растворимая в воде двунатриевая соль этилендиаминтетрауксусной кислоты – комплексон III (ЭДТА)
 НООС–Н2С СН2 –СООNa
НООС–Н2С СН2 –СООNa
N–СН2–СН2– N
NaООС–Н2С СН2 –СООН
Лиганд комплексонов обычно обозначают Y (с соответствующим зарядом и степенью протонирования):
 Н6Y 2+ Н5Y + Н3Y – Н2Y 2– НY 3– Y 4–
Н6Y 2+ Н5Y + Н3Y – Н2Y 2– НY 3– Y 4–
рН: 0 1 2 3 – 6 6 –10 10–14
ЭДТУ (Н4Y) – белое кристаллическое вещество, малорастворимое в воде (2 г/дм3, 22 ОС), раствор бесцветен. Дигидрат Na2Н2Y ·2Н2О (ЭДТА) – белый кристаллический препарат, относительно хорошо растворим в воде (108 г/дм3, 22 ОС).
Особенности строения комплексонов:
¨ Наличие в молекулах комплексонов нескольких групп кислотного характера (–СООН), атомы водорода которых способны замещаться на металл. При этом образуется валентная связь.
¨ Присутствие двух атомов азота, имеющих неподеленную пару электронов и, следовательно, способных образовывать координационные связи с металлом.
¨ Шесть функциональных групп с донорными атомами азота и кислорода позволяют комплексонам реагировать со всеми металлами, кроме металлов со степенью окисления 1, образуя комплексные соединения – комплексонаты.
Реакция комплексообразования протекает мгновенно, практически необратима.

 НООС–Н2С СН2 –СООNa
НООС–Н2С СН2 –СООNa

 Мe3+ + N–СН2 –СН2– N →
Мe3+ + N–СН2 –СН2– N →
NaООС–Н2С СН2 –СООН

 ООС–Н2С СН2 –СОО
ООС–Н2С СН2 –СОО
→ N–СН2 –СН2– N +2Н+ +Na+
NaООС–Н2С СН2 –СОО
Мe
Свойства комплексонатов.
¨ Комплексонаты – прочные соединения, слабые электролиты. Их прочность обусловлена наличием в молекуле двух видов связи (валентной и координационной) и замкнутых циклов, разветвленных в пространстве. Состояние комплексонатов в растворе характеризуется константой устойчивости (β).
 МеY 2– Ме2+ + Н2Y 2–
МеY 2– Ме2+ + Н2Y 2–
β =
¨ Чем выше степень окисления металла, тем устойчивее комплексонат и, следовательно, выше константа устойчивости.
¨ Независимо от степени окисления металла, комплексонаты характеризуются одинаковым составом 1:1. Ступенчатое комплексообразование отсутствует. Поэтому эквиваленты металлов, как и комплексонов, равны 1.
¨ Комплексонаты хорошо растворимы в воде, растворы их бесцветны.
Условия комплексонометрического титрования.
1. Реакция комплексообразования сопровождается изменением рН вследствие накопления протонов:
 Ме2+ + Н2Y 2– МеY 2– + 2Н+.
Ме2+ + Н2Y 2– МеY 2– + 2Н+.
Изменение рН влияет на устойчивость комплексонатов: с увеличением рН устойчивость комплексонатов повышается. Поэтому Ме2+ определяют в щелочной или нейтральной среде, Ме3+ и Ме4+ – в кислой среде. При выборе условий титрования раствора соли определенного металла необходимо учитывать константу β, которая прямо зависит от рН.
Растворы, содержащие Mg2+, Са2+, Ва2+, титруют при рН = 9 – 10 в присутствии аммонийной буферной смеси.
| Ион | β | рН | Буферный раствор |
| Mg2+ | 109 | 9–10 | Аммонийный |
| Ca2+ | 1011 | ||
| Fe2+ | 1014 | 5–7 | |
| Zn2+ | 1016 | ||
| Sn2+ | 1018 | Ацетатный, фосфатный | |
| Cu2+ | 1019 | ||
| Fe3+ | 1024 | 2–3 | |
| Bi 3+ | 1027 | – | |
| Th4+ | 1025 | ||
| Zr4+ | 1030 |
Особенность комплексонометрического титрования состоит в том, что в одной пробе без предварительного разделения можно раздельно определять катионы различных металлов, варьируя условия с помощью буферных растворов. Несколько металлов в растворе можно определять при условии, если константы устойчивости их комплексонатов отличаются более, чем на четыре порядка (β1/ β2≥104). При этом для титрования раствора соли каждого катиона должен быть свой индикатор.
2. Фиксирование точки эквивалентности. Для визуального фиксирования точки эквивалентности в комплексонометрии применяются металлоиндикаторы – органические соединения, изменение окраски которых зависит от концентрации ионов металла в растворе. Металлоиндикаторы с ионами титруемого металла образуют окрашенные комплексы.
Требования к металлоиндикаторам.
¨ Индикатор должен образовывать достаточно устойчивый комплекс с ионами металла в соотношении Меn+ : Ind = 1:1.
¨ Комплексное соединение металла с индикатором должно быть менее прочным, чем комплексонат данного металла:
β (МеInd) << β(МеY2–).
¨ Комплекс МеInd должен быть кинетически подвижным и быстро разрушаться при действии комплексона III.
¨ Окраска комплекса МеInd должна отличаться от собственной окраски металлоиндикатора. Переход окраски должен быть контрастным.
Металлоиндикаторы, как правило, являются многоосновными кислотами и в зависимости от рН могут существовать в различных формах, окраска которых зависит от реакции среды. Интервал перехода окраски индикатора рассчитывают по уравнению:
∆pMe = lg β(МеInd) ± 1.
Наибольшее применение в анализе среди металлоиндикаторов получил эриохромовый черный Т. Он образует комплексные соединения с ионами Са2+, Mg2+, Zn2+, Pb2+ и другими красного или фиолетового цвета.
Индикатор в зависимости от рН изменяет форму и окраску:
 Н3Ind Н2Ind– Н Ind 2– Ind 3–
Н3Ind Н2Ind– Н Ind 2– Ind 3–
винно-красная синяя оранжевая
рН 0 – 6 6 –11 11–14
Механизм изменения окраски эриохромового черного Т в слабощелочной среде состоит в следующем.
¨ К анализируемой пробе, содержащей ионы определяемого металла, добавляют индикат