Строение молекулы бензола
Первое ароматическое соединение бензол – было открыто в 1825 г. М. Фарадеем. Была установлена его молекулярная формула – С6Н6. Если сравнить его состав с составом предельного углеводорода, содержащего такое же количество атомов углерода, — гексаном (С6Н14), то можно заметить, что бензол содержит на восемь атомов водорода меньше. Как известно, к уменьшению количества атомов водорода в молекуле углеводорода приводит появление кратных связей и циклов. В 1865 г. Ф. Кекуле предложил его структурную формулу как циклогексантриена – 1, 3, 5.


Таким образом, молекула, соответствующая формуле Кекуле, содержит двойные связи. В действительности углерод — углеродные связи в бензоле равноценны, и их свойства не похожи на свойства ни одинарных, ни двойных связей. В настоящее время бензол обозначают или формулой Кекуле, или шестиугольником, в котором изображают окружность. Сочетание шести сигма – связей с единой π–системой называется ароматической связью.
Атомы углерода находятся в состоянии sр2- гибридизации. Выяснено, что все С—С связи в бензоле имеют одинаковую длину (0,139 нм). Они несколько короче одинарных С—С связей (0,154 нм) и длиннее двойных (0,132 нм). Валентный угол – 1200
Гомологи бензола
Состав их молекул отвечает формуле СnH2n-6. Ближайшие гомологи бензола:
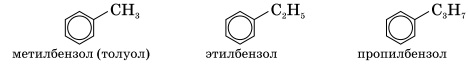
Все следующие за толуолом гомологи бензола имеют изомеры. Изомерия может быть связана как с числом и строением заместителя (1, 2), так и с положением заместителя в бензольном кольце (2, 3, 4). Соединения общей формулы С8Н10:
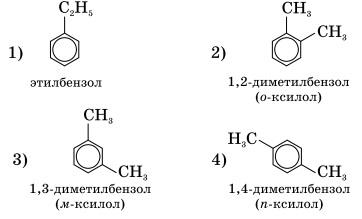
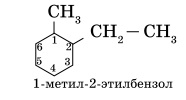 Основой названия ароматического углеводорода с небольшими заместителями является слово бензол. Атомы в ароматическом кольце нумеруют, начиная от старшего заместителя к младшему:
Основой названия ароматического углеводорода с небольшими заместителями является слово бензол. Атомы в ароматическом кольце нумеруют, начиная от старшего заместителя к младшему:
По старой номенклатуре, употребляемой для указания относительного расположения двух одинаковых или разных заместителей в бензольном кольце, используют приставки орто — (сокращенно о-) – заместители расположены у соседних атомов углерода, мета- (м -) – через один атом углерода и пара — (п -) – заместители друг против друга.
Первые члены гомологического ряда бензола – жидкости со специфическим запахом. Они легче воды. Являются хорошими растворителями.
Физические свойства
Бензол и его простейшие гомологи в обычных условиях весьма токсичные жидкости с характерным неприятным запахом. Они плохо растворяются в воде, но хорошо — в органических растворителях.
Основные способы получения ароматических:
1) Из ацетилена (тримеризация).
а) В 1851 г. Французский химик Бертло при нагревании С2 Н2 до 600 °С получил бензол.
600°С
3С2Н2 → (С6Н6)
б) В 1927 г. Н.Д.Зелинский и Б.А.Казанский получили бензол на активированном угле:
t,C
3С2Н2 → С6Н6 (с очень большим выходом).
2) а) Н.Д.Зелинский получил бензол из циклогексана:
Pt, t°
С6Н12 → (С6Н6) (реакция дегидрирования)
-3H2
б) соответственно, из метилциклогексана (при этих же условиях) можно получить метилбензол (или толуол):
Pt, t°
С6Н11 – СН3 → (С6Н5 – СН3)
-3H2
3) При этих же условиях н-гексан → в бензол (дегидроциклизация)
Pt,t°
С6Н14 → С6Н6 +4Н2↑
4) Алкилирование (реакция Фриделя-Крафтса):
t° кат.
С6Н6 + Cl-СН3 → С6Н5 – СН3 + НСl
Хлорметан толуол (метилбензол)
Химические свойства бензола
1. Реакции замещения. Ароматические углеводороды вступают в реакции замещения.
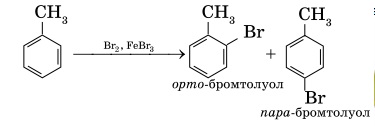
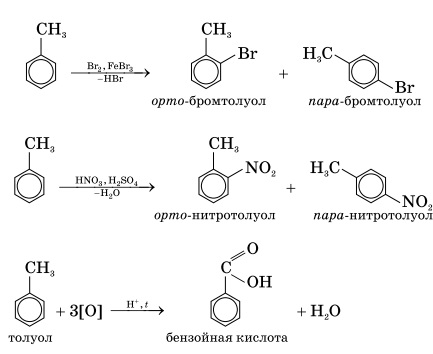
1. Бромирование. При реакции с бромом в присутствии катализатора, бромида железа (ΙΙΙ), один из атомов водорода в бензольном кольце может замещаться на атом брома:
2. Нитрирование бензола и его гомологов. При взаимодействии ароматического углеводорода с азотной кислотой в присутствии серной (смесь серной и азотной кислот называют нитрующей смесью) происходит замещение атома водорода на нитрогруппу —NO2:

Восстановлением образовавшегося в этой реакции нитробензола получают анилин — вещество, которое применяется для получения анилиновых красителей:
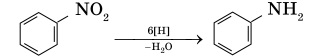
Эта реакция носит имя русского химика Зинина.
2. Реакции присоединения. Ароматические соединения могут вступать и в реакции присоединения к бензольному кольцу. При этом образуются циклогексан или его производные.
1. Гидрирование. Каталитическое гидрирование бензола протекает при более высокой температуре, чем гидрирование алкенов:
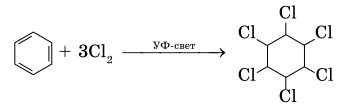
2. Хлорирование. Реакция идет при освещении ультрафиолетовым светом и является свободнорадикальной:
Гомологи бензола вступают в реакции замещения ( бромирование, нитрирование). Толуол окисляется перманганатом при нагревании:
Применение
Бензол и его гомологи бензола используются как растворители, для получения красителей, средств для защиты растений, пластмасс, лекарств.
ДОМАШНЕЕ ЗАДАНИЕ
Ответьте на вопросы (письменно):
1) Какова общая формула гомологического ряда аренов?
2) Какова молекулярная формула бензола?
3) Имеет ли молекула бензола кратные связи, подобные двойным связям в молекулах алкенов?
4) Как можно отличить бензол и гексен?
5) В каком состоянии гибридизации находятся атомы углерода в молекуле бензола?
6) Чему равен валентный угол в молекуле бензола?
7) Каково современное изображение молекулы бензола?
8) Что такое ароматическая связь? Объясните механизм её образования.
2. Учебник 10 кл.: §15,16, стр.70, тесты,

стр.75, № 3, 5.

УРОК № 96, 97
Тема: Природные источники углеводородов
Смотреть по ссылке: https://www.youtube.com/watch?v=KGIQXMZjY20
Природные газы – смеси газообразных углеводородов различного строения, заполняющие поры и пустоты горных пород, рассеянные в почвах, растворенные в нефти и пластовых водах. Попутные нефтяные газы – смеси углеводородов, сопутствующие нефти и выделяющиеся при ее добыче на газонефтяных месторождениях. Эти газы растворены в нефти и выделяются из нее вследствие снижения давления при подъеме нефти на поверхность Земли. Состав природных нефтяных газов разных месторождений различен. Основные месторождения природных газов расположены в Северной и Западной Сибири, Волго-Уральском бассейне, на Северном Кавказе, в Астраханской области, Баренцевом море.
Каменный уголь – сложная смесь высокомолекулярных соединений, в состав которых входят углерод, водород, азот, кислород, сера. Основные каменноугольные бассейны: Подмосковный, Южно-Якутский, Кузбасс, Донбасс, Печорский, Тунгусский, Ленский (карта России). При коксовании угля протекают физико-химические процессы, сопровождающиеся поглощением энергии. При этом происходит разложение высокомолекулярных соединений с образованием летучих веществ и твердого остатка кокса.
Нефть – богатство мира. Она играет огромную роль, как в политике государств, так и в их экономике. Сегодня нефть – основной источник энергии. Жидкое топливо наиболее удобно: оно высококалорийно, легко транспортируется, содержит мало примесей. Нефть – сложная смесь углеводородов различной молекулярной массы. Содержание парафинов, циклопарафинов и аренов в нефти разных месторождений различно. Всего нефть содержит более 100 различных соединений. Основные месторождения нефти расположены в Западной Сибири (здесь добывают 50% всей нефти) (карта), Республике Коми, Башкортостане, Самарской и Саратовской областях, на Северном Кавказе.