Пример 3. Массовая доля серы и кислорода в оксиде серы равны соответственно 40% и 60%. Определите простейшую формулу оксида.
Решение:
Для расчета выбираем массу оксида 100г., т.е. (оксида)=100г.
Тогда масса серы и кислорода будет равна:
m(S)=m(оксида) х w(S);
m(S)=100x0,4=40г.
m(O)= m (оксида) х w(О);
m (O)= 100 x 0,6=60 г.
 ;
;
n(S)=40:32 – 1,25 моль.
 ;
;
n (O)=60:16 – 3,75моль.
Находим соотношение количества вещества серы и кислорода:
n(S):n(O)=1:3, т.е. простейшая формула соединения SO3.
ЗАДАЧА № 5.
 В состав химического соединения входят кальций, углерод и кислород. Массовые доли элементов составляют (%): кальций–40, углерод –12, кислород-48. Определите простейшую формулу соединения.
В состав химического соединения входят кальций, углерод и кислород. Массовые доли элементов составляют (%): кальций–40, углерод –12, кислород-48. Определите простейшую формулу соединения.
 Дано: Решение:
Дано: Решение:
ЗАДАЧА № 6.
Определите простейшую формулу соединения калия с марганцем и кислородом, если массовая доля элементов в этом веществе составляет соответственно 24,7%, 34,8%, 40,5%.
 Дано: Решение:
Дано: Решение:

ЗАДАНИЕ № 3.
Расчет по химическим уравнениям
Теоретические основы:
Расчеты по химическим уравнениям (стехоометрические расчеты) основаны на законе сохранения массы вещества. Однако в реальных химических процессах из – за неполного протекания реакции и различных потерь веществ масса образующихся продуктов часто бывает меньше той, которая должна образовываться в соответствии с законом сохранения массы вещества.
Выход продукции реакции (или массовая доля выхода) – это выражение в процентах отношения массы реального полученного продукта к его массе, которая должна образовываться в соответствии с теоретическим расчетом: т.е.
 , где
, где
h – выход продукта,%.
mp(x) – масса продукта Х, полученного в реальном процессе.
m(x)-рассчитанная масса вещества.
Пример 4. Железо может быть получено восстановлением оксида железа (III) алюминием. Какую массу алюминия и оксида железа (III) надо взять для получения железа массой 140г?
Решение 1.
Записываем уравнение реакции:
Fe2O3 + 2AL = 2Fe + AL2O3,
определяем количество железа, которое надо получить:
 ;
;
n(Fe)=140: 56=2,5 моль.
Из уравнения следует, что для получения железа количеством вещества 2 моль требуется 1 моль Fe2O3 и 2 моль алюминия, т.е.
 ;
;  .
.
Отсюда получаем:
n(AL)=n(Fe) и n(AL)=2,5 моль
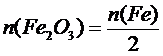 и
и  .
.
Определяем необходимые массы алюминия и оксида железа (III):
m(AL) = n(AL) x M(AL); m(AL)=2,5x27=67,5г.
m (Fe2O3)=n(Fe2O3) x M(Fe2O3); m(Fe2O3)=1,25 x 160=200г.
Задачу можно решать также методом составления пропорции.
Решение 2.
Из уравнения реакции следует, что для получения железа количеством вещества 2 моль требуется 2 моль алюминия.
Записываем: для получения 112 г Fe требуется 54 г AL.
140 г Fe требуется m (AL).
Составляем пропорцию: 112:54=140:m(AL).
Отсюда находим: m(AL)=140 х 54:112=67,5г.
Из уравнения реакции следует, что для получения железа количеством вещества 2моль требуется 1моль оксида железа (ІІІ).
Записываем: для получения 2·56=112г. Fe требуется 1·160=160г. Fe2O3
140г.Fe ------------------------- m(Fe2O3)
Составляем пропорцию:
112:160=140:m(Fe2O3), откуда
m(Fe2O3)=140·160:112=200г.
ЗАДАЧА № 7
Какую массу фосфора надо сжечь для получения оксида фосфора (V) массой 7,1 г.
 Дано: Решение:
Дано: Решение:

(Ответ: 3,1г)
ЗАДАЧА № 8
Какая масса сульфата бария образуется при взаимодействии раствора, содержащего хлорид бария массой 62,4 с избытком серной кислоты.
 Дано: Решение:
Дано: Решение:

(Ответ: 69,9г)
Пример 5. Какой объем водорода выделяется при (н.у.), если растворить алюминий массой 10,8г. в избытке соляной кислоты?
 Дано: Решение:
Дано: Решение:
m(Al)=10,8г. Записываем уравнение реакции взаимодействия алюминия с
M(Al)=27г/моль соляной кислоты:
 Найти V(H2) -? 2Al+6HCl=2AlCl+3H2↑
Найти V(H2) -? 2Al+6HCl=2AlCl+3H2↑
Определяем количество вещества алюминия, вступающего в реакцию:
n(AL)=  ; n(AL)=10,8:27=0,4м.
; n(AL)=10,8:27=0,4м.
Из уравнения реакции следует, что при растворении 2моль алюминия образуется 3моль водорода (Н2).
Следовательно:  , отсюда следует: n(Н2)=
, отсюда следует: n(Н2)=  .
.
n(Н2)=3·0,4:2=0,6моль.
Рассчитываем объем водорода при нормальных условиях:
VH(H2)=Vm·n(H2); VH(H2)=22,4·0,6=13,44л.
ЗАДАЧА № 9
Какой объем алюминия измеренный при нормальных условиях, должен прореагировать с избытком хлороводорода, для получения хлорида аммония массой 10,7г?
 Дано: Решение:
Дано: Решение:

(Ответ: 4,48л)
ПОСЛЕ ВЫПОЛНЕНИЯ ПРАКТИЧЕСКОЙ РАБОТЫСТУДЕНТ ДОЛЖЕН:
ЗНАТЬ:
Ø Массовую долю вещества, формулу по которой она определяется.
Ø Выход продуктов реакции и формулу его определения.
УМЕТЬ:
Ø Производить вычисления по формуле массой доли вещества, по химическим уравнениям, решать задачи на вывод формулы соединения.
 |