ПРОСТЫЕ ЭФИРЫ,
Простые эфиры являются производными спиртов, енолов и фенолов, в которых атом водорода гидроксильной группы замещен углеводородным остатком.
Простые эфиры подразделяют на соединения алифатического, ароматического и смешанного рядов.
Для названия простых эфиров используется радикально-функциональная номенклатура, согласно которой название образуют из названий радикалов следующих в алфавитном порядке и слова эфир, например, диметиловый эфир С2Н5 – О – С2Н5; винилметиловый эфир СН3 – О – СН=СН2; диизопропиловый эфир (СН3)2СН – О – СН(СН3)2.
Более сложные по составу простые эфиры называют по правилам заместительной номенклатуры, в соответствии с которой к названию более старшего углеводорода добавляют название радикала R – O – в качестве приставки, например, СН3СН2 - О – С6Н5 этоксибензол. Полиэфиры линейной структуры называют по заместительной номенклатуре, например, 1,2-диметоксиэтан (глим) СН3 – О – СН2СН2 – О – СН3.
|
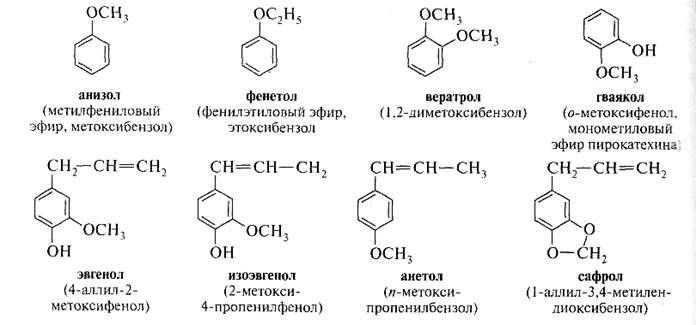
Правила номенклатуры IUPAC сохраняют некоторые тривиальные названия эфиров
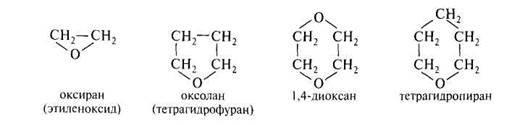
Циклические простые эфиры называют как гетероциклические соединения. Насыщенные кислородсодержащие гетероциклы называют: оксиран (трехчленный), оксолан (пятичленный), диоксан (шестичленный с двумя атомами кислорода). Оксолан чаще называют тетрагидрофураном как производное ненасыщенного аналога – фурана.
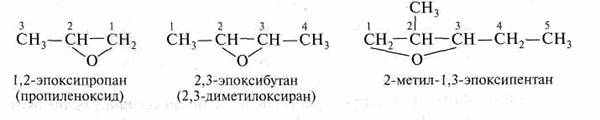
|
Для оксирана прочно сохраняется название этиленоксид. Оксираны часто называют эпоксидами, хотя префикс эпокси- означает атом кислорода, связанный с двумя любыми атомами углерода в циклической системе, и не обязательно соседними.
Физические свойства.
Простые эфиры, как правило, представляют собой бесцветные жидкости со своеобразным запахом и довольно низкими температурами кипения. Только диариловые эфиры являются твердыми веществами. Простые эфиры легче воды и плохо в ней растворимы. Простые эфиры фенолов имеют своеобразный цветочный запах и используются в парфюмерии. Наиболее важными в этом отношении являются анизол и фенетол, которые, кроме того, применяются в синтезе лекарственных препаратов и красителей.
Способы получения.
Простые эфиры могут быть получены из галогенопроизводных, спиртов, фенолов.
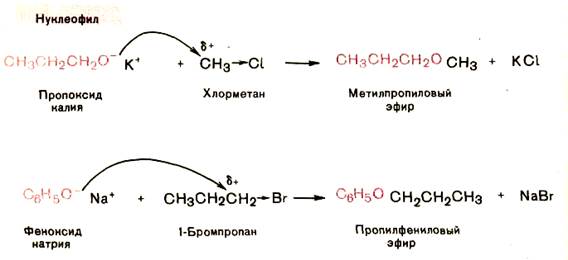
1. Получение из галогенопроизводных (синтез Вильямсона). Реакция протекает по механизму SN2, поэтому хороший выход достигается лишь в случае первичных алкилирующих реагкнтов, в качестве которых могут выступать алкилгалогениды, алкилсульфаты и алкилсульфонаты.
|
2. Дегидратация спиртов. Превращение первичных спиртов под действием минеральных кислот – старейший и до настоящего времени важнейший способ образования симметричных простых эфиров. Однако этот способ мало пригоден для синтеза смешанных алифатических эфиров и не годится для получения ароматических эфиров.
Н2SO4
 2 СН3СН2СН2-ОН СН3СН2СН2 - О – СН2СН2СН3
2 СН3СН2СН2-ОН СН3СН2СН2 - О – СН2СН2СН3
Пропанол-1 дипропиловый эфир
(1-пропоксипропан)
Вторичные и третичные спирты в этих условиях превращаются не в простые эфиры, а в алкены. Третичные спирты дают хорошие выходы смешанных эфиров в реакциях с первичными спиртами. В случае диолов реакция дегидратации может протекать как межмолекулярно, так и внутримолекулярно с образованием циклических эфиров.
- Присоединение спиртов и фенолов к непредельным соединениям.
BF3, t, p
 (СН3)2С=СН2 + СН3ОН (СН3)3С – О – СН3 + Н2О
(СН3)2С=СН2 + СН3ОН (СН3)3С – О – СН3 + Н2О
2-метилпропен трет- бутилметиловый
эфир
Фенолы присоединяются труднее спиртов вследствие их более низкой нуклеофильности. К ацетилену спирты и фенолы присоединяются в достаточно жестких условиях, образуя виниловые и винилфениловые эфиры.
Химические свойства.
|
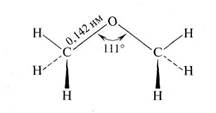
Благодаря более ЭО атому кислорода по сравнению с атомом углерода связь С – О полярна. Полярность этой связи, ее длина, энергия и угол между связями С – О – С различны в зависимости от вида гибридизации связанных атомов кислорода и углерода. В диметиловом эфире угол близок к тетраэдрическому:
Среднее значение энергии связей С – О в эфирах и С – С в алканах близко между собой, к тому же связь С – О несколько короче связи С – С (0,142 и 0,154 нм соответственно). Приведенные данные свидетельствуют о том, что все связи в простых эфирах являются довольно прочными и для их расщепления требуются жесткие условия. В алкилариловых и диариловых эфирах наблюдается взаимодействие свободной пары электронов кислорода с π-электронами бензольного кольца, что также приводит к упрочению связей С – О.
|
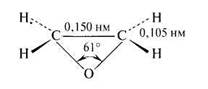
Эпоксидный цикл представляет собой почти правильный треугольник со значительно деформированными валентными углами (~ 60°С). Как и циклопропан, этиленоксид представляет напряженный цикл, в котором происходит только частичное перекрывание атомных орбиталей:
|
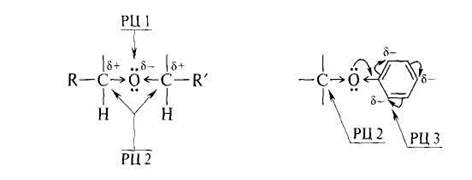
Исходя из электронного характера связей в простых эфирах и влияния на их состояние радикалов, следует ожидать следующих направлений их химических превращений:
РЦ 1 – нуклеофильный реакционный центр. Поскольку атом кислорода обладает высокой ЭО и низкой поляризуемостью, следует ожидать, что простые эфиры будут проявлять слабые п -основные свойства, как основания Бренстеда, и жесткие, как основания Льюиса.
РЦ 2 – электрофильные центры. Под влиянием ЭО атома кислорода повышается электрофильность α-углеродного атома, и, следовательно, следует ожидать, что простые эфиры будут проявлять склонность к реакциям с нуклеофильными реагентами. При этом в диалкиловых эфирах, содержащих различные радикалы, нуклеофильной атаке будет подвергаться преимущественно более электронодефицитный и пространственно незатрудненный атом углерода.
РЦ 3 – электрофильные центры ароматического кольца – его орто- и пара- положения. В алкилариловых эфирах нуклеофильная атака должна быть преимущественно направлена на α-атом углерода алкильного радикала; электрофильная – на орто- и пара- положения арильного радикала.
Простые эфиры – нейтральные и малоактивные соединения. Эфирная связь очень устойчива к действию оснований, окислителей и восстановителей, поэтому эфиры часто используют в качестве инертных растворителей.
1. Основные свойства.
В ряду кислородсодержащих соединений простые эфиры являются более сильными основаниями, чем спирты за счет суммарного +I-эффекта алкильных заместителей, связанных с атомом кислорода. Ввиду слабых нуклеофильных свойств атома кислорода простые эфиры являются слабыми n-основаниями Брёнстеда и, отсюда, способны образовывать оксониевые соли в безводной среде только с сильными кислотами Брёнстеда и взаимодействовать с жесткими кислотами (по Пирсону). Простые эфиры растворяются в холодной концентрированной серной кислоте с образованием солей оксония, что используется для отделения их от алканов и галогеноалканов:
С2Н5 – Ö – С2Н5 + H2SO4 ⇄ [C2H5 – OH – C2H5]+ HSO4-
диэтиловый эфир диэтилоксонийгидросульфат
Менее основными, чем диалкиловые эфиры, являются алкилариловые эфиры, у которых за счет сопряжения р-орбиталей sp2-гибридизованного атома кислорода с р-орбиталями ароматического кольца понижена электронная плотность в основном центре. Поэтому алкилариловые эфиры протонируются только в концентрированных растворах сильных кислот. Диариловые эфиры вследствие р, π-сопряжения атома кислорода с двумя ароматическими кольцами основных свойств не проявляют.
Расщепление галогеноводородами.
Реакция расщепления простых эфиров под действием кислот является реакцией ацидолиза. В эту реакцию вступают простые эфиры, обладающие заметными основными свойствами – циклические, диалкиловые, алкилариловые. Для расщепления связи С – О используют сильные протонные минеральные кислоты (HBr, HI). В диалкиловых эфирах нуклеофильной атаке преимущественно подвергается наименее стерически затрудненный радикал с образованием галогеноалкана и спирта.
HI, кипячение
 СН3 – О – СН2СН2СН3 СН3I + СН3СН2СН2ОН
СН3 – О – СН2СН2СН3 СН3I + СН3СН2СН2ОН
Расщепление происходит по правилу Цейзеля: галоген уходит с наименьшим радикалом. Исключение составляют эфиры с аллильными и третичными радикалами. В этом случае правило Цейзеля не соблюдается, реакция идет с образованием первичного спирта:
t0
 СН3 – О – СН2-СН=СН2 + HI СН3ОН + СН2=СН-СН2I
СН3 – О – СН2-СН=СН2 + HI СН3ОН + СН2=СН-СН2I
В алкилариловых эфирах под действием галогеноводородных кислот всегда разрывается связь O – Alk с образованием галогеноалкана и фенола:
HI, 1000C
 Ar – O – CH3 Ar-OH + CH3I
Ar – O – CH3 Ar-OH + CH3I
Диариловые эфиры, как не обладающие заметными основными свойствами, галогеноводородными кислотами не расщепляются.
Окисление.
Диалкиловые эфиры под действием кислорода воздуха или других окислителей легко вступают в реакцию автоокисления с образованием гидропероксидов, пероксидов, представляющих собой сильнейшие взрывчатые вещества. Поэтому при работе с простыми эфирами их необходимо проверять на присутствие пероксидов (выделение йода из раствора йодида калия при взбалтывании его с пробой эфира). Из эфиров пероксиды удаляют, обрабатывая их раствором солей железа (II) или олова (II).
- Реакции электрофильного замещения (SE) в
Ароматических эфирах.
В алкилариловых эфирах алкоксидная группа проявляет ЭД свойства. При этом повышается электронная плотность в орто- и пара-положениях ароматического кольца (ориентант I рода) и облегчается протекание реакций SE с преимущественным образованием пара- изомеров.
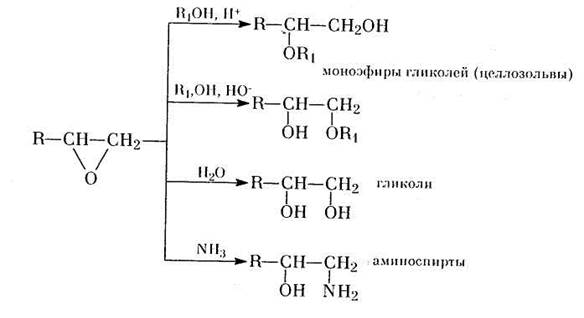
Эпоксиды (оксираны).
Эпоксиды являются бесцветными газами или жидкостями со слабым запахом.Эпоксидный цикл представляет собой почти правильный треугольник со значительно деформированными валентными углами (~ 60°С), что приводит к уменьшению энергии, а, следовательно, и прочности связей. Поэтому связь С – О в эпоксидах легко разрывается под действием различных нуклеофильных реагентов.
По направлениям химических превращений эпоксидные сходны с простыми эфирами, только все их реакции протекают с большими скоростями. Связь С – О разрывается легко, особенно в условиях кислотного катализа. Циклические эфиры обладают заметно большей основностью, чем простые ациклические эфиры. В отсутствии кислотного катализа реакции со слабыми нуклеофилами проходят при повышенной температуре и под давлением.
|