Длиной связи следует считать равновесное межъядерное расстояние, относительно которого колеблется ядерный остов химического соединения. Ориентировочно длину связи можно оценить, исходя из атомных или ионных радиусов, с учетом разностей электроотрицательностей взаимодействующих элементов. Расчет длин гетероядерных связей («межатомного» расстояния d Э1Э2) можно проводить по эмпирическому уравнению Шомэкера-Стивенсона
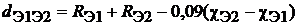 , (16)
, (16)
где R Э1 и R Э2 - радиусы для одинарных связей (Å). Для преимущественно ковалентных связей, образующих ковалентные молекулярные соединения, используются ковалентные радиусы; для преимущественно ионных связей – ионные радиусы, а для преимущественно металлических связей – металлические радиусы.
Формула (16) может быть использована и для определения длин гомоядерных связей, так как последний член в этом уравнении равен нулю при D Х = 0. В результате длина гомоядерной связи будет определяться по следующей формуле:
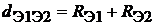 . (17)
. (17)
Существуют и другие формулы для оценки межъядерного расстояния с учетом разностей электроотрицательностей. Так, Ганик предлагает формулу:
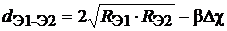 , (18)
, (18)
где R Э1 и R Э2 – соответствующие радиусы элементов (Å), b – коэффициент (равный 0,053 для одинарных и 0,03 для двойных связей). Аналогично, формула (18) может быть использована для определения длин гомоядерных связей, в которой в этом случае ликвидируется последний член, так как D Х = 0.
Энергия связи равна энергии, которую необходимо затратить для разрушения связи (либо, наоборот, она характеризуется энергией, выделяющейся при образовании связи). Таким образом, энергия связи является мерой её прочности.
Энергию одинарных гомоядерных преимущественно ковалентных связей в молекулярных соединениях можно оценить исходя из их длины. Опыт анализа ряда гомосвязей показал, что равновесная энергия одинарной гомоядерной связи (Е, кДж/моль) в них находится в достаточно простой линейной зависимости от её длины (d, Å) в виде следующего приближенного уравнения
E = 4,18×(-38 d + 136). (19)
В свою очередь длину ковалентной связи можно получить, сложив ковалентные радиусы образующих её элементов.
|
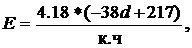 |
Энергию одинарных гомоядерных преимущественно металлических связей, образующих металлы, можно рассчитать из следующего уравнения
где к. ч. – координационное число соответствующего металла.
В этом случае длину металлической связи можно получить, сложив металлические радиусы образующих её элементов.
Значения энергии одинарных гетероядерных связей (кДж/моль) можно приближенно оценить по формуле Полинга, зная соответствующие значения энергии гомоядерных связей и электроотрицательностей:
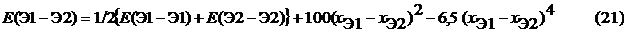
Значения необходимых для расчетов характеристик даны в приложениях 2 и 4.
3. Межмолекулярное взаимодействие и методы его оценки
Между молекулами независимо от их размера и строения действуют силы притяжения; их называют ван-дер-ваальсовыми (ВДВ) или межмолекулярными силами. Природа действующих между молекулами сил определяется строением взаимодействующих молекул. Выделяют три основных типа межмолекулярного взаимодействия:
1. Неполярные взаимодействия (силы Лондона, дисперсионные силы), которые обусловлены синхронным возникновением и изменением мгновенных диполей в атомах и молекулах при движении их электронов. Неполярные взаимодействия широко распространены, они имеют наибольшее значение из всех трех видов межмолекулярного взаимодействия и проявляются между любыми молекулами. Возникновение их тесно связано с непрерывным движением, в котором находятся внутренние составные части молекул – атомные ядра и электроны, и вызвано поляризацией атомов и молекул.
2. Взаимодействия наведенных диполей (силы Дебая, индукционные силы), связанные с образованием наведенного диполя у одной молекулы постоянным диполем другой молекулы. При взаимодействии полярной молекулы с постоянным дипольным моментом и неполярной молекулы всегда происходит некоторое смещение электронов и ядер у неполярной молекулы под действием близкорасположенного полюса полярной молекулы. Вследствие этого в неполярной молекуле возникает индуцированный дипольный момент и индуцированное взаимодействие.
3. Ориентационные взаимодействия (силы Кизома, дипольные, электростатические), которые проявляются между постоянными диполями. Электроотрицательность и размер атомов элементов (ван-дер-ваальсовый радиус), а также межатомные расстояния между ними определяют полярность химической связи, выражаемую дипольным моментом.
Как правило, электронное ВДВ притяжение между молекулами возрастает с увеличением числа электронов в молекуле. А поскольку их молекулярная масса примерно пропорциональна числу электронов в молекуле (обычно вдвое превышает число электронов), ВДВ притяжение, как правило, возрастает с её увеличением.
Энергию притяжения (ЭП) между молекулами можно расссчитать по следующему уравнению, предложенному Лондоном:
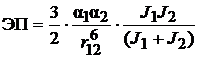 , (22)
, (22)
где J 1 и J 2 - энергия возбуждения молекул; α1 и α2 - поляризуемость двух взаимодейстующих молекул; r - расстояние между молекулами принято равным 3.0  .
.
Примечание. Данная формула обычно приводится со знаком «-», который был нами опущен с целью упрощения расчетов.
Уравнение Лондона позволяет получить средние по точности значения энергии и силы ВДВ притяжения, когда энергия возбуждения берется приблизительно на 60 % больше, чем первая энергия ионизации молекулы. Таким образом, формула Лондона принимает следующий вид:
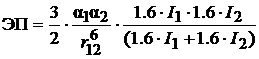 , (23)
, (23)
где r - расстояние между молекулами принято равным 3.0 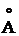 ; I 1 и I 2 - энергия ионизации молекул; α1 и α2 - поляризуемость двух взаимодейстующих молекул.
; I 1 и I 2 - энергия ионизации молекул; α1 и α2 - поляризуемость двух взаимодейстующих молекул.
Полную ВДВ энергию можно также получить путем расчета и последующего сложения дисперсионной (ED), ориентационной (EC) и индукционной (EI) энергий по следующим формулам:
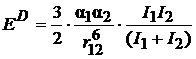 , (24)
, (24)
где r - расстояние между молекулами принято равным 3.0 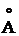 ; I 1 и I 2 - энергия ионизации молекул; α1 и α2 - поляризуемость двух взаимодейстующих молекул.
; I 1 и I 2 - энергия ионизации молекул; α1 и α2 - поляризуемость двух взаимодейстующих молекул.
 , (25)
, (25)
где μ1 и μ2 – дипольные моменты молекул; k - постоянная Больцмана; Т - абсолютная температура (при нормальных условиях Т » 298 ˚К); r - расстояние между молекулами, которое у нас условно равно 3.0 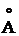 .
.
 , (26)
, (26)
где r - расстояние между молекулами принято равным 3.0 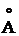 ; μ – постоянный дипольный момент полярной молекулы; α - поляризуемость неполярной молекулы.
; μ – постоянный дипольный момент полярной молекулы; α - поляризуемость неполярной молекулы.
Значения необходимых для расчетов характеристик даны в приложении 5.