| Химические реакции, протекающие с изменением степеней окисления атомов нескольких элементов реагирующих веществ, называются окислительно-восстановительными. Степень окисления (окислительное число) – это условный заряд атома в соединении, вычисляемый из допущения, что все связи в этом соединении являются ионными, и равный числу электронов, смещенных от атома данного элемента (положительная степень окисления) или к атому данного элемента (отрицательная степень окисления). +1 +7 –2 +1 +6 –2 –3 +1 +1 +6 –2 K Mn O4 , H2 S O4, N H3, K2 Cr2 O7 Восстановители – атомы, молекулы или ионы, отдающие электроны; процесс отдачи электронов называется окислением. Процесс окисления сопровождается увеличением степени окисления соответствующих элементов, входящих в состав восстановителя: о Al – 3 ē = Al3+ Окислители – атомы, молекулы или ионы, принимающие электроны; процесс присоединения электронов называется восстановлением. Процесс восстановления сопровождается понижением степени окисления элементов, входящих в состав окислителя: о_ Cl2 + 2 ē = 2 Cl Соединения, в состав которых входят атомы элементов в своей максимальной положительной степени окисления, могут только восстанавливаться, выступая в качестве окислителей: +6 +4 +5 K2Cr2O7, PbO2, HNO3 Соединения, содержащие элементы в их минимальной степени окисления, могут только окисляться, выполняя функцию восстановителей: –2 –3 H2S, NH3 |
| Классификация окислительно-восстановительных реакций 1) межмолекулярные – реакции, в ходе которых окислитель и восстановитель находятся в разных веществах; 2) внутримолекулярные – реакции, в ходе которых и окислитель и восстановитель (атомы разных элементов) находятся в составе одного вещества; 3) диспропорционирования (самоокисления-самовосстановления) – реакции, в ходе которых атомы одного и того же элемента, находящиеся в составе одного вещества, являются и окислителем (понижают степень окисления) и восстановителем (повышают степень окисления) |
| Правила определения степени окисления атомов в свободном состоянии и в химических соединениях: 1) степень окисления атомов в молекулах простых веществ равна нулю (F2, O2, O3, Al, Cl2); 2) алгебраическая сумма степеней окисления атомов в молекулах равна нулю, то есть молекула электронейтральна; 3) алгебраическая сумма степеней окисления атомов в ионах равна электрическому заряду данного иона; 4) металлы в своих соединениях проявляют только положительные степени окисления; 5) постоянную степень окисления в соединениях проявляют: металлы главной подгруппы 1 группы периодической системы элементов имеют степень окисления, равную плюс одному(+1); металлы главной подгруппы 2 группы (включая кадмий и цинк из побочной подгруппы) имеют степень окисления, равную плюс двум (+2); алюминий имеет степень окисления, равную плюс трем (+3); фтор в соединениях имеет степень окисления, равную минус одному (–1); водород в большинстве соединений имеет степень окисления, равную плюс одному (+1); исключение составляют гидриды металлов (CaH2, КН), где степень окисления водорода равна минус одному (–1); кислород в большинстве соединений имеет степень окисления, равную минусдвум (–2); исключения составляют: пероксиды (H2O2, Na2O2) – здесь кислород имеет степень окисления, равную минус одному (–1); фторид кислорода (OF2) – здесь степень окисления кислорода плюс два (+2); дифторид кислорода (O2F2) – степень окисления кислорода– плюс один (+1) |
Составление окислительно-восстановительных реакций
Существует несколько способов составления уравнений окислительно-восстановительных реакций. Наиболее распространенными являются метод электронного баланса и ионно-электронный метод.
Метод электронного баланса
Метод электронного баланса основан на сравнении степеней окисления атомов в исходных веществах и продуктах реакции и предусматривает соблюдение правила: число электронов, отданных восстановителями, равно числу электронов, принятых окислителями.
Сущность метода электронного баланса рассмотрим на примере составления уравнения окислительно-восстановительной реакции.
Пример1. Рассчитать коэффициенты в окислительно-восстановительной реакции
KNO2 + KMnO4 + H2SO4 ¾¾® KNO3 + MnSO4 + K2SO4 + H2O.
Основные этапы составления уравнения реакции:
1) определяются степени окисления элементов в соединениях, устанавливаются окислитель и восстановитель:
+1 +3 –2 +1 +7 –2 +1 +6 –2 +1 +5 –2 +2 +6 –2 +1 +6 –2 +1 –2
K N O2 + K Mn O4 + H2 S O4 ¾¾® K N O3 + Mn S O4 + K2 S O4 + H2 O.
Из схемы реакции видно, что степень окисления азота повысилась от +3 до +5, следовательно, KNO2 – восстановитель и в процессе реакции окисляется до KNO3. Степень окисления марганца меняется от +7 до +2, следовательно, KMnO4 – окислитель и в процессе реакции восстанавливается до MnSO4;
2) составляются уравнения электронного баланса и находятся коэффициенты при восстановителе и окислителе (основные коэффициенты):
+3 +5

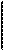 N – 2 ē = N 5
N – 2 ē = N 5
+7 +2
Mn + 5 ē = Mn 2
3) основные коэффициенты переносятся в уравнение реакции
5KNO2 + 2KMnO4 + H2SO4 ¾¾® 5KNO3 + 2MnSO4 + K2SO4 + H2O;
4) для остальных участников реакции находятся коэффициенты в следующем порядке: сначала уравнивается число атомов металлов, далее – число атомов неметаллов (кроме водорода), в последнюю очередь уравнивается число атомов водорода.
Окончательно уравнение будет иметь вид:
5KNO2 + 2KMnO4 + 3H2SO4 = 5KNO3 + 2MnSO4 + K2SO4 + 3H2O.
Для подтверждения того, что коэффициенты найдены верно, проверяется равенство атомов кислорода в левой и правой частях уравнения.
Пример 2. Используя метод электронного баланса, расставить коэффициенты в уравнении реакции:
As2S3 + HNO3 + H2O ¾¾® H3AsO4 + H2SO4 + NO
Определяются степени окисления элементов в соединениях:
+3 –2 +1 +5 –2 +1 –2 +1 +5 –2 +1 +6 –2 +2 –2
As2 S3 + H N O3 + H2O ¾¾® H3 As O4 + H2 S O4 + N O.
Из схемы реакции видно, степень окисления азота уменьшается от +5 до +2, следовательно, происходит процесс восстановления (HNO3 – окислитель), а степени окисления повышаются сразу у двух элементов: у мышьяка от +3 до +5 и у серы от –2 до +6, следовательно, эти два элемента в процессе реакции окисляются (As2S3 – восстановитель).
Составляем электронные уравнения и добиваемся электронного баланса, учитывая индексы при атомах мышьяка и серы и суммируя число отданных электронов (принято 3 электрона, а отдано 24 + 4 = 28 электронов):
+5 +2
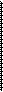 N + 3ē = N 28
N + 3ē = N 28
+3 +5
2 As – 4ē = 2 As 3
–2 +6
3 S – 24 ē = 3 S 3
Перенесем основные коэффициенты в уравнение реакции:
3As2S3 + 28HNO3 + H2O ¾¾® 6H3AsO4 + 9H2SO4 + 28NO,
а затем найдем коэффициент при H2O.
Окончательно уравнение будет иметь вид:
3As2S3 + 28HNO3 + 4H2O = 6H3AsO4 + 9H2SO4 + 28NO.
Пример 3. Используя метод электронного баланса, расставить коэффициенты в уравнении реакции:
P + NH4ClO4 ¾¾® H3PO4 + N2 + Cl2 + H2O.
В молекуле NH4ClO4 находятся два элемента, изменяющих свою степень окисления. В этом случае при составлении электронных уравнений можно подсчитать алгебраическую сумму теряемых и приобретаемых электронов:
0 –3 +1 +7 –2 +1 +5 –2 0 0 +1 –2
P + N H4 Cl O4 ¾¾® H3 P O4 + N2 + Cl2 + H2O.
–5ē –3ē +7ē
+4 ē
Составляем электронный баланс, для чего количество электронов, отдаваемых восстановителем (фосфором), записывается в качестве коэффициента перед формулой окислителя (NH4ClO4), а число электронов, получаемых окислителем, – в качестве коэффициента перед формулой восстановителя, причем в данном случае коэффициенты удваиваются в связи с тем, что в правой части уравнения находятся двухатомные молекулы N2 и Cl2.
Окончательно уравнение будет иметь вид:
8P + 10NH4ClO4 = 8H3PO4 + 5N2 + 5Cl2 + 8H2O.
Пример 4. Окислитель или восстановитель могут расходоваться, кроме основной окислительно-восстановительной реакции, и на связывание образующихся продуктов реакции, например:
+6 –1 +3 –1 0
K2Cr2O7 + HCl ¾¾® CrCl3 + Cl2 + KCl + Н2О.
Составим электронные уравнения и найдем основные коэффициенты при восстановителе и окислителе:
+6 +3

 2Cr + 6ē = 2Cr 1
2Cr + 6ē = 2Cr 1
–1 0
2Cl – 2ē = Cl2 3
Проставим основные коэффициенты в уравнение реакции, но только лишь при K2Cr2O7, CrCl3 и Cl2:
K2Cr2O7 + HCl ¾¾® 2CrCl3 + 3Cl2 + KCl + Н2О.
При HCl коэффициент пока не выставляется, так как электронными уравнениями определено лишь число ионов Cl–, изменивших степень окисления (истраченных на восстановление) и не учтено число ионов Cl–, пошедших на связывание катионов Cr3+.
Уравнивая калий, хлор и водород в обеих частях уравнения, получаем окончательное уравнение реакции:
K2Cr2O7 + 14HCl = 2CrCl3 + 3Cl2 + 2KCl + 7Н2О.
Пример 5. Внутримолекулярная окислительно-восстановительная
реакция:
+5 –2 –1 0
NaClO3 ¾¾® NaCl + O2.
Электронный баланс: +5 –1

 Cl + 6ē = Cl 12 2
Cl + 6ē = Cl 12 2
–2 0
6О –12 ē = 3О2 6 1
Окончательное уравнение реакции:
2NaClO3 = 2NaCl + 3O2.
Пример 6. Реакция диспропорционирования:
0 –1 +1
Cl2 + КОН ¾¾® КCl + КClО + Н2О.
Электронный баланс: 0 –1
 Cl + ē = Cl 1
Cl + ē = Cl 1
0 +1
Cl – ē = Cl 1
Окончательное уравнение реакции:
Cl2 + 2КОН = КCl + КClО + Н2О.
ионно-электронный метод
Ионно-электронный метод, или метод полуреакций, предусматривает раздельное составление ионных уравнений для процесса окисления и процесса восстановления с последующим суммированием их в общее ионное уравнение.
В методе полуреакций нет необходимости знать степень окисления атомов, так как в нем рассматриваются не гипотетические ионы, а существующие реально. Однако большое значение имеет среда – активный участник всего процесса. Влияние средына химический процесс настолько велико, что в некоторых случаях изменяется даже направление и результат процесса.
При составлении уравнений следует руководствоваться правилами:
1) сильные электролиты записывают в виде ионов, а слабые, малодиссоциированные, газообразные или твердые соединения (осадки) – в молекулярной форме. В ионную схему включают те частицы, которые подвергаются изменению, т.е. проявляют восстановительные или окислительные свойства, а также частицы, характеризующие среду:
кислую – ион Н+, щелочную – ион ОН- и нейтральную – молекулу Н2О;
2) если исходные вещества содержат больше кислорода, чем полученные продукты, то в кислой среде избыток кислорода с ионами Н+ образует воду, например:
5 NO2- + 2 MnO4- + 6 H+ ® 5 NO3- + 2 Mn2+ + 3 H2O,
а в щелочной и нейтральной среде кислород связывается молекулами воды с образованием гидроксид-ионов:
5 NO2- + 2 MnO4- + H2O ® 3 NO3- + 2 MnO2 + 2 OH-;
3) если исходные вещества содержат меньшее число атомов кислорода, чем образующиеся соединения, то недостающее число их пополняется в кислых и нейтральных растворах за счет молекул воды с образованием ионов водорода, например:
SO32- + Cl2 + H2O = SO42- + 2Cl- + 2H+;
а в щелочных растворах – за счет гидроксид-ионов с образованием
молекул воды:
NO2- + 2 MnO4- + 2OH- = NO3- + 2 MnO42- + 2H2O.
Пример 7. Реакция протекает в кислой среде:
K MnO4 + H2S + H2SO4 ® MnSO4 + S + K2SO4 + H2O.
Окислитель MnO4- восстанавливается в кислой среде до Mn2+,
а восстановитель H2S окисляется до S: по ионно-электронному уравнению:
 |
MnO4- + 8 H+ + 5e = Mn2+ + 4 H2O 2
H2S – 2e = S + 2H+ 5
Суммируем эти полуреакции, предварительно умножая их соответственно на 2 и 5:
2 MnO4- + 16 H+ + 5H2S = 2 Mn2+ + 5 S + 8 H2O + 10H+.
Правильно подобрав члены, получим уравнение окислительно-восстановительной реакции в ионно-молекулярном виде
2 MnO4- + 6 H+ + 5H2S = 2 Mn2+ + 5 S + 8 H2O.
Для получения уравнения в молекулярном виде следует добавить к каждому аниону соответствующий катион, а к каждому катиону – анион:
2 КMnO4 + 5H2S + 3 H2SO4 = 2 MnSO4 + 5 S + K2SO4 + 8 H2O.
Пример 8. Реакция протекает в щелочной среде:
NaCrO2 + Br2 + NaOH ® Na2CrO4 + NaBr + H2O
Окислитель Br2 восстанавливается до ионов Br-, а восстановитель CrO2- окисляется до CrO42 -: по ионно-электронным уравнениям:
 CrO2 - + 4 OH - – 3e = CrO42- + 2H2O 2
CrO2 - + 4 OH - – 3e = CrO42- + 2H2O 2
Br2 + 2e = 2Br- 3
______________________________________________
2 CrO2- + 8 OH- + 3 Br2 = 2 CrO42- + 2H2O + 6 Br-
В молекулярном виде:
2NaCrO2 + 3Br2 + 8NaOH = 2Na2CrO4 + 6NaBr + 4H2O.
************************************
ЛАБОРАТОРНАЯ РАБОТА № 6