АМИНЫ
Амины — органические производные аммиака, в молекуле которого один, два или все три атома водорода замещены углеродным остатком.
https://youtu.be/c6IrEJk0rFE (все вместе)
Обычно выделяют три типа аминов:
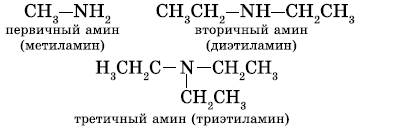
Можно также считать, что первичные амины являются производными углеводородов, в молекулах которых атом водорода замещен на функциональную аминогруппу (NH2—).
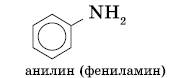
Амины, в которых аминогруппа связана непосредственно с ароматическим кольцом, называются ароматическими аминами.
Простейшим представителем этих соединений является аминобензол, или анилин:
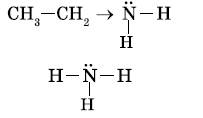
Основной отличительной чертой электронного строения аминов является наличие у атома азота, входящего в функциональную группу, неподеленной электронной пары. Это приводит к тому, что амины проявляют свойства оснований.
Существуют ионы, которые являются продуктом формального замещения на углеводородный радикал всех атомов водорода в ионе аммония:
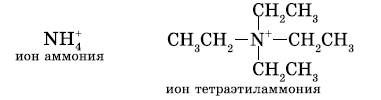
Эти ионы входят в состав солей, похожих на соли аммония. Они называются четвертичными аммонийными солями.
Изомерия и номенклатура аминов
https://youtu.be/SMIab4zd8-A?list=PLZD7dfTuRHAlfklennzHX5vPb66VqhpKV
1. Для аминов характерна структурная изомерия:
а) изомерия углеродного скелета:
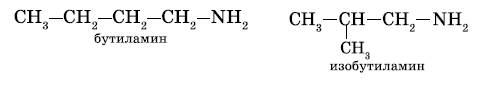
б) изомерия положения функциональной группы:
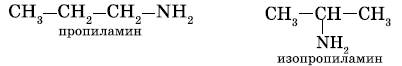
2. Первичные, вторичные и третичные амины изомерны друг другу (межклассовая изомерия):
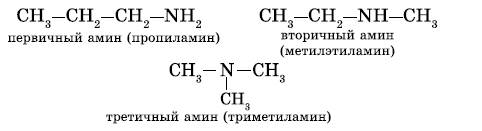
Как видно из приведенных примеров, для того чтобы назвать амин, перечисляют заместители, связанные с атомом азота (по порядку старшинства), и добавляют суффикс — амин.
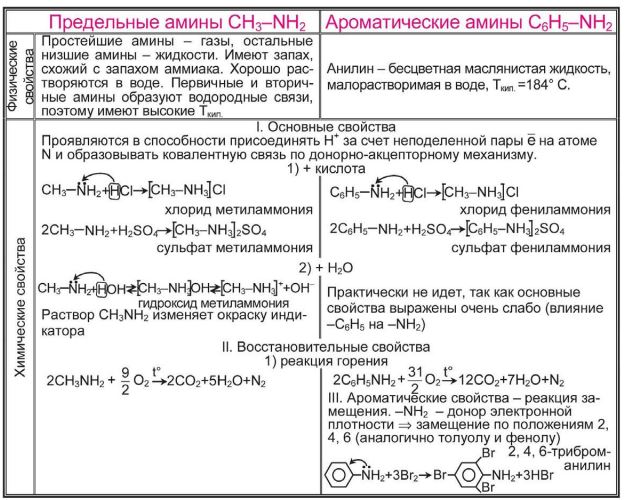
Физические свойства аминов
Простейшие амины (метиламин, диметиламин, триметиламин) — газообразные вещества. Остальные низшие амины — жидкости, которые хорошо растворяются в воде. Имеют характерный запах, напоминающий запах аммиака.
Первичные и вторичные амины способны образовывать водородные связи. Это приводит к заметному повышению их температур кипения по сравнению с соединениями, имеющими ту же молекулярную массу, но не способными образовывать водородные связи.
Анилин — маслянистая жидкость, ограниченно растворимая в воде, кипящая при температуре 184 °С.
Химические свойства аминов
Химические свойства аминов определяются в основном наличием у атома азота неподеленной электронной пары.
Амины как основания. Атом азота аминогруппы, подобно атому азота в молекуле аммиака, за счет неподеленной пары электронов может образовывать ковалентную связь по донорно-акцепторному механизму, выступая в роли донора. В связи с этим амины, как и аммиак, способны присоединять катион водорода, т. е. выступать в роли основания:
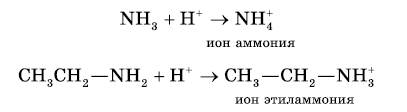
https://youtu.be/pI-wcKf4v50
https://youtu.be/3nenZjkvboI
1. Реакция амионов с водой приводит к образованию гидроксид-ионов:
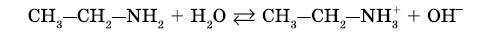
https://youtu.be/BdP9Xgbe0xg
2. Реакция с кислотами. Аммиак, реагируя с кислотами, образует соли аммония. Амины также способны вступать в реакцию с кислотами:
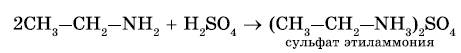
С Н3─ СН2 ─ NH2 + Н2 SO4 →[ С Н3─ СН2 ─ NH 3 ] Н SO4 ↓
Основные свойства алифатических аминов выражены сильнее, чем у аммиака. Это связано с наличием одного и более донорных алкильных заместителей, положительный индуктивный эффект которых повышает электронную плотность на атоме азота. Повышение электронной плотности превращает азот в более сильного донора пары электронов, что повышает его основные свойства:
3. Горение аминов. Амины горят на воздухе с образованием углекислого газа, воды и азота:
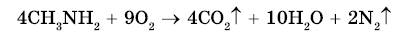
4. Взаимодействие ароматического амина (анилина) с бромной водой
https://youtu.be/d_pxNj5sd8g
С6 Н5 NH2 + 3Br2 (вода) → С6 Н 2 Br 3 NH2 ↓ +3Н Br
ПОЛУЧЕНИЕ АМИНОВ
1. [С Н3─ СН2 ─ NH3 ] Сl + NаОH→ С Н3─ СН2 ─ NH2 + Nа Сl + Н2 О
2. С Н3─ СН2 Сl + 2 NH3 → С Н3─ СН2 ─ NH2 + NH 4 Сl
Кат.
3. С Н3─ СН2 ОН + NH3 → С Н3─ СН2 ─ NH2 + Н2 О
Кат.
4. С6 Н5 NО 2 + 6Н → С6 Н5 NH2 +2 Н2 О РЕАКЦИЯ ЗИНИНА
https://youtu.be/VILzXkBnXho
Применение аминов
Амины широко применяются для получения лекарств, полимерных материалов. Анилин — важнейшее соединение данного класса, которое используют для производства анилиновых красителей, лекарств (сульфаниламидных препаратов), полимерных материалов (анилинформальдегидных смол).