Лабораторная работа №4
Определение Fe2+ в соли мора
Цель работы определить содержание железа в соли мора способом обратного перманганатометрического титрования.
Оборудование и реактивы бюретка 25мл в штативе, воронка, мерная колба 100 мл, пипетки Мора 5мл, колбы конические для титрования 100мл, резиновая груша, Раствор KMnO4. 0,1н, подкисленный раствор соли Мора 0,1н, раствор серной кислоты 1н, плитка, колба мерная 500 мл
Теоретическая часть
Определение содержания железа (II) в растворах является одним из важнейших применений перманганатометрии, которое осуществляют прямым методом титрования. Соль Мора (NH4)2Fe(SO4)2×6Н2О окисляется перманганатом калия в среде серной кислоты согласно уравнению:
2KMnO4 + 10(NH4)2Fe(SO4)2 + 8H2SO4 = 2MnSO4 + 5Fe2(SO4)3 +
+ 10(NH4)2SO4 + K2SO4 + 8H2O
Ход работы
Опыт 1. Приготовление раствора перманганата калия и определение его точной концентрации
Приготовление раствора перманганата калия
1. Навеску перманганата калия массой 1,6г взвесить в стаканчике на аналитических весах с точностью 0,0002г.
2. Перевести навеску в мерную колбу объёмом 500 мл налить дистиллированной воды на половину колбы и перемешать до растворения кристаллов
3. Раствор оставляют на 7-10 дней после чего путем фильтрования через стеклянный фильтр отделяют раствор от осадка двуокиси марганца
Приготовление раствора щавелевой кислоты
Раствор готовится из фиксонала согласно инструкции
1.3 Определение точной концентрации раствора KMnO4 (холостой опыт)
1. Заполнить бюретку раствором KMnO4. Поскольку раствор перманганата калия интенсивно окрашен, все измерения объемов производят по верхнему мениску. При заполнении бюретки на нулевой отметке устанавливают верхний мениск.
2. В коническую колбу на 100 мл вносят 5 мл раствора щавелевой кислоты и 5 мл раствора серной кислоты концентрацией 1н.
3. Нагревают колбу на плитке до появления пара
4. После этого колбу аккуратной снимают с плитки и титруют раствор перманганатом калия до неисчезающей розовой окраски.
5. Результаты титрования повторяют до тех пор, пока разница между результатами не будет составлять 0,05 мл.
6. Результаты титрования заносят в таблицу 1
Таблица 1 – результаты титрования щавелевой кислоты перманганатом калия
| № | V (H2C2O4), мл | V(KMnO4), мл | V(KMnO4)ср, мл |
По полученным вычислить молярную концентрацию эквивалента раствора перманганата калия.
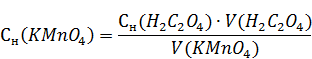
где Сн(H2C2O4) – концентрация щавелевой кислоты (написана на склянке), н.
V(H2C2O4) – объём щавелевой кислоты пошедшего на титрование, мл.
V(KMnO4) – объём раствора взятый для анализа (равен объему пипетки), мл.
Опыт 2. Определение железа соли Мора.
Приготовление раствора соли Мора
1. 20 г соли Мора взвешивают с точностью до 0,0002г. и переносят в мерную колбу на 500 мл.
2. добавляют а колбу 30 мл серной кислоты и 200 мл воды и перемешивают до растворения соли
3. доводят раствор до метки
4. коэффициент поправки устанавливают в день применения.
Определение концентрации железа (II) в соли Мора
1. Взять исследуемый раствор соли Мора в мерной колбе у преподавателя.
2. Довести объем мерной колбы дистиллированной водой до метки.
3. В колбу для титрования мерной пипеткой отбирают 5,0 мл анализируемого раствора, подкисляют 10 мл раствором H2SO4 с молярной концентрацией эквивалента 1н
4. Нагревают колбу на плитке до появления пара.
5. титруют рабочим раствором перманганата калия до появления устойчивой бледно-розовой окраски.
6. Результаты титрования повторяют до тех пор, пока разница между результатами не будет составлять 0,05 мл.
7. результаты записывают в таблицу 2
Таблица 2 – результаты титрования соли Мора перманганатом калия
| № | V (соль Мора), мл | V(KMnO4), мл | V(KMnO4)ср, мл |
8. Содержание железа (II) определяют по формулам:

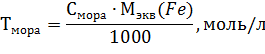
m(Fe)=Тмора ∙ Vколбы, г
Железо (II) окисляется до железа (III), теряя один электрон. Поэтому молярная масса эквивалента железа равна его атомной массе − 55,85.
9. После установления концентрации раствора необходимо определить относительную ошибку по формуле:
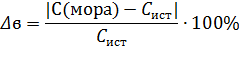
где С(мора) – практическая концентрация, найденная титрометрическим методом;
Сист – концентрация раствора, которую нужно было приготовить по условию лабораторной работы.
10. Сделать вывод по проделанной работе
Вопросы для защиты:
1. Какой индикатор используется?
2. Какой переход окраски во время титрования?
3. Какой тип реакции лежит в основе метода?
4. Для чего нужно подкислять исследуемый раствор?
5. Чем обусловлена необходимость установления точной концентрации рабочего перманганата калия?