Способы выражения состава растворов
Вариант № 18
Вычислить массовую Сm, молярную С(А), моляльную m концентрации вещества и его мольную долю X, % в водном растворе с массовой долей ω, % и плотностью ρ
| Вещество(A) | ω, % | ρ, г/см3 |
| CdSO4 | 1,291 |
Пусть Vр-ра = 1000 мл, тогда:
mр-ра(CdSO4) = ρ·V = 1,291 г/см3·1000 мл = 1291 г.
mр.в(CdSO4) = ω· mр-ра = 0,25·1291 = 322,75 г
1) Рассчитаем массовую Сm:
СCdSO4 = 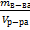 =
= 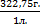 = 322,75 г/л
= 322,75 г/л
2) Рассчитаем молярную С(А):
С(CdSO4) = 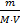 =
= 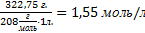
3) Рассчитаем моляльную m:
m = 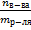 =
= 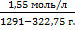 = 1,6 моль/кг
= 1,6 моль/кг
4) Рассчитаем мольную доли X, %:
N = 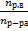 =
= 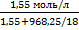 = 0,028 или 2,8%
= 0,028 или 2,8%
Коллигативные (общие) свойства растворов
| № варианта | Задание |
| Эбуллиоскопическая постоянная для воды равна 0,512 К·кг/моль. При какой температуре кипит 5%-ный раствор тростникового сахара С12H22O11 в воде. |
Kk - эбуллиоскопическая постоянная
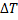 кип = Kk · m
кип = Kk · m
Пусть mр-ра = 100 г.
m = 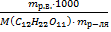 =
= 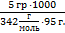 = 0,154
= 0,154
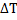 кип = 0,512 · 0,154 = 0,0788
кип = 0,512 · 0,154 = 0,0788
Тк(р-р) = 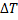 кип + Тк(р-ль) = 100 + 0,0788 = 100,0788 0С
кип + Тк(р-ль) = 100 + 0,0788 = 100,0788 0С
Свойства растворов слабых электролитов
Рассчитать pH и удельную электропроводность раствора слабой кислоты при 298 К.
| № варианта | Кислота | Концентрация, моль/л |
| муравьиная | 0,1 |
1) Рассчитаем степень диссоциации слабого электролита на основании выражения для закона разведения Оствальда.
Кд = 1,772·10-4 – константа электролитической диссоциации муравьиной кислоты.
α = 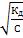 =
= 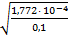
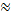 0,0421
0,0421
2) Рассчитаем концентрацию ионов водорода и pH раствора:
С(H+) = α 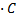 = 0,0421· 0,1 = 0,00421 или 4,21· 10-3 моль/л
= 0,0421· 0,1 = 0,00421 или 4,21· 10-3 моль/л
pH = - lgC(H+) = -lg4,21· 10-3 = 2,376
3) Рассчитаем удельную электропроводность по закону Кольрауша:
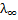 =
= 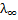 + +
+ + 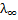 - =
- = 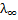 H+ +
H+ + 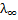 HCOO-
HCOO-
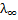 =
= 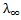 H+ +
H+ + 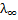 HCOO- = 349,8·10-4 + 54,6·10-4 = 404,4·10-4 Oм-1м2моль-1
HCOO- = 349,8·10-4 + 54,6·10-4 = 404,4·10-4 Oм-1м2моль-1
χ = С · 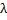 с
с
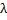 с = α ·
с = α · 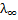 = 0,0421·404,4·10-4 =17,03·10-4 Oм-1м2моль-1 – молярная электропроводность раствора.
= 0,0421·404,4·10-4 =17,03·10-4 Oм-1м2моль-1 – молярная электропроводность раствора.
χ = С · 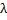 с = 0,1 моль/л · 1000моль/м3 · 17,03·10-4 = 17,03·10-2 Oм-1м-1
с = 0,1 моль/л · 1000моль/м3 · 17,03·10-4 = 17,03·10-2 Oм-1м-1
|
|
Расчёт кинетических характеристик химической реакции
Рассчитать: 1) энергию активации реакции Еа; 2) константу скорости реакции k3 при температуре T3; 3) Температурный коэффициент скорости реакции γ; 4) период полураспада τ1/2 при температуре T1; 5) израсходованное количество вещества за время τ при температуре T1; 6) Построить графическую зависимость lnk = f(1/T) на миллиметровой бумаге и найти по графику значения энергии активации и предэкспоненциального множителя А.
| № вар | Реакция | T1,K | k1 | T2,K | k2 | T3,K | τ, мин | Со, М |
2NO2 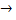 N2 + 2O2 N2 + 2O2
| 986,0 | 6,72 | 1165,0 | 977,0 | 1053,2 | 1,75 |
1) Рассчитаем энергию активации реакции Еа:
Согласно уравнению, реакция имеет второй порядок. Размерность k - л·моль-1·мин-1
Ea = R·ln 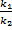 · (
· (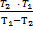 ) = 8,314 · ln
) = 8,314 · ln 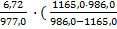 ) = 8,314 · (-4,979) · (-6417,26) = 265645,1 Дж/моль
) = 8,314 · (-4,979) · (-6417,26) = 265645,1 Дж/моль
Ea = 265,6 кДж/моль
2) Рассчитаем константу скорости реакции k3 при температуре T3:
ln 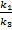 =
= 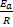 ·
· 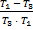 =
= 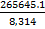 ·
· 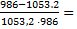 31951,5 · (-0,00006471) = -2,068
31951,5 · (-0,00006471) = -2,068
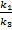 = e -2,068 = 0,126
= e -2,068 = 0,126
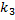 = 6,72/0,126 = 53,33 л·моль-1·мин-1
= 6,72/0,126 = 53,33 л·моль-1·мин-1
3) Рассчитать температурный коэффициент скорости реакции γ:
lnγ = 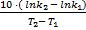 =
= 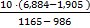 = 0,278
= 0,278
γ = e0,278 = 1,32
Проверка
γ = 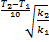 =
= 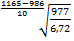 = 1,32
= 1,32
4) Рассчитаем период полураспада τ1/2 при температуре T1:
τ ½ = 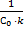 =
= 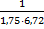 = 0,08503
= 0,08503
5) Рассчитаем израсходованное количество вещества за время τ при температуре T1 :
kτ =  -
- 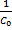
 = k1τ +
= k1τ + 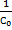 = 6,72·65 +
= 6,72·65 + 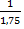 = 436,813
= 436,813
С = 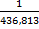 = 0,0023 моль/л
= 0,0023 моль/л
За 65 минут при температуре T1 = 986,0 K прореагировало 1,75 – 0,0023 = 1,7477 моль
6) Построить графическую зависимость lnk = f(1/T):
| lnk1 | lnk2 | lnk3 |
| 1,90 | 6,88 | 3,98 |
| 1/T | 1/T | 1/T |
| 1,01·10-3 | 0,86·10-3 | 0,95·10-3 |
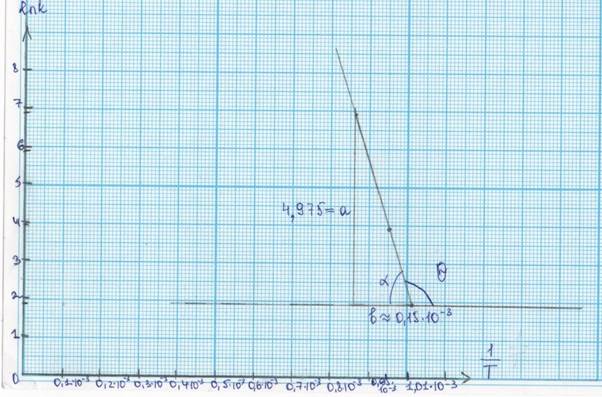
a = 4,975
b = 0,15·10-3
tgα = 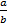 =
= 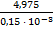 = 33166,67
= 33166,67
tgα = - tgɵ = 33166,67
-Ea = tgɵ · R = -33166,67 · 8,314 = -275748
Ea = 275748 Дж/моль
lnA = 4,975
A = e4,975 = 144,75 – предэкспоненциальный множитель
|
|
Расчет кинетических характеристик химической реакции
| № вар. | 1. Реакция 2А 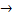 продукты за 60 мин при 20 0С прошла на 40% а при 500С – на 90%. С0 = 0,25 моль/л. Вычислите константы скорости и энергию активации реакции. Реакция 2-го порядка. продукты за 60 мин при 20 0С прошла на 40% а при 500С – на 90%. С0 = 0,25 моль/л. Вычислите константы скорости и энергию активации реакции. Реакция 2-го порядка.
|
| 2. При повышении температуры на 20 0С скорость процесса увеличилась в 9 раз. Вычислить температурный коэффициент химической реакции. |
1.
Реакция второго порядка. Для расчета константы скорости уравнение имеет вид:
kτ = 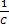 -
- 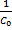
1) Рассчитаем k1 при 200С
Реакция прошла на 40% = > 100% - 40% = 60% не прореагировало. С = 0,6·С0
τ = 60 мин· 60 =3600 с.
k1 = (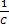 -
- 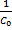 )
) 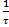 = (
= (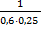 -
- 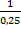 ) ·
) · 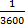 = 7,407 · 10-4 л/моль·с
= 7,407 · 10-4 л/моль·с
2) Рассчитаем k2 при 500С
Реакция прошла на 90% = > 100% - 90% = 10% не прореагировало. С = 0,1·С0
k2 = (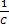 -
- 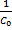 )
) 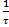 = (
= (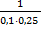 -
- 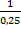 )
) 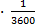 = 0,01 л/моль·с
= 0,01 л/моль·с
3) Рассчитаем энергию активации Ea
Ea = 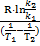 =
= 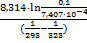 = 52647,5 Дж/моль
= 52647,5 Дж/моль
Ea = 52,65 кДж/моль
2.
Так как скорость процесса увеличилась в 9 раз, тогда:
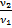 = 9
= 9
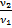 =
= 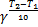
9 = 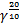
9 = 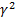
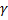 = 3 – температурный коэффициент химической реакции.
= 3 – температурный коэффициент химической реакции.