Задача 1
В сосуде объемом 1 л находится 2 г углекислого газа при температуре 17 0С. Каково давление газа?
Решение
| V=10-3 м3 m=2×10-3 кг Т=290 К Мr=44 | Так как состояние газа не изменяется, то применяем уравнение Клапейрона – Менделеева: 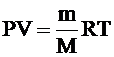 Все параметры, кроме искомого Р, известны. Выражаем Р:
Все параметры, кроме искомого Р, известны. Выражаем Р: 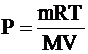
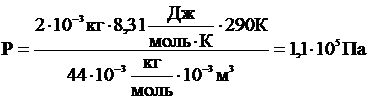 Ответ: Р = 1,1×105 Па
Ответ: Р = 1,1×105 Па
|
| Р -? |
При решении задач на газовые законы наиболее часто используются следующие соотношения:
1. Связь абсолютной температуры (Т) с температурой по шкале Цельсия (t): Т = 2737+ t.
2. Связь наиболее часто употребляемых единиц давления:
1 мм ртутного столба = 133,3 Па;
1 атм. = 760 мм рт. ст. » 1,013×105 Па.
3. 1 литр = 1 дм3 = 10-3 м3.
4. «Нормальные условия»: Р0 » 105 Па; Т0 = 273 К.
5. Относительная молекулярная масса «воздуха»: Мr » 29.
Если состояние газа изменяется (т.е. изменяется хотя бы один из трех параметров: P, V или Т), то связь между параметрами начального и конечного состояния осуществляется при помощи объединенного газового закона:

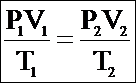
Для данной массы газа отношение произведения давления на объем к абсолютной температуре постоянно при любых изменениях, происходящих с газом.
Объединенный газовый закон является следствием уравнения Клапейрона – Менделеева: пусть газ переходит из состояния "1" с параметрами Р1,V1, T1 в состояние "2" с параметрами P2, V2, T2, причем при этом переходе масса газа не изменяется (m = const).
Для каждого состояния можно записать уравнение Клапейрона - Менделеева:
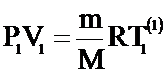 ;
; 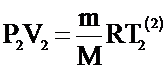
Из уравнения (1):  ; из уравнения (2):
; из уравнения (2): 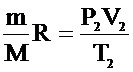 .
.
Так как левые части равенств равны, то, приравнивая правые, получаем:

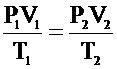
Задача 2
В цилиндре двигателя в начале такта сжатия температура воздуха была 40 0С, а давление 0,8×105 Па. Во время сжатия объем воздуха уменьшился в 15 раз, а давление увеличилось до 3,5×106 Па. Определить температуру сжатого воздуха.
Решение
| Р1=0,8×105 Па Т1=313 К Р2=3,5×106 Па V1 = 15V2 V1=15V2 | Так как параметры газа при переходе из первого состояния во второе изменяются, то для связи между параметрами применяем объединенный газовый закон: |
| T2 -? |
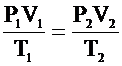 .
Из него выражаем искомый параметр Т2: .
Из него выражаем искомый параметр Т2:
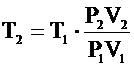 , ,
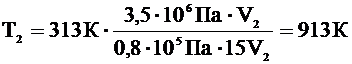 Ответ: температура сжатого воздуха 913 К
Ответ: температура сжатого воздуха 913 К
| ||
Изопроцессы. Газовые законы
Из объединенного газового закона можно получить соотношения,
соответствующие частным случаям изменения состояния газа, называемым изопроцессами (когда при изменении состояния, кроме массы газа, остается постоянным один параметр: либо Т, либо Р, либо V).
1. Изотермический процесс
Процесс изменения состояния газа при неизменной температуре (Т=const) называется изотермическим.
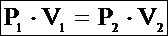 |
Из объединенного газового закона при Т = const получим:
Для данной массы газа при неизменной температуре произведение давления на объем есть величина постоянная - закон Бойля-Мариотта (Р×V = const).
Изотермический процесс должен осуществляться очень медленно, чтобы успевал пройти теплообмен газа с соприкасающимися с ним телами.
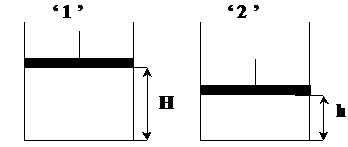 Задача 3
Задача 3
Как изменится давление газа в цилиндре, если поршень медленно опустить на 1/3 высоты цилиндра?
Решение
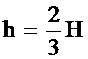
| Газ под поршнем перешел из состояния "1" с параметрами Р1, V1, Т1 в состояние "2" с параметрами Р2, V2, T2. Так как изменение состояния происходило медленно, то подразумеваем, что температура газа при этом не изменялась (Т = const).
Для этих двух состояний можно применить закон Бойля-Мариотта:
P1V1 = P2V2
V1 = H×S, V2 = h×S = 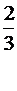 H×S, где S - площадь основания цилиндра; H×S, где S - площадь основания цилиндра;
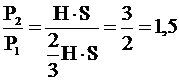 P2 = 1,5Р1
Ответ: давление газа увеличится в 1,5 раза P2 = 1,5Р1
Ответ: давление газа увеличится в 1,5 раза
|
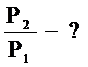
|
 |
Графики зависимостей параметров при T=const называются изотермами. Изотермы в координатных осях P(V), P(T), V(T) имеют вид:
 2. Изобарный процесс
2. Изобарный процесс
Если в процессе изменения состояния газа остается неизменным давление (Р = const), то это изобарный процесс.
Из объединенного газового закона при Р = const (т.е. Р1 = Р2) следует:
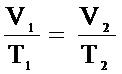
Для данной массы газа при постоянном давлении отношение объема газа к абсолютной температуре постоянно - закон Гей-Люссака. Иначе V ~ T (при постоянном давлении объем газа пропорционален его абсолютной температуре).
Задача 4
 В цилиндре под поршнем площадью 100 см2 находятся 28 г азота при 00С. На какую высоту поднимется поршень массы 100 кг при нагревании цилиндра до 1000С? Атмосферное давление – нормальное.
В цилиндре под поршнем площадью 100 см2 находятся 28 г азота при 00С. На какую высоту поднимется поршень массы 100 кг при нагревании цилиндра до 1000С? Атмосферное давление – нормальное.
Решение
| S = 10-2 м2 m = 2,8×10-2 кг Т1 = 273 К Т2 = 373 К М = 100 кг Р0 = 105 Па Мr = 28 | Давление газа в данной задаче остается без изменения. Для нахождения этого давления запишем условие равновесия поршня:
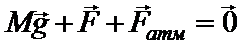 Отсюда: F = Fатм + Mg
Разделив обе части на S, получим:
Р = Р0 +
Отсюда: F = Fатм + Mg
Разделив обе части на S, получим:
Р = Р0 + 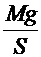 ;
Р = 105 + ;
Р = 105 + 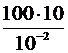 = 2×105 (Па) = 2×105 (Па)
|
| h-? |
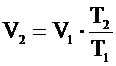
 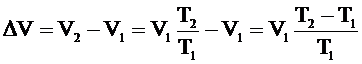 Из уравнения Клапейрона-Менделеева для начального состояния выразим объем V1:
Из уравнения Клапейрона-Менделеева для начального состояния выразим объем V1:
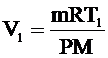
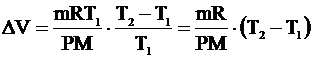 Высота поднятия поршня:
Высота поднятия поршня:
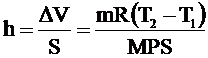
 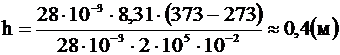 Ответ: поршень поднимется на 0,4 м.
Ответ: поршень поднимется на 0,4 м.
|
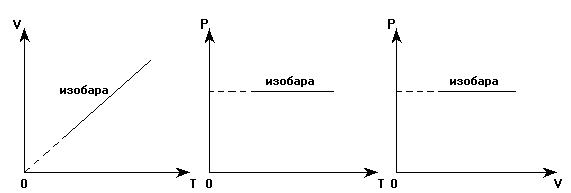 |
Графики зависимости между параметрами газа при изобарном процессе называются изобарами:
В координатных осях V(T) из двух изобар, соответствующих одной и той же массе газа, круче располагается та, которая соответствует меньшему давлению.
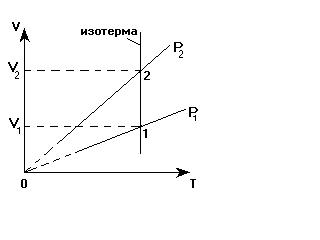 Для обоснования этого утверждения "зафиксируем" температуру (проведем изотерму, пересекающую обе изобары).
Для обоснования этого утверждения "зафиксируем" температуру (проведем изотерму, пересекающую обе изобары).
Точки «1» и «2» находятся на одной изотерме. Температура газа в этих точках одинакова, поэтому применим для газа в этих точках закон Бойля-Мариотта:
Р1×V1 = P2×V2
Так как V2 >V1, то для выполнения этого закона необходимо, чтобы выполнялось неравенство: Р2 < Р1. Значит, изобара, проходящая через точку «2», соответствует меньшему давлению, чем изобара, проходящая через точку «1».
Сравнение наклона изобар используется при решении ряда задач, где приходится сравнивать давления газа.
3. Изохорный процесс
Если в процессе изменения состояния газа остается постоянным объем газа (V = const), то такой процесс называется изохорным.
Из объединенного газового закона при V1 = V2 следует:
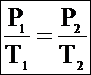
Для данной массы газа при неизменном объеме отношение давления газа к абсолютной температуре постоянно – закон Шарля. Иначе: P ~ T (при постоянном объеме давление газа пропорционально абсолютной температуре).
Задача 5
В цилиндре под поршнем площадью 30 см2 находится воздух при давлении 2×105 Па и температуре 270С. Какой груз нужно положить на поршень после нагревания воздуха до температуры 500С, чтобы поршень остался на прежнем уровне?
Решение
| S = 3×10-3 м2 Р = 2×105 Па Т1 = 300 К Т2 = 323 К V1 = V2 | Так как объем газа не изменяется, то для связи параметров начального и конечного состояний газа применяем закон Шарля:
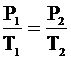 Учитывая, что
Учитывая, что 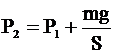 , получим: , получим:
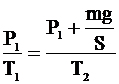 Отсюда:
Отсюда: 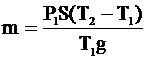
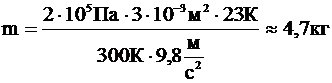 Ответ: 4,7 кг.
Ответ: 4,7 кг.
|
| m -? |
Графики зависимостей параметров газа при изменении его
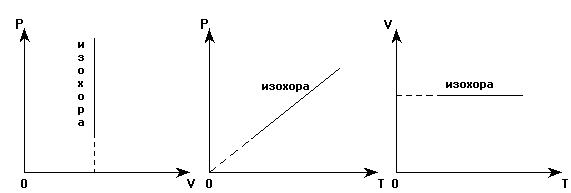 |
состояния, когда объем газа не меняется, называются изохорами.
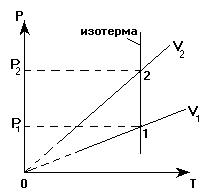 |
Аналогично утверждение: чем круче расположена изохора в координатных осях Р(Т), тем меньшему объему газа она соответствует:
V2 < V1
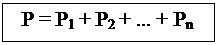 |
Если в некотором сосуде находится смесь различных газов, то давление этой смеси на стенки сосуда определяется законом Дальтона: