(Давление, создаваемое каждым компонентом смеси, иначе называют парциальным давлением.)
Задача 6
Смесь газов из 4 г водорода, 56 г азота и 22 г углекислого газа заключена в сосуде объемом 25 л при температуре 270С. Определить давление смеси.
Решение
| m1 = 4×10-3 кг Mr1 = 2 m2 = 56×10-3 кг Mr2 = 28 m3 = 22×10-3 кг Mr3 = 44 V = 25×10-3 м3 Т = 300 К | Три газа находятся в одном сосуде. Каждый газ занимает весь предоставленный ему объем. Значит, объем каждого газа – 25 л. Температуры газов одинаковы. Применим для каждого газа уравнение Клапейрона-Менделеева и выразим из этих уравнений парциальные давления водорода (Р1), азота (Р2) и углекислого газа (Р3):
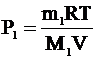 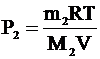 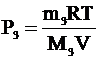 . .
 По закону Дальтона их общее давление равно: По закону Дальтона их общее давление равно:
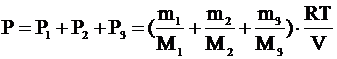 , ,
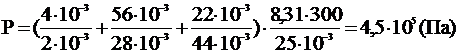 Ответ: давление смеси газов равно 4,5×105 Па.
Ответ: давление смеси газов равно 4,5×105 Па.
|
| Р -? |
Применение газовых законов
К решению ряда задач
Задача 7
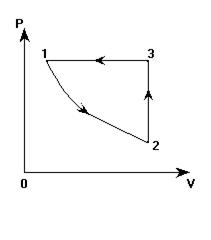
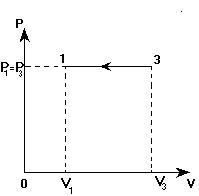
На графике в координатных осях Р(V) представлен замкнутый цикл для некоторой массы идеального газа. Представить этот цикл в координатных осях V(T).
Решение
 Проанализируем, как изменяются параметры газа при каждом изменении состояния:
Проанализируем, как изменяются параметры газа при каждом изменении состояния:
1. Переход 1-2. Линия 1-2 - изотерма. Значит, температура остается постоянной (Т=const). Давление Р при переходе из состояния 1 в состояние 2 уменьшается (это видно из графика). Объем V возрастает (также из графика).
 Процесс «1-2» - изотермическое расширение.
Процесс «1-2» - изотермическое расширение.
2. Переход 2-3. Остается постоянным объем (V=const). Давление газа при переходе из состояния 2 состояние 3 возрастает. По закону Шарля: Р ~ Т. Значит, Т3 > Т2 (температура растет).
 Процесс «2-3» - изохорное нагревание.
Процесс «2-3» - изохорное нагревание.
3. Переход 3-1. Не изменяется давление (Р=const). Объем уменьшается (V1 < V3). Из закона Гей-Люссака (Р ~ Т) следует:
Т1 < Т3. Температура уменьшается.
Процесс «3-1» - изобарное охлаждение.
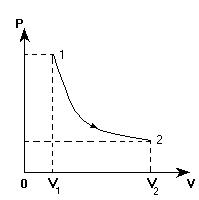
Изображаем эти процессы в координатных осях V(T):
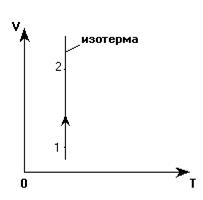
1. Переход 1-2. С учетом анализа: Т = const, Р уменьшается, V возрастает. Произвольно изображаем изотерму. На ней выбираем точки «1» и «2» с учетом того, что V2 >V1.
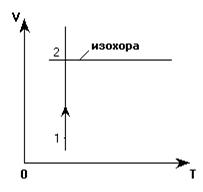 2. Переход 2-3. Через точку «2» проводим изохору, так как процесс 2-3 - изохорный (V = const). Точка «3» находится на этой изохоре, правее точки «2», так как согласно анализу Т3 >Т2. Точное положение точки «3» определится следующим построением изобары 3-1: точка «3» найдется пересечением изохоры 2-3 и изобары 3-1.
2. Переход 2-3. Через точку «2» проводим изохору, так как процесс 2-3 - изохорный (V = const). Точка «3» находится на этой изохоре, правее точки «2», так как согласно анализу Т3 >Т2. Точное положение точки «3» определится следующим построением изобары 3-1: точка «3» найдется пересечением изохоры 2-3 и изобары 3-1.
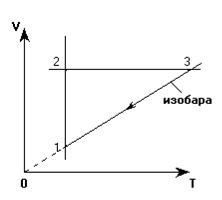
3. Переход 3-1. Через точку «1» проводим изобару и тем самым определяем положение точки «3». При переходе 1-3 объем газа уменьшается, что также соответствует анализу.
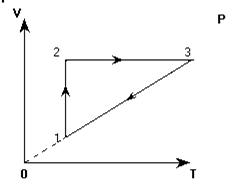 |
Итак, данный замкнутый процесс имеет следующий вид в координатных осях V(T):
Задача 8
Определить молекулярную формулу некоторого соединения углерода с водородом, если известно, что при температуре 270С и давлении 105 Па 1 л этого вещества в газообразном состоянии имеет массу 0,65г.
Решение
| Т = 300 К Р = 105 Па V = 10-3 м3 m = 0,65×10-3 кг | Так как изменения состояния газа не происходит, то используем уравнение Клапейрона-Менделеева. Из него выражаем молярную массу данного вещества:
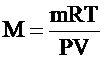
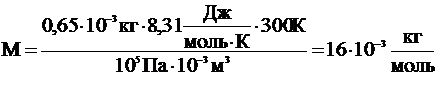 .
Значит, относительная молекулярная масса равна 16.
16 = 12x + 1y, т.к. Mr(С) =12, а Мr(H) =1
Это уравнение имеет единственное решение при x = 1, y = 4.
Итак, искомая молекулярная формула - СН4. Это метан.
Ответ:молекулярная формула - СН4. .
Значит, относительная молекулярная масса равна 16.
16 = 12x + 1y, т.к. Mr(С) =12, а Мr(H) =1
Это уравнение имеет единственное решение при x = 1, y = 4.
Итак, искомая молекулярная формула - СН4. Это метан.
Ответ:молекулярная формула - СН4.
|
| CX HY -? |
Задача 9
Объем комнаты 50 м3. Какая масса воздуха выйдет из комнаты при повышении температуры от 00С до 400С? Атмосферное давление - нормальное.
Решение
| V = 50 м3 Р = 105 Па Т1 = 273 К Т2 = 313 К Мr = 29 | При изменении температуры воздуха в комнате объем комнаты существенно не изменяется. Не изменяется также и давление воздуха в комнате, так как комната не герметична и расширяющийся воздух может выходить из нее. Выразим массу воздуха в комнате при температурах Т1 и Т2:
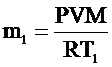 , , 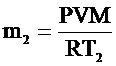 . .
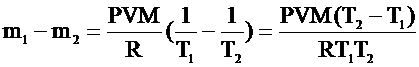
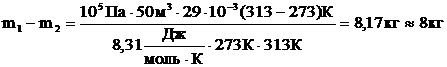 Ответ: из комнаты выйдет 8 кг воздуха
Ответ: из комнаты выйдет 8 кг воздуха
|
| m1, m2 -? |
Задача 10
Сосуд объемом 8 л разделен на две равные части полупроницаемой перегородкой, пропускающей водород и не пропускающей азот. В левую половину сосуда впускают 2 г водорода, а в правую - 14 г азота. Температура поддерживается 170С. Определить давление в обеих частях сосуда после установления равновесия.
Решение
| V = 8×10-3 м3 m1 = 2×10-3 кг Мr1 = 2 m2 = 14×10-3 кг Мr2 = 28 Т = 290 К Рлев -? Рправ -? | Tак как перегородка не представляет препятствия для молекул водорода, то водород постепенно равномерно распределится по всему объему сосуда. Азот же полностью останется в правой половине. Тогда давление в левой части сосуда будет обусловлено только давлением водорода, которое можно найти из уравнения Клапейрона-Менделеева:
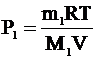 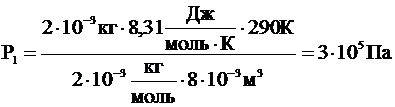 Рлев = Р1 - давление в левой части сосуда.
Давление в правой части сосуда по закону Дальтона будет складываться из давления водорода Р1 и давления азота Р2. Давление азота Р2 найдем также из уравнения Клапейрона – Менделеева с учетом того, что его объем вдвое меньше:
Рлев = Р1 - давление в левой части сосуда.
Давление в правой части сосуда по закону Дальтона будет складываться из давления водорода Р1 и давления азота Р2. Давление азота Р2 найдем также из уравнения Клапейрона – Менделеева с учетом того, что его объем вдвое меньше:
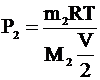
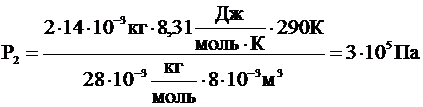 .
Давление в правой части сосуда по закону Дальтона равно:
Рправ = Р1+ Р2 = 3×105 Па + 3×105 Па = 6×105 Па.
Ответ. Рлев= 3×105 Па; Рправ= 6×105 Па. .
Давление в правой части сосуда по закону Дальтона равно:
Рправ = Р1+ Р2 = 3×105 Па + 3×105 Па = 6×105 Па.
Ответ. Рлев= 3×105 Па; Рправ= 6×105 Па.
|
Задача 11
Два баллона соединены трубкой с краном. В первом находится газ под давлением 105Па, во втором - под давлением 0,6×105Па. Емкость первого баллона 1л, второго - 3л. Какое давление установится в баллонах, если открыть кран? Температуру считать постоянной.
Решение
| Р1 = 105 Па Р2 = 0,6×105 Па V1 = 10-3 м3 V2 = 3×10-3 м3 | В этой задаче происходит изменение состояния обоих газов. Газ из первого баллона распределится по всему объему; Р1 и V1 – его параметры в начальном состоянии, а Р1¢ и V1 + V2 – его параметры в конечном состоянии. Так как температура газа при этом не менялась, то для этого изменения состояния можно применить закон Бойля-Мариотта:
P1×V1 = P1¢×(V1+V2).
Отсюда: 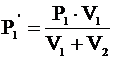 - конечное давление газа из первого баллона.
Аналогично для давления газа из второго баллона: - конечное давление газа из первого баллона.
Аналогично для давления газа из второго баллона:
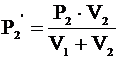 Согласно закону Дальтона общее давление газов равно сумме их давлений:
Согласно закону Дальтона общее давление газов равно сумме их давлений:
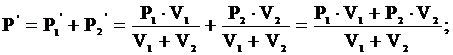
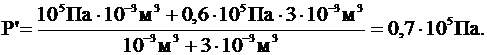 Ответ: Р¢ = 0,7×105 Па.
Ответ: Р¢ = 0,7×105 Па.
|
| Р¢ -? |
Задача 12
В сосуд объемом 10 л накачивают воздух при помощи поршневого насоса, объем которого равен 0,1 л. Каким будет давление воздуха в сосуде после 100 качаний? Первоначальное давление воздуха в сосуде равно наружному.
Решение
| V0 = 10-4 м3 V = 10-3 м3 n = 100 Р0 = 105 Па | Воздух из атмосферы нагнетается в сосуд, при этом состояние воздуха изменяется.
Состояние «1»: атмосферный воздух, который будет потом заключен в сосуде, имеет давление Р1 = Р0 и объем V1 = V + n×V0.
Состояние «2»: этот воздух накачали в сосуд и теперь он имеет параметры: объем V2 = V и давление Р2.
Так как температуру воздуха подразумеваем неизменной, то для обоих состояний воздуха можно применить закон Бойля-Мариотта:
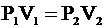 .
Отсюда: .
Отсюда: 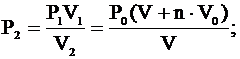
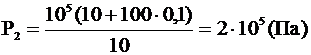 Ответ: Р2 = 2×105 Па.
Ответ: Р2 = 2×105 Па.
|
| Р2 -? |
Задача 13
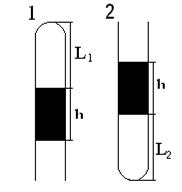 |
Как велико атмосферное давление, если при длине ртутного столбика 12,5 см в тонкой трубке длина воздушного столбика в первом положении - 7 см, а во втором - 5 см?.
Решение
| h = 12,5 см L1 = 7 см L2 = 5 см | Воздух в трубке изотермически перешел из состояния «1» с параметрами: Р1 = Р0 – h
V1 = L1×S
в состояние «2» с параметрами: Р2 = Р0 – h
V2 = L2×S,
S – площадь сечения трубки.
Применяем для этих состояний закон Бойля-Мариотта: 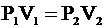
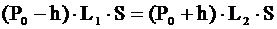 .
Находим Р0: .
Находим Р0: 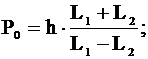
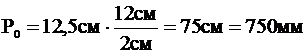 .
Ответ: атмосферное давление Р0 = 750 мм рт.ст. .
Ответ: атмосферное давление Р0 = 750 мм рт.ст.
|
| Р0 -? |
Задача 14
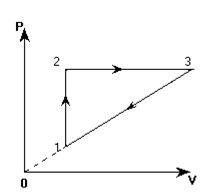 Газ последовательно переводится из состояния "1" с температурой Т1 в состояние "2" с температурой Т2, а затем - в состояние "3" с температурой Т3 и возвращается в состояние "1". Определить температуру Т3, если процессы изменения состояний происходили так, как показано на графике. Температуры Т1 и Т2 считать известными.
Газ последовательно переводится из состояния "1" с температурой Т1 в состояние "2" с температурой Т2, а затем - в состояние "3" с температурой Т3 и возвращается в состояние "1". Определить температуру Т3, если процессы изменения состояний происходили так, как показано на графике. Температуры Т1 и Т2 считать известными.
Решение
1. Переход "1"-"2". Изохорный процесс (V = const): 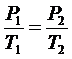 .
.
2. Переход "2"-"3". Изобарный процесс (P = const): 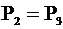 .
.
3. Переход "3"-"1" не является изопроцессом. Для него справедлив объединенный газовый закон:
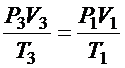 .
.
Из (3) выразим Т3: 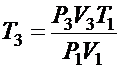 .
.
Но учитывая (2) и (1) 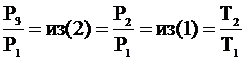 и чтобы найти отношение
и чтобы найти отношение 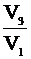 , воспользуемся тем, что прямая 1-3 проходит через начало координат. Это значит, что объем прямо пропорционален давлению (V ~ P).
, воспользуемся тем, что прямая 1-3 проходит через начало координат. Это значит, что объем прямо пропорционален давлению (V ~ P).
Значит, 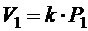 , а
, а 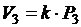 , где k – коэффициент пропорциональности.
, где k – коэффициент пропорциональности.
Отсюда получаем: 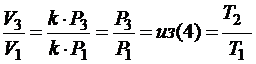
и теперь выражаем Т3: 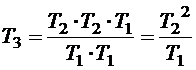 .
.
Ответ: 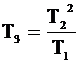
 Задача 15
Задача 15
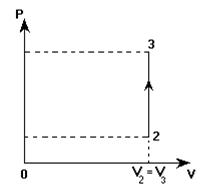
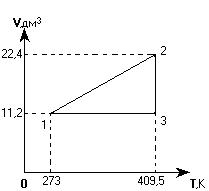
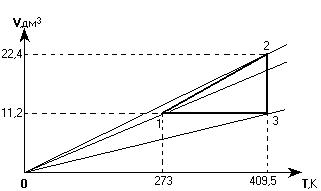
На графике изображен замкнутый процесс, который совершает некоторая масса азота. Известно, что минимальное давление газа в этом процессе Рmin = 3×105 Па. Определить массу газа и его давление в точке «1». Значения V1, V2, T1 и Т2 указаны на графике.
 Решение
Решение
Сначала изобразим этот процесс в системе координат, где точка пересечения осей координат является "нулем" и для абсолютной температуры, и для объема газа.
По наклону изобар определяем, в какой из точек давление наименьшее. Это точка «2», а не точка «1», как ошибочно можно было принять до перестраивания графика.
Теперь решаем задачу, применяя объединенный газовый закон для газа в точках «1» и «2», а также используя следующие данные:
| Р2 = 3×105 Па V2 = 22,4×10-3 м3 Т2 = 409,5 К V1 = 11,2×10-3 м3 Т1 = 273 К Мr = 28 | Применим объединенный газовый закон для точек «1» и «2»: 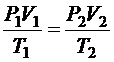 .
Находим Р1: .
Находим Р1: 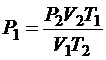 , ,
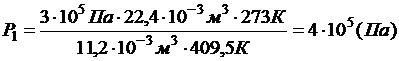 .
Для точки «2» применимо уравнение Клапейрона-Менделеева: .
Для точки «2» применимо уравнение Клапейрона-Менделеева:
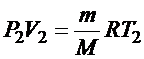 Из него найдем массу газа:
Из него найдем массу газа: 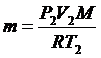
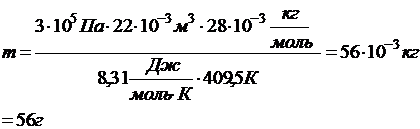 Ответ: Р1 = 4×105 Па, m = 56 г.
Ответ: Р1 = 4×105 Па, m = 56 г.
|
| Р1 -? m -? |
Задача 16
В закрытом баллоне объемом 20 л находилась смесь кислорода и водорода в количествах 10 г и 1 г соответственно. В результате реакции температура возросла от 00С до 1000С. Каково давление в баллоне до и после реакции, если конденсации водяных паров не произошло?
Решение
| V = 2 ×10-2 м3 m1 = 10-2 кг Мr1 = 32 m2 = 10-3 кг Мr2 = 2 Т1 = 273 К Т2 = 373 К | 1. До реакции
Давление в баллоне по закону Дальтона равно сумме парциальных давлений кислорода и водорода: 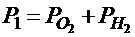 .
Парциальные давления кислорода и водорода найдем из уравнений Клапейрона-Менделеева: .
Парциальные давления кислорода и водорода найдем из уравнений Клапейрона-Менделеева: 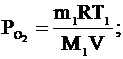  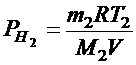 .
Итак, давление в баллоне до реакции равно: .
Итак, давление в баллоне до реакции равно:
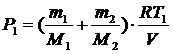
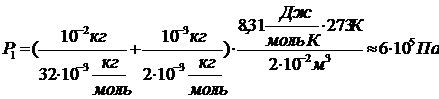 .
Итак, давление в баллоне до реакции равно 6×105Па.
2. После реакции (Н2 + О = Н2О)
Водород и кислород вступают в реакцию в соотношении 1:8. Значит, в реакцию вступили 1 г водорода и 8 г кислорода (образовав 9 г водяного пара), а 2 г кислорода не прореагировали.
Давление в баллоне обусловлено давлением остатков кислорода (m¢ = 2г) и давлением водяных паров ( .
Итак, давление в баллоне до реакции равно 6×105Па.
2. После реакции (Н2 + О = Н2О)
Водород и кислород вступают в реакцию в соотношении 1:8. Значит, в реакцию вступили 1 г водорода и 8 г кислорода (образовав 9 г водяного пара), а 2 г кислорода не прореагировали.
Давление в баллоне обусловлено давлением остатков кислорода (m¢ = 2г) и давлением водяных паров (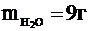 ): ): 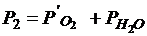 .
Из уравнений Клапейрона-Менделеева для остатка кислорода и для водяного пара выразим их давления и применим закон Дальтона, чтобы найти давление в сосуде после реакции: .
Из уравнений Клапейрона-Менделеева для остатка кислорода и для водяного пара выразим их давления и применим закон Дальтона, чтобы найти давление в сосуде после реакции:
|
| Р1 -? Р2 -? | |
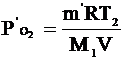 - давление остатка кислорода; - давление остатка кислорода;
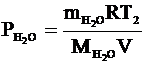 - давление водяного пара; - давление водяного пара;
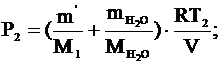
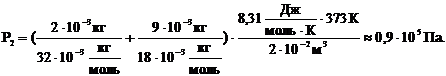 Ответ: Р1 = 6×105 Па, Р2 = 0,9×105 Па.
Ответ: Р1 = 6×105 Па, Р2 = 0,9×105 Па.
|