Изопроцессы. Газовые законы
Макропараметры и универсальная газовая постоянная
Для модели идеального газа используется предположение, что молекулы газа взаимодействуют между собой и со стенками сосуда только во время упругих столкновений. Исходя из этой модели, можно получить соотношение
p = nkT,
которое связывает давление газа с его температурой и концентрацией молекул. Это соотношение может быть записано в другой форме, устанавливающей связь между макроскопическими параметрами газа – объёмом V, давлением p, температурой T и количеством вещества ν. Для этого нужно использовать равенства
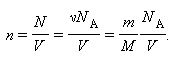
Здесь N – число молекул в сосуде, N A – постоянная Авогадро, m – масса газа в сосуде, M – молярная масса газа. В итоге получим:
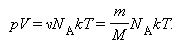
Произведение постоянной Авогадро N A на постоянную Больцмана k называется универсальной газовой постоянной и обозначается буквой R. Её численное значение в системе СИ есть: R = 8,31 Дж/моль·К.
Термодинамические характеристики идеального газа описываются одним простым уравнением:
pV = νRT,
где ν есть отношение количества вещества газа к количесту вещества содержащемся в одном моле газа ν = m/M, и называется уравнением состояния идеального газа. Иногда его называют уравнением Клапейрона-Менделеева.
Для одного моля любого газа это соотношение принимает вид:
pV = RT.
Если температура газа равна T н = 273,15 К (0 С), а давление p н = 1 атм = 1,013·105 Па, то говорят, что газ находится при нормальных условиях.
Уравнение, устанавливающее связь между давлением, объёмом и температурой газа, было получено в 1834 году французским физиком Б. Клапейроном, в форме pV / T = const.
В 1874 году российский учёный Д.И. Менделеев объединил закон А. Авогадро и уравнение Б. Клапейрона и получил уравнение, которое позволяет использовать уравнение состояния идеального газа для практического применения.
Как следует из уравнения состояния идеального газа, один моль любого газа при нормальных условиях занимает один и тот же объём V 0, равный
V 0 = 0,0224 м3/моль = 22,4 дм3/моль.
Это утверждение называется законом Авогадро.
В равных объёмах различных газов при постоянных температуре и давлении содержится одинаковое число молекул.
в ХХ веке Б. Клапейрон получил уравнение, показывающее связь между давлением и температурой:
pV=νRT=mMRTpV=νRT=mMRT.
Впоследствии оно было записано Д.И. Менделеевым. Позже его назвали уравнением Клапейрона-Менделеева.
Изопроцессы. Газовые законы: закон Бойля-Мариотта, закон Шарля, закон Гей-Люссака
Задолго до того, как уравнение состояния идеального газа было теоретически получено на основе молекулярно-кинетической модели, закономерности поведения газов в различных условиях были хорошо изучены экспериментально Поэтому уравнение Клайперона-Менделеева можно рассматривать как обобщение опытных фактов, которые находят объяснение в молекулярно-кинетической теории.
Газ может участвовать в различных тепловых процессах, при которых могут изменяться все параметры, описывающие его состояние (p, V и T).
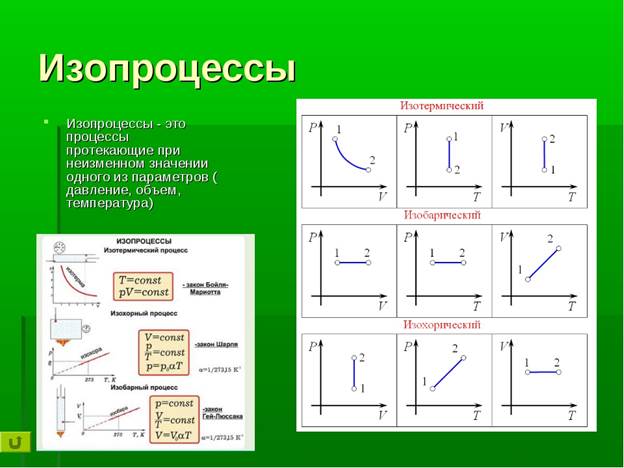
Интерес представляют процессы, в которых один из параметров p, V или T остаётся неизменным. Такие процессы называются изопроцессами.
Определение: При неизменном одном параметре из (p, Vp, V или TT) процесс принято называть изопроцессом.
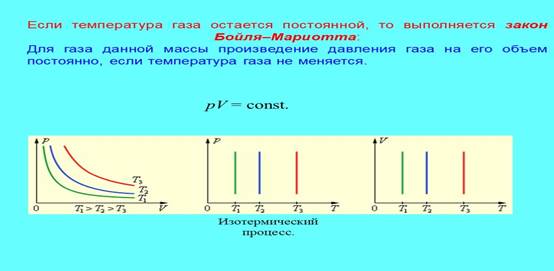
Изотермический процесс (T= const):
Из уравнения pV=νRT=mMRTpV=νRT=mMRT имеем, что неизменные температура Т с количеством вещества ν – это постоянное состояние для произведения значения давления газа p на его объем V: pV=const.
Уравнение изотермического процесса было получено из эксперимента английским физиком Р. Бойлем (1662 г.) и независимо от него французским физиком Э. Мариоттом (1676 г.). Поэтому это уравнение называют законом Бойля–Мариотта.
Изображение изотермических процессов на плоскости (p, V) предусматривает различные значения температур Т Они получили название изотермов.
Изохорный процесс (V=const)-
это процесс квазистатического нагревания или охлаждения газа при постоянном объёме V (V= const) и при условии, что количество вещества ν в сосуде остается неизменным.
Как следует из уравнения состояния идеального газа, при этих условиях давление газа p изменяется прямо пропорционально его абсолютной температуре: p ~ T или
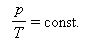
На плоскости (p, T) изохорные процессы для заданного количества вещества ν при различных значениях объёма V изображаются семейством прямых линий, которые называются изохорами. (Большим значениям объёма соответствуют изохоры с меньшим наклоном по отношению к оси температур.)
Экспериментально зависимость давления газа от температуры исследовал французский физик Ж. Шарль (1787 г.), поэтому уравнение изохорного процесса называется законом Шарля. При постоянном давлении объём газа пропорционален его температуре.

Изобарным процессом называют квазистатический процесс, протекающий при неизменном давлении p (p= const).
Уравнение изобарного процесса для некоторого неизменного количества вещества ν имеет вид:
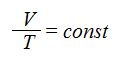
На плоскости (V, T) изобарные процессы при разных значениях давления p изображаются семейством прямых линий, которые называются изобарами.
Зависимость объёма газа от температуры при неизменном давлении была экспериментально исследована французским физиком Ж. Гей-Люссаком (1862 г.), поэтому уравнение изобарного процесса называют законом Гей-Люссака.

Закон Дальтона Давление смеси газов, не взаимодействующих друг с другом химически, равно сумме парциальных давлений этих газов.
Джон Дальтон сформулировал этот закон в 1801 году, хотя молекулярно-кинетическая теория газов (модель, описывающая поведение газов), из которой этот закон непосредственно вытекает, была разработана позже – уже в середине XIX века. Давление газа на стенки сосуда представляет собой результат столкновения молекул газа с этими стенками. Рассматривая газ с этих позиций, нетрудно понять, что количество столкновений со стенкой молекул каждого вида будет зависеть от того, сколько молекул этого вида присутствует в газе. А из этого следует, что общее давление, представляющее собой сумму столкновений всех молекул, получается при сложении числа столкновений молекул каждого вида.
Закон Грэма: Чем меньше плотность идеального газа, тем больше скорость его истечения через микроскопические отверстия в стенках сосуда
Закон Грэма примен яется при конструировании космических кораблей, предназначенных для длительного нахождения человека в космосе. Корабль, конечно, отличается от воздушного шарика, но с течением времени воздух будет просачиваться через материал, из которого сделан корпус, так же, как он просачивается через оболочку шарика.
Таблица открытий
| 1662 г. | – | Закон Бойля—Мариотта |
| 1787 г. | – | Закон Шарля |
| 1798 г. | – | Механическая теория теплоты ( |
| 1801 г. | – | Закон Дальтона |
| 1811 г. | – | Закон Авогадро |
| 1827 г. | – | Броуновское движение |
| 1829 г. | – | Закон Грэма |
| 1834 г. | – | Уравнение состояния идеального газа |
| 1849 г. | – | Молекулярно-кинетическая теория) |
| 1874 г. | – | Закон Менделеева |