Система для анализа клеток Cellavista. Cellavistaпредставляет собой полностью автоматизированную систему для анализа клеток, которая позволяет получать как флуоресцентные изображения клеток, так и микрофотографии в светом поле.Оптическая система прибора снабжена пятью объективами: 2x, 4x, 10x, 20x and 40x, а также CCD–камерой, которая позволяет получать 4 Мпикс изображения. С помощью Cellavistaможно анализировать клетки, помещенные в культуральные планшеты 6, 24, 96-луночные, либо на предметные стекла. Области применения Cellavista: конфлюэнцию и морфологию клеток, клонирование единичных клеток, оценка экспрессии по флуоресценции белков, подсчет и характеристика клеточных ядер, оценка эффективности трансфекции, контроль качества планшетов, подсчет клеток в суспензии, изучение вирусных бляшек, изучение апоптоза, изучение слияния клеток и многие другие функции.
Для получения изображений микропланшет с клетками помещают в устройство и устанавливают настройки изображения (коэффициент усиления, интенсивность и время облучения, фокус). В зависимости от типа анализа могут быть установлены различные параметры для анализа полученных изображений: число клеток, кластеры клеток, колонии и т.д.
Описание образца: Гель для внутрикожных инъекций «НЕОКОЛЛ+» во флаконах по 3мл. по ТУ 9385-059-05664012-2017, экспериментальная серия.
Линия клеток: DK-4 штамм диплоидных клеток из кожно-мышечной ткани эмбриона человека получен из коллекции ФБУН ГНЦ ВБ «Вектор» Роспотребнадзора. Клетки фибробластоподобные с ядрами овальной формы. Монослойный способ культивирования. Бактерии, грибы, микоплазмы и вирусы в культуре клеток не обнаружены.
Условия культивирования: Клетки выращивали в ростовой питательной среде Игла МЕМ (ФБУН ГНЦ ВБ «Вектор» Роспотребнадзора, Россия) с 10 % сыворотки крови плодов коровы (Gibco, США), 200 мМ L-глютамина, 40 мкг/мл гентамицина в CO2 инкубаторе при 37 оС. Посевная концентрация составляла (0,5-1,0)х106 клеток в 1 мл, кратность рассева 1:3, клетки пересевали каждые 3 − 4 суток. Для пересева культур клеток в качестве диспергента применяли 0,25 %-ный раствор трипсина (ФБУН ГНЦ ВБ «Вектор» Роспотребнадзора, Россия) и 0,02 %-ный раствор версена (ФБУН ГНЦ ВБ «Вектор» Роспотребнадзора, Россия) в соотношении 1:2.
|
|
Контроли. В качестве контролей использована ростовая питательная среда с 10 % сыворотки. В качестве препарата сравнения использован «Имплантат для подкожного введения NCTF 135 во флаконах объемом 5 мл» производства FilorgaS.A.S. 2-4, ruedeLisbonne 75008 Paris (Франция), Регистрационный номер медицинского изделия ФСЗ 2008/02524, а также препарат «DermahealHSR» производства Caregen (республика Корея).
Оценка влияния препаратов на морфологию клеток с помощью системы Cellavista. Клетки рассевали в 96-луночные культуральные планшеты в концентрации 7 – 10 х 103 клеток/лунка, инкубировали в течение 24 часов при 37оС в увлажненной атмосфере, содержащей 5% двуокиси углерода (стандартные условия). Посевная концентрация клеток устанавливалась с таким расчетом, чтобы воздействие проходило в экспоненциальной (логарифмической) фазе роста клеток. Далее в планшеты вносили препараты в широком диапазоне концентраций (0,7 – 90%) и совместно культивировали в течение 72 часа при стандартных условиях культивирования.После чего планшет с клетками помещали в систему Cellavista,с помощью которой получали изображения клеток в световом поле,используя объектив х20, и анализировали полученные изображения с помощью функции «Cell confluence» (конфлюэнция клеток)программного обеспечения Cellavistasoftware.
|
|
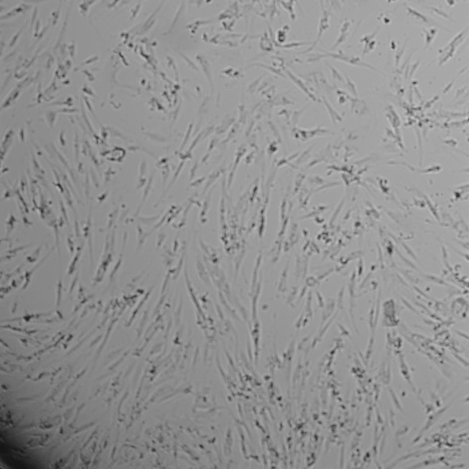
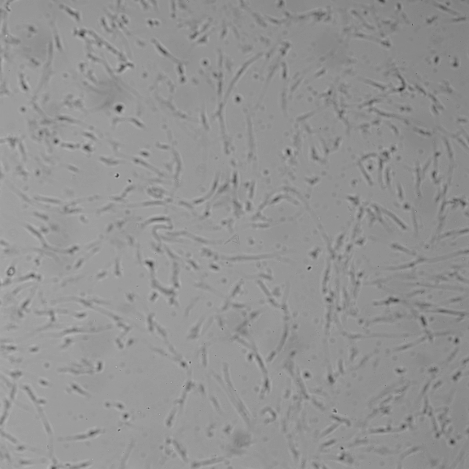
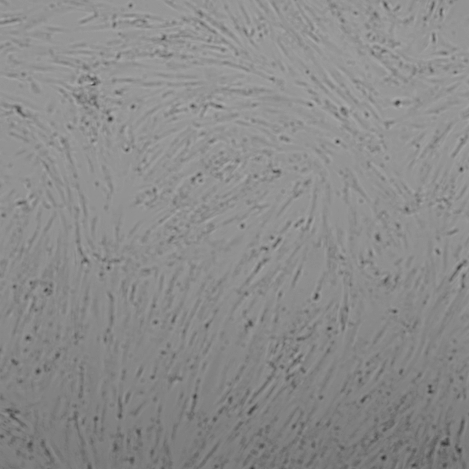
Результат исследований: Гель для внутрикожных инъекций «НЕОКОЛЛ+» во всех исследуемых концентрациях не оказывал влияние на морфологию фибробластов человека (рис. 2). Через 72 часа совместного культивирования клеток с препаратом «НЕОКОЛЛ+» во всех исследуемых концентрациях уровень конфлюэнции (% поверхности культуральной посуды, занятой клетками) клеточного монослоя составил 90 – 100 %, также как и в контроле.Тогда как, при добавлении в культуру клеток 22,5 – 90 % препаратасравнения «Dermaheal HSR» (Caregen, Корея) наблюдалось выраженное цитотоксическое действие на клетки, частичная или полная деструкция монослоя клеток, повреждение отдельных клеток и образование клеточного детрита.При совместном культивировании препарата NCTF 135 (Filorga, Франция) изменения морфологии клеток не наблюдалось, однако конфлюэнция клеточного монослоя при культивировании с 90 % этого препарата была снижена до 70 % по сравнению с контролем.
Заключение: Гель для внутрикожных инъекций «НЕОКОЛЛ+» во всех исследуемых концентрациях не вызывал морфологических изменений фибробластов человека и снижение уровня конфлюэнции клеточного монослоя по сравнению с контролем.
| Концентрация препарата, % | НЕОКОЛЛ+ (Россия) | NCTF 135 (Filorga, Франция) | Dermaheal HSR (Caregen, Корея) | Контроль |
| 90 % | 
| 
| 
| 
|
| 45 % | 
| 
| 
| |
| 22,5 % | 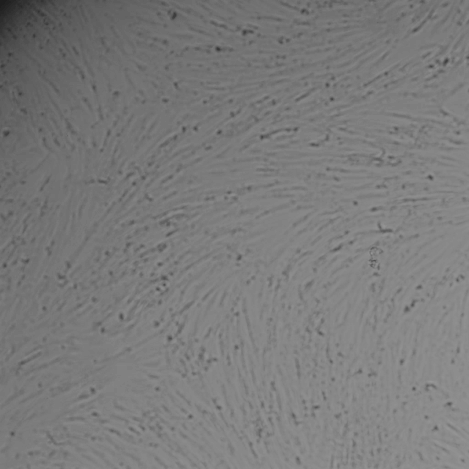
| 
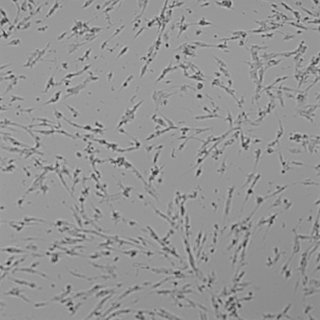
| 
| |
| 11,25 % | 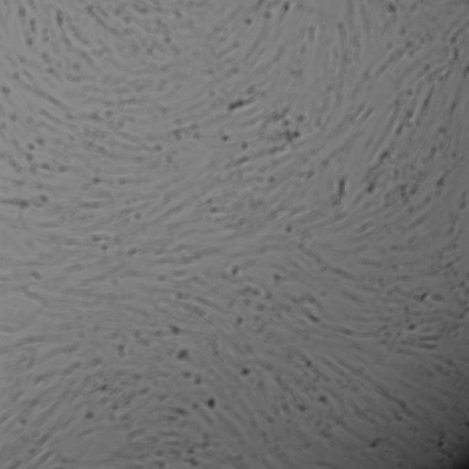
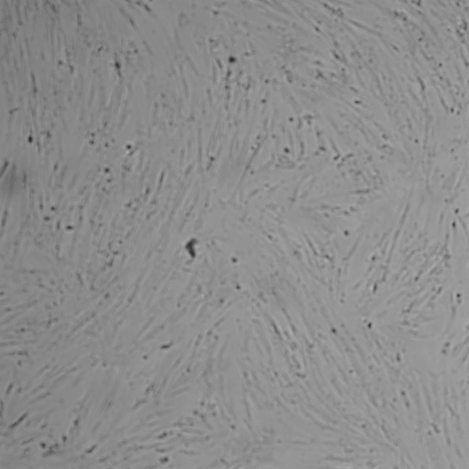
| 
| 
|
|
|
Рис. 2. Световая микроскопия фибробластов человека совместно культивированных с препаратом «НЕОКОЛЛ+», а также с препаратами сравнения NCTF 135 (Filorga, Франция) и Dermaheal HSR (Caregen, Корея) в концентрациях: 11,25 %, 22,5 %, 45 %, 90 %. В качестве контроля использована ростовая питательная среда с 10 % сыворотки. Изображения получены с помощью системы Cellavista(объектив х20).
Исследование влияния препаратов на апоптоз и пролиферацию клеток с помощью системы Cellavista.
Влияние препаратов на апоптоз и пролиферацию клеток оценивали путем окрашивания клеток ядерным флуоресцентным красителем Hoechst 33342[Y. Lee and E. Shacter, J. Biol. Chem., 1999].
Клетки рассевали в 96-луночные культуральные планшеты в концентрации 7 – 10 х 103 клеток/лунка, инкубировали в течение 24 часов при 37оС в увлажненной атмосфере, содержащей 5% двуокиси углерода (стандартные условия). Посевная концентрация клеток устанавливалась с таким расчетом, чтобы воздействие проходило в экспоненциальной (логарифмической) фазе роста клеток. Далее в планшеты вносили препараты в широком диапазоне концентраций (0,7 – 90%) и совместно культивировали в течение 72 часа при стандартных условиях культивирования.После этого клетки окрашивали красителем Hoechst 33342 (Sigma-Aldrich, США) в течении 30 минут при 37 oC, после чего клетки трижды отмывали фосфатно-солевым буфером. Система Cellavistaбыла использована для автоматического получения изображений клеток минимум в 6 полях/лунку, используя объектив х20, в световом поле и флуоресцентном канале. Количество апоптотических и делящихсяклеток анализировали с помощью программного обеспечения Cellavistasoftware.
. 
Live – живые клетки, Apoptotic – клетки в апоптозе.
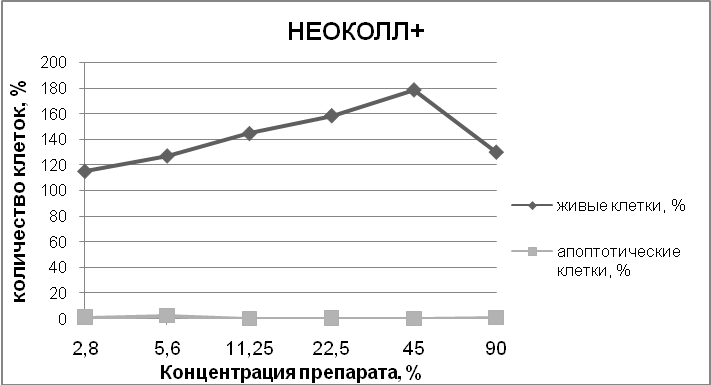
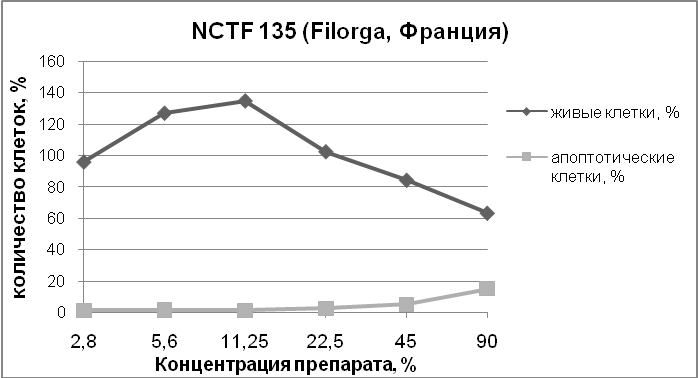

Рис. 3. Количество живых и апоптотических клеток после совместного культивирования в течение 72 часов с препаратами BiomatrixMeso, NCTF 135, DermahealHSR, клетки окрашивали ядерным красителем Hoechst 33342. Изображения получали и анализировали с помощью системы Cellavista.
Результат исследований: гель для внутрикожных инъекций «НЕОКОЛЛ+» значительно стимулировал пролиферацию фибробластов человека в концентрации 11,25 – 90 %, при этом число апоптотических клеток по сравнению с контролем было снижено.Препарат сравнения DermahealHSR значительно снижал количество живых клеток в культуре в концентрации 22,5 – 90 % при этом число апоптотических клеток было значительно увеличено.Другой препарат сравнения NCTF 135 (Filorga, Франция) в концентрации 5,6 – 11,25 % стимулировал пролиферацию клеток, а в дозе 45 – 90 % снижал количество живых клеток и увеличивал число клеток в апоптозе.
Заключение: Экспериментально доказано, что гель для внутрикожных инъекций «НЕОКОЛЛ+»стимулирует пролиферацию фибробластов человека, снижая при этом число апоптотических клеток.
ВЫВОДЫ
1. В экспериментах на животных доказано, что гель для внутрикожных инъекций «НЕОКОЛЛ+» в дозе 1 мл/животное нетоксичен.
2. Исследована пирогенность препарата, гель «НЕОКОЛЛ+» в дозе 1 мл/животное непирогенен.
3. Препарат «НЕОКОЛЛ+»стерилен.
4. pHпрепарата экспериментальной серии препарата «НЕОКОЛЛ+» составляет 7,2 ед.
5. С помощью МТТ-теста доказано, что гель для внутрикожных инъекций «НЕОКОЛЛ+» не оказывал цитотоксическое влияние на фибробласты человека, напротив препарат стимулировал пролиферацию клеток в концентрации от 2,8 – 90 %.
6. С помощью системы Cellavistaустановлено, что препарат «НЕОКОЛЛ+» во всех исследуемых концентрациях не вызывал морфологических изменений фибробластов человека и снижение уровня конфлюэнции клеточного монослоя по сравнению с контролем.
7. С помощью системы Cellavistaпоказано, что препарат стимулирует пролиферацию фибробластов человека, снижая при этом число апоптотических клеток.