| Г |
орение всегда сопровождается химическими превращениями. Горение в среде воздуха - взаимодействием горючего вещества с кислородом. Однако следует иметь в виду, что окислителями в процессе горения могут выступать окислы азота, галоиды, озон. Известны процессы горения, протекающие с участием только одного исходного продукта - соединения, способного к быстрому распаду. Примерами таких соединений являются ацетилен и гидразин.
Химические процессы, протекающие при горении, чрезвычайно сложны. Даже для простейшего случая - горения водорода в кислороде, обобщенное уравнение которого имеет вид
2Н2 + 02 = 2Н20,
установлено и изучено несколько десятков элементарных стадий.
К настоящему времени достаточно подробно исследованы механизмы химических превращений при горении лишь нескольких веществ: водорода, оксида углерода, метана и этана. Эти знания используются для прогнозирования условий воспламенения и горения многих веществ.
2.1. Цепные реакции
Цепные реакции в отличие от обычных химических превращений характеризуются возникновением в каждом элементарном акте активной частицы: атома, обладающего неспаренным электроном, свободного радикала или иона. Появление активных частиц вызывает цепь превращений исходных веществ в продукты реакции. Атомы, свободные радикалы и ионы более реакционноспособны, чем валентнонасыщенные молекулы. Поэтому, несмотря на значительные затраты энергии, необходимые для разрыва химических связей и образование активных частиц, цепное развитие реакции зачастую оказывается энергетически выгоднее, чем непосредственное взаимодействие между молекулами.
Глава 2. Химические процессы при горении
|
|
Процессы горения в основном протекают по цепному механизму. Цепные реакции - сложные реакции, протекающие в несколько стадий, представляющих собой:
- зарождение цепей (инициирование), при котором образуются активные частицы;
- продолжение цепей, при которой активные частицы вступают в химическое взаимодействие с исходными веществами, в результате чего образуются новые активные частицы;
- обрыв цепей, при котором происходит «гибель» активных частиц с образованием конечных продуктов реакции
Зарождение цепей может происходить при различных условиях. Например, в результате диссоциации молекул под действием тепловой энергии, или ионизирующих излучений, в электрическом разряде. Гибель активных частиц происходит при их рекомбинации*, при взаимодействии свободных радикалов (гомогенный обрыв цепей), при взаимодействии активных частиц с твердыми поверхностями (гетерогенный обрыв цепей) или в результате их реакции с ингибиторами горения.
Существуют неразветвленные и разветвленные цепные реакции. В неразветвленных на каждую активную частицу, израсходованную в реакциях продолжения цепи, приходится одна вновь возникающая. Число образовавшихся молекул продуктов на одну начальную активную частицу называется длиной цепи. Длина цепей в реакциях горения колеблется от сотен тысяч до десятков миллионов. На скорость неразветвленных цепных реакций могут влиять незначительные примеси веществ, способные эффективно взаимодействовать с активными частицами - ингибиторами горения.
Некоторые вещества - инициаторы - облегчают образование активных частиц и тем самым ускоряют неразветвленные цепные реакции.
|
|
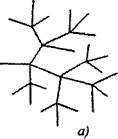
В разветвленных цепных реакциях на одну активную частицу, расходующуюся при продолжении цепи, образуются две или более активные частицы. Одна из них продолжает первичную цепь, а другие начинают новые цепи, образуя разветвления (рис. 2.1).
" Рекомбинация — процесс образования нейтральных атомов или молекул из заряженных частиц. Образующиеся при рекомбинации атомы и молекулы могут находиться в основном или возбужденном состоянии.
Корольченко А.Я. Процессы горения и взрыва
|
б)
Рис. 2.1. Схематическое изображение реакционных цепей:
а) разветвление в каждом звене цепи
6) редкое разветвление
Например, при горении водорода в реакции зарождения цепи:
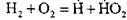
образуется активный атом  . В реакции продолжения цепи:
. В реакции продолжения цепи:
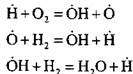
происходит увеличение числа активных атомов, являющихся началом новых цепей.
Разветвленные цепные реакции могут протекать в стационарном режиме, при котором скорость разветвления меньше скорости гибели активных частиц, и в нестационарном, при котором гибель происходит медленнее, чем разветвление. В последнем случае скорость цепной реакции возрастает по экспоненциальному закону и лимитируется только расходованием исходных веществ. Переход от стационарного к нестационарному режиму происходит скачкообразно при незначительном изменении условий протекания реакции: температуры, давления или концентрации одного из реагирующих веществ. Такое быстрое ускорение рассматривается как самовоспламенение реакционной смеси или цепной взрыв.
|
|
Открытие разветвленных цепных реакций имело огромное значение для создания теории процессов горения. Доказано, что существует два типа воспламенения: тепловое и цепное. Закономерности, установленные в
Глава 2. Химические процессы при горении
теории цепных процессов, позволяют эффективно влиять на развитие и подавление процессов горения при пожарах.
Зарождение цепей. Процесс зарождения начальных активных центров играет большую роль в развитии неразветвленных цепных реакций. Он компенсирует убыль активных центров при реакциях обрыва цепи. Этот механизм определяет условия формирования стационарного режима в начальной период накопления активных центров. При небольшой скорости инициирования этот период может быть значительным.
Большинство химических реакций в пламенах отличается значительным запасом энергии активных центров. В этих условиях инициирование активных центров связано с преодолением значительного энергетического барьера.
При этом важную роль играют факторы, обеспечивающие значительную скорость возникновения активных центров: химически активные добавки, излучение, электрический разряд, продукты радиоактивного распада.
Среди факторов, значительно облегчающих генерирование активных центров, следует отметить гетерогенные реакции. В молекулах горючих веществ, адсорбированных на твердой поверхности, межатомные связи ослаблены и для их разрыва требуется меньшая затрата энергии. В этих условиях скорость генерирования активных центров существенно выше, чем в газовом объеме. Энергия активации при гетерогенном взаимодействии компонентов горючей смеси также ниже, чем при гомогенном. Гетерогенное инициирование активных центров в условиях протекания реальных процессов горения представляет собой важный фактор ускоренного достижения стационарного режима при неразветвленных цепных процессах.
Некоторые особенности характеризуют неразветвленные цепные реакции, протекающие с участием атомарных компонентов. В отсутствие примесей, взаимодействующих с активными центрами без регенерации, обрыв цепей становится возможным только при рекомбинации атомов путем тройных соударений и на поверхности.
При любой температуре все газообразные вещества частично диссоциированы. Некоторая часть молекул распадается на атомы. При этом существует равновесие между процессами диссоциации и объединением атомов в молекулы. Степень диссоциации экспоненциально зависит от температуры.
Если в горючей смеси отсутствуют примеси, обрывающие цепи, то концентрация атомарных компонентов реакции практически не изменяется. Вступившие в реакцию атомы тотчас регенерируются в таком же ко-
Корольченко А.Я. Процессы горения и взрыва
личестве. Начальное инициирование компенсирует прореагировавшие атомы в том же количестве, что и в нереагирующей системе. Стационарная реакция не влияет на этот процесс. Равновесие одного их компонентов реакции, отличающегося наименее прочной связью между атомами в молекуле, является характерной особенностью подобного режима. Концентрация другого атомарного компонента при этом квазистационарна, но больше равновесной.
При гомогенном инициировании реакций горения стационарный режим установится только спустя некоторый промежуток времени, поскольку диссоциация требует большой энергии активации. В течение этого периода скорость диссоциации превосходит скорость рекомбинации, и в реагирующей системе происходит накопление активных центров. Скорости обоих процессов сравниваются только после увеличения концентрации активных центров до равновесной. Этот промежуток времени называется периодом индукции.
Присутствие в качестве катализатора в зоне реакции твердой поверхности не изменяет состояние термодинамического равновесия. Катализатор в равной степени влияет на прямую и обратную реакции. Активные центры не только зарождаются на твердой поверхности, но и обрываются на ней. Однако присутствие катализатора ускоряет достижение состояния равновесия диссоциации.
Если в горючей смеси присутствуют активные примеси, способные участвовать в реакциях обрыва цепей, то они снижают концентрации активных центров. При этом нарушается равновесная диссоциация одного из исходных компонентов, что замедляет реакцию и может привести к ее прекращению.
Эксперименты показывают, что при инициировании неразветвлен-ной цепной реакции внешним источником (например, источником света) концентрация активных центров на начальном этапе развития процесса горения может существенно превосходить равновесную.
При протекании разветвленных цепных реакций условия начального инициирования оказывают существенное влияние на развитие реакции. У медленно развивающихся процессов добавление частично прореагировавшей смеси к исходной сокращает период индукции и ускоряет момент возникновения пламенного горения.
Продолжение цепей. Характерной особенностью неразветвленных цепных реакций является квазистационарность концентрации активных центров. При отсутствии обрыва цепей активные частицы образуются в
Глава 2. Химические процессы при горении
таком же количестве, в котором и расходуются. Новые возникают лишь при начальном инициировании. При равенстве скоростей генерирования активных центров и обрыва цепей устанавливается постоянная концентрация активных центров и стационарный режим реакции. Скорость реакции будет снижаться по мере расходования исходных компонентов.
В случае протекания разветвленной цепной реакции концентрация активных центров в реагирующей системе возрастает независимо от условий их начального инициирования. Реализуется самоускоряющийся режим реакции, имеющий лавинообразный характер. В этом случае для полного превращения исходных компонентов в конечные продукты реакции достаточно одного начального активного центра.
Кинетическое уравнение разветвленной ценной реакции выглядит следующим образом. Изменением концентраций устойчивых исходных компонентов во времени в первом приближении можно пренебречь, а учитывать только более быстрые изменения концентрации активных центров п. Изменения этой скорости определяется скоростью начального инициирования 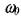 и соотношением скоростей реакций разветвления и обрыва цепей. Скорость начального инициирования не зависит от концентрации присутствующих в системе активных центров. Скорости процессов разветвления и обрыва пропорциональны концентрациям активных центров. При этих условиях общий баланс образования и расходования активных центров определяется суммой скоростей процессов инициирования, разветвления и обрыва:
и соотношением скоростей реакций разветвления и обрыва цепей. Скорость начального инициирования не зависит от концентрации присутствующих в системе активных центров. Скорости процессов разветвления и обрыва пропорциональны концентрациям активных центров. При этих условиях общий баланс образования и расходования активных центров определяется суммой скоростей процессов инициирования, разветвления и обрыва:
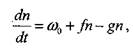 (2.1)
(2.1)
где  и
и  - константы скоростей реакций разветвления и обрыва. Обозначив
- константы скоростей реакций разветвления и обрыва. Обозначив  , получим:
, получим:
 (2.2)
(2.2)
При  производная по времени концентрации активных центров
производная по времени концентрации активных центров
положительна. При этом скорость реакции возрастает во времени. Эта особенность разветвленных цепных реакций обусловлена размножением активных центров при таких режимах, когда скорость реакции разветвления превышает скорость реакции обрыва цепей.
Корольченко А.Я. Процессы горения и взрыва
Если до начала реакции система не содержала активные центры, т.е. при t = 0, n = 0 интегрирование уравнения (2.2) дает:
 (2.3)
(2.3)
Суммарная скорость реакции СО определяется скоростью процесса разветвления. Конечные продукты образуются только при этой реакции. На каждый элементарный акт разветвления цепи образуются  молекул конечного продукта. Из этого следует:
молекул конечного продукта. Из этого следует:
 (2.4)
(2.4)
Развитие цепной реакции во времени определяется соотношением констант скоростей реакций разветвления и обрыва цепей  и
и  При
При  т.е. при
т.е. при  показатель экспоненты в уравнении (2.4) положителен и ре-
показатель экспоненты в уравнении (2.4) положителен и ре-
акция неограниченно самоускоряется. В начальный период развития реакции  справедливо соотношение:
справедливо соотношение:
 (2.5)
(2.5)
Вследствие того, что скорость начального инициирования мала, заметное химическое превращение в начальный период отсутствует. Спустя некоторое время величина  становится существенно больше единицы. После этого скорость реакции в соответствии с уравнением (2.4) начинает быстро возрастать и достигает очень больших значений, хотя до этого была практически неощутимой.
становится существенно больше единицы. После этого скорость реакции в соответствии с уравнением (2.4) начинает быстро возрастать и достигает очень больших значений, хотя до этого была практически неощутимой.
Наличие периода задержки (периода индукции) при развитии цепной реакции обусловлено необходимостью накопления в реагирующей системе определенного количества активных центров. Только после этого химическое превращение становится заметным.
Величину периода индукции при цепных реакциях определяют соотношения скоростей процессов разветвления и обрыва цепей, а не скорость начального инициирования. В свою очередь скорости реакций разветвления и обрыва обусловлены химическими особенностями каждой реагирующей системы, определяются зависимостями от температуры и концентраций исходных компонентов. Особенность цепных реакций за-
Глава 2. Химические процессы при горении
ключается в том, что процессы разветвления требуют значительной энергии активации, тогда как температурный коэффициент константы скорости процесса обрыва близок к нулю. У реакций обрыва цепей всех трех типов: при объемной и гетерогенной рекомбинациях, при взаимодействии радикалов с активными примесями энергии активации равны нулю.
При повышении температуры, общего давления смеси или изменении концентрации реагирующих компонентов возможно такое изменение констант скоростей разветвления и обрыва, при котором реакция переходит от стационарного режима к нестационарному. Особенность этого процесса заключается в скачкообразности перехода от одного режима к другому, в изменении скорости реакции от пренебрежимо малой величины к неограниченно возрастающей.
Протекание некоторых цепных реакций сопровождается образованием промежуточных продуктов, отличающихся сравнительной устойчивостью, но при этом обладающих способностью генерировать активные центры. К таким реакциям относятся, например, реакции горения углеводородов, в качестве промежуточных продуктов при которых образуются перекиси и альдегиды. Это приводит к разветвлениям цепи. Однако, вследствие относительной устойчивости промежуточных продуктов ускорение реакции растягивается во времени. Подобные замедленные разветвления цепей называются вырожденными.
Цепные реакции с обычным радикальным механизмом разветвления, как правило, из-за высокой активности радикалов протекают достаточно быстро. Образующиеся радикалы либо инициируют быстро ускоряющуюся реакцию, либо рекомбинируют и выходят из про-цесса.
Обрыв цепей. Активная частица, как и всякая газовая молекула, совершает внутри реагирующей системы хаотические движения, сталкиваясь с другими молекулами. При этом существует определенная вероятность при каком-то столкновении взаимодействия с другой активной частицей или молекулой и образования новой активной частицы, продолжающей путь предыдущей. Развитие цепи реакции аналогично броуновскому движению инертных молекул, хотя перенос активных центров сопровождается химической реакцией. На пути развития цепи чередуются активные центры двух или более типов.
Корольченко А.Я. Процессы горения и взрыва
Цепь реакций продолжается до момента, когда активная частица не вступит в реакцию без регенерации. В этом случае происходит так называемый обрыв цепи. Процессы обрыва играют большую роль в кинетике цепных реакций. Возможны два типа реакций, ведущих к гибели активных центров:
- гомогенный обрыв (гибель в объеме реагирующей смеси);
- гетерогенный обрыв (гибель на твердой поверхности) Гомогенный обрыв цепей возможен при одном из двух процессов:
при рекомбинации радикалов или при взаимодействии различных химически активных компонентов с активными центрами без регенерации последних.
Гетерогенный обрыв цепей происходит на частицах сажи, образующейся при горении, или на поверхности твердых горящих материалов. Обрыв цепей на твердой поверхности можно рассматривать как диффузию активных центров из газовой смеси к этой поверхности, на которой они исчезают. Механизм рекомбинации на твердой поверхности заключается в том, что активная частица, обладающая повышенной реакционной способностью, сорбируется* на поверхности. Сорбированные на соседних участках радикалы рекомбинируют между собой, поскольку для этого процесса не существует энергетических и пространственных препятствий. Образовавшиеся в результате рекомбинации молекулы устойчивых соединений не участвуют больше в развитии цепной реакции.
Однако не каждое соударение активной частицы с твердой поверхностью приводит к ее адсорбции. Возможно ее отражение от поверхности. Вероятность адсорбции активного центра твердой поверхностью называется коэффициентом аккомодации. Этот коэффициент является характеристикой химического сродства активной частицы и поверхности. В практически важных случаях активная частица после отражения от стенки не удаляется от нее далеко. Существует вероятность новых соударений со стенкой до тех пор, пока не произойдет ее аккомодация. Из-за этого процесса в определенных условиях скорость реакции практически не зависит от коэффициента аккомодации. Процесс протекает таким образом, как ес-
* Сорбция - поглощение твердым телом (или жидкостью) вещества га окружающей среды. Поглощающее тело называется сорбентом, поглощаемое - сорбатом. Различают поглощение всей массой сорбента (абсорбция) и поверхностным слоем (адсорбция). Сорбция, обусловленная взаимодействием химического типа между поверхностью твердого сорбента и сорбатом называется хемосорбцией.
__________________________ Глава 2. Химические процессы при горении
ли бы обрыв цепи происходил при каждому соударении. Концентрацию активных центров у поверхности можно принимать равной нулю.
При отсутствии в реагирующей смеси активных примесей обрыв цепей может происходить либо на твердых поверхностях, либо гомогенно путем рекомбинации радикалов в объеме. При реальных пожарах реализуется, в основном, второй путь.
Определенное влияние на кинетику цепных реакций оказывают добавки в реагирующую систему инертных газов. Инертные добавки увеличивают число соударений с активными частицами, увеличивают вероятность обрыва цепей и, соответственно, тормозят общую реакцию.
Более эффективное торможение цепных реакций достигается при введении в реагирующую смесь химически активных добавок - ингибиторов. Ингибиторы взаимодействуют с активными центрами, ведущими реакцию, обрывая цепи. Кинетика реакции в ингибированной смеси определяется условиями конкуренции ингибитора и основных компонентов реакции при взаимодействии с активными центрами. При высокой эффективности ингибитора и умеренной скорости генерирования новых активных центров уже небольшие добавки ингибитора могут полностью подавлять протекание цепной реакции.
Процессы ингибирования имеют большое значение в практике по-жаровзрывобезопасности. Использование ингибиторов позволяет эффективно влиять на процессы горения.
2.2. Химические процессы при горении водорода
Взаимодействие молекулы водорода с молекулой кислорода протекает сложным путем через ряд последовательных стадий. В настоящее время твердо установлено, что горение водорода происходит по цепному механизму, причем роль активных центров играют частицы  . Последовательность и значение элементарных реакций при горении водорода описаны очень подробно для различных условий возникновения и развития водородных пламен.
. Последовательность и значение элементарных реакций при горении водорода описаны очень подробно для различных условий возникновения и развития водородных пламен.
Наиболее подробный анализ процесса горения водорода в режиме самовоспламенения экспериментальным и расчетным методами выполнен профессором А. Н. Баратовым. Им предложена следующая схема процесса, включающая четырнадцать основных элементарных реакций:
Корольченко А.Я. Процессы горения и взрыва
- зарождение активных центров происходит по реакции

- продолжение цепей по реакциям
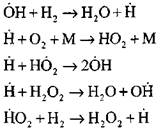
(0)
(1)
(2) (3) (4) (5)
- разветвление цепей

|
(6) (7) (8)
обрыв цепей

|
(9) (10)
(П) (12) (13)
Концентрация атомов водорода в начальной стадии процесса самовоспламенения составляет незначительную часть от начального содержания водорода. При развитии цепной реакции скорость превращения молекулярного водорода становится столь высокой, что он расходуется за сотые доли секунды.
2.3. Химические реакции при горении оксида углерода
Взаимодействие оксида углерода с кислородом представляет собой важнейшую для процессов горения реакцию. Протекание этой реакции во
__________________________ Глава 2. Химические процесс ы при горении
многих случаях определяет закономерности горения углеродсодержащих веществ. Для реакции характерен разветвленный цепной механизм. Она отличается рядом особенностей.
Длительное время существовало убеждение, что абсолютно сухая смесь СО и 02 не может воспламеняться и гореть. Однако тщательно поставленные опыты, в которых отсутствие воды контролировалось с помощью масс-спектрографа, показали, что воспламенение возможно и для сухой смеси. При этом следует отметить, что присутствие в системе СО + 02 паров воды или водорода активизирует процесс воспламенения и горения за счет увеличения количества возможных активных центров. Ускоряющее действие воды особенно заметно при малых ее концентрациях.
Горение оксида углерода в присутствии паров воды или небольших добавок водорода происходит с участием следующих элементарных процессов:

Радикалы, Н02, образующиеся по реакции (VI), могут продолжать цепь (реакция VIII) или приводить к ее обрыву по реакция (IX—XII).
Для оценки условия перехода медленного окисления СО в цепной взрыв оценим вероятность обрыва цепи через радикал Н02; при этом учтем, что роль реакций (X) и (XI) в обрыве цепи будет несущественной по
сравнению с реакцией (IX), поскольку константы скоростей процессов (IX-XI) при температурах порядка 1000К близки между собой, но концентрации радикалов  и
и 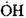 значительно меньше концентрации атомов водорода, поскольку радикалы
значительно меньше концентрации атомов водорода, поскольку радикалы  и
и  обладают большей химической активностью. Поэтому вероятность
обладают большей химической активностью. Поэтому вероятность  обрыва цепи через радикал Н02 может быть записана в виде:
обрыва цепи через радикал Н02 может быть записана в виде:

|
(2.6)
где  - константы скоростей соответствующих реакций.
- константы скоростей соответствующих реакций.
При дальнейшем анализе будем рассматривать лишь систему реакций (I—VII), считая реакцию (VI) обрывом цепи с эффективной константой скорости  Присутствие множителя 2 в этом выражении обу-
Присутствие множителя 2 в этом выражении обу-
словлено тем, что в результате протекания последовательных процессов (VI) и (IX) происходит гибель двух активных центров-атомов Н. Исходя из этого, получено следующее условие перехода окисления СО в цепной взрыв:

|
(2.7)

При температуре 1000К
Поэтому при условии, когда
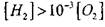
или

влияние величины
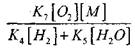
на решение уравнения (2.7) будет слабым.
42.
Глава 2. Химические процессы при горении
В случае  или
или  (что наблюдается в
(что наблюдается в
реальных пламенах СО), уравнение (2.7) преобразуется к виду:
 (2.8)
(2.8)
Таким образом, условие горения оксида углерода в воздухе в значительной степени определяется присутствием и закономерностями горения водорода. Окисление СО по реакции (I) зависит от концентрации радикалов ОН, образующихся в реакциях с участием водорода.
Особенность реакции горения оксида углерода заключается в ее резвом торможении при введении в реагирующую систему малых добавок веществ, обладающих высоким сродством к атомам водорода. Такими веществами, ингибирующими горение СО, являются галоиды и галоиди-роизводные углеводородов. Их ингибирующее действие обусловлено обрывом реакционных цепей при взаимодействии с атомами водорода по реакции

2.4. Горение углеводородов
Рассмотрение процессов горения водорода и оксида углерода показывает сложность механизма реакции горения. В случае Н2 и СО реакция протекает как цепная с участием множества элементарных стадий и про-межуточных продуктов. Поэтому естественно ожидать, что механизм ре-акций горения более сложных по строению веществ - углеводородов еще более сложен и эффекты, сопровождающие процессы воспламенения и горения этих соединений более многообразны.
Имеющиеся в настоящее время сведения о природе химических превышений углеводородов в процессе их горения позволяют с некоторым приближением объяснить наблюдаемые эффекты.
Установлено, что в углеводородных пламенах, наряду с уже известными активными частицами  , присутствует большое количество промежуточных продуктов более сложного строения. В ряде случаев они становятся источниками зарождения новых цепей. Основную роль в процессах воспламенения и горения углеводородов играют следующие типы промежуточных соединений:
, присутствует большое количество промежуточных продуктов более сложного строения. В ряде случаев они становятся источниками зарождения новых цепей. Основную роль в процессах воспламенения и горения углеводородов играют следующие типы промежуточных соединений:
Корольченко А.Я. Процессы горения и взрыва
1. Углеводородные радикалы, представляющие собой молекулу уг
леводорода, у которой удалены один или несколько атомов водорода. Эти
остатки называются алкилами (СНз - метил; С2Н5 - этил; С3Н7 - пропил и
т.д.). Из-за высокой реакционной способности алкилы в свободном виде
длительно не существуют. Присутствуют в пламенах в виде промежуточ
ных продуктов. При взаимодействии с другими молекулами ведут себя
как самостоятельная структурная группа. Углеводородные радикалы
обычно изображают буквой R.
2. Перекиси - соединения общей формулы R-00-R'.
3.Альдегиды - соединения типа

Простейшими альдегидами являются муравьиный (формальдегид)  и уксусный (ацетальдегид)
и уксусный (ацетальдегид)  . Эти вещества все-
. Эти вещества все-
гда присутствуют в продуктах неполного сгорания углеводородов.
Зарождением цепи при горении углеводородов может стать любая реакция, в которой образуются углеводородные радикалы. Это может быть реакция разложения молекулы этана с образованием двух свободных метальных групп:

или реакция углеводорода с кислородом:

Продолжение цепей происходит в результате реакций образования | перекисей или гидроперекиси:

Разветвление цепей осуществляется при разложении гидроперекиси:


Глава 2. Химические процессы при горении
Приведенная последовательность реакций приводит к постепенному увеличению в реагирующей системе концентрации перекисных соединений.
Одновременно с накоплением перекисей, радикалов  и
и  начи-
начи-
нают идти параллельные реакции:
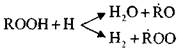
и

Эти реакции экзотермичны; при их протекании выделяется большое количество тепла.
При повышении температуры реагирующей смеси роль активных центров переходит от одних промежуточных продуктов к другим в следующем порядке: гидроперекиси алкилов, ацильные гидроперекиси, формальдегиды.
Экспериментальные исследования изменения состава реагирующей смеси во времени в высокотемпературной области (600-800°С) показывают, что процесс превращения исходных углеводородов в конечные продукты горения  иразделен
иразделен  на две стадии: на первой, протекающей с очень высокой скоростью, происходит окисление углеводородов до СО. На второй, медленной, стадии СО окисляется до
на две стадии: на первой, протекающей с очень высокой скоростью, происходит окисление углеводородов до СО. На второй, медленной, стадии СО окисляется до  . Отсюда следует очень важный вывод: многие закономерности горения углеводородов могут быть объяснены особенностями горения оксида углерода.
. Отсюда следует очень важный вывод: многие закономерности горения углеводородов могут быть объяснены особенностями горения оксида углерода.
2.5. Горение углерода
Горение углерода протекает по механизму гетерогенного процесса, специфика которого заключается в том, что химическую стадию нельзя рассматривать изолированно от процесса переноса газообразного окислителя (кислорода воздуха) из окружающего пространства к поверхности горящего твердого тела. Скорость горения оказывается зависящей как от химических свойств углерода, так и от характеристик, определяющих процесс подвода кислорода к поверхности топлива. Поступление кисло-родав зону горения осуществляется посредством диффузии и поэтому
 Корольченко А.Я. Процессы горения и взрыва
Корольченко А.Я. Процессы горения и взрыва
зависит от многих факторов: формы и размеров горящего тела, движения газовой среды, коэффициентов диффузии кислорода и продуктов реакции как в пространстве над поверхностью топлива, так и в трещинах и порах, содержащихся в угле и коксе в значительных количествах.
Для иллюстрации особенностей гетерогенного горения углерода рассмотрим поведение отдельного кусочка угля, помещенного в нагретую до температуры 900°С печь. В начальный момент горение угля будет происходить за счет кислорода, находящегося вблизи его поверхности. После его израсходования вокруг накаленной поверхности образуется слой продуктов горения -  . Скорость горения снизится, и процесс мог бы прекратиться, если бы не было поступления кислорода из более удаленных областей газового пространства.
. Скорость горения снизится, и процесс мог бы прекратиться, если бы не было поступления кислорода из более удаленных областей газового пространства.
Это поступление происходит посредством диффузии, и скорость горения будет определяться величиной диффузионного потока. Интенсивность диффузии в значительной степени зависит от интенсивности и характера движения газовой среды вблизи горящей поверхности. Скорость химической реакции определяется главным образом температурой. Гетерогенные реакции, так же, как и гомогенные, подчиняются закону Арре-ниуса.
При высокой температуре реакция окисления углерода протекает очень быстро, и суммарная скорость процесса будет лимитироваться диффузией кислорода к поверхности.
Таким образом, процесс горения углерода состоит из двух разных по природе процессов: процесса переноса кислорода воздуха из газового пространства к месту его потребления и процесса его химического взаимодействия с поверхностью твердого углерода. Оба эти процесса взаимосвязаны, но для каждого характерны свои закономерности. Наиболее важным из этих процессов является процесс потребления кислорода, для которого характерно многообразие химических реакций.
Механизм сложной реакции соединения кислорода с углеродом заключается в образовании одновременно двух окислов СО и С02 через промежуточный физико-химический комплекс вида СХ0У, который затем расщепляется на СО и  . Соотношение между этими окислами зависит от условий горения. Соответственно этому уравнение реакции горения углерода может быть записано следующим образом:
. Соотношение между этими окислами зависит от условий горения. Соответственно этому уравнение реакции горения углерода может быть записано следующим образом:

Глава 2. Химические процессы при горении
Затем протекает гомогенная реакция горения оксида углерода:

механизм которой рассмотрен в разделе 2.3.
Эта реакция может протекать как вблизи углеродной поверхности, так и внутри угольной массы, в ее порах и трещинах.
Другая реакция является гетерогенной реакцией между накаленным углеродом и диоксидом углерода:

Она протекает с заметной скоростью в местах, где наблюдается не-хватка кислорода, но где достаточно высока температура углерода.
Совокупность протекания описанных реакций определяет состав продуктов горения углерода.
Глава 3.
ВОЗНИКНОВЕНИЕ ПРОЦЕССОВ ГОРЕНИЯ
| Г |
орение в горючих смесях может возникнуть в результате их самовоспламенения, зажигания внешним источником или самовозгорания. Если процессы самовоспламенения и зажигания характерны для веществ, находящихся в газообразном, жидком или твердом состоянии, то самовозгорание характерно для твердых материалов (особенно находящихся в мелкораздробленном состоянии) или высококипящих жидкостей, распределенных на материалах с развитой поверхностью.
3.1. Самовоспламенение. Стационарная теория