| № п/п | Наименование продукта | 
| 
| 
| 
 
| 
 
| 
 
| 
| |||
| Травяная мука | 121-1015 | 1,75 | 357,73 | - | 329,45 | - | 318,53 | - | |||
| Шрот подсолнечный | 3,79- 106 | 43,2 | 2,27 | 267,61 | 2,4 | 225,92 | 2,2 | 211,84 | 2,2 | 0,39 | |
| Жмых подсолнечный | 1,51 106 | 42,0 | 1,2 | 274,44 | 229,48 | 3,6 | 214,50 | 3,5 | 0,5 | ||
| Шрот соевый | 4,36- 109 | 47,3 | 1,85 | 292,61 | 247,03 | 9,2 | 231,64 | 9,1 | 0,8 | ||
| Мука пшеничная | 1,94- 1010 | 81,2 | 3,02 | 348,88 | - | 310,45 | - | 296,42 | 1387, 6 | 8,4 | |
| Отруби пшеничные | 4,1 108 | 60,9 | 2,27 | 303,05 | 264,66 | 17,7 | 251,01 | 17,2 | 1,12 | ||
| Мука из ячменя | 2,04-109 | 73,6 | 2,61 | 344,91 | - | 303,61 | - | 288,76 | 548,1 | 5,63 | |
| Дрожжи кормовые | 7,93- 10ю | 83,4 | 3,35 | 340,15 | 304,53 | 291,41 | 650,6 | 6,25 | |||
| Комбикорм для свиней | 8,89' 10й | 93,5 | 1,41 | 352,05 | 317,92 | 305,18 | 8,1 | ||||
| Комбикорм для птиц | 3,79- 109 | 71,6 | 1,78 | 326,35 | 288,31 | 274,57 | 120,6 | 2,8 |
Глава 3, Возникновение процессов горения
Учет функции Ф(Bi) в уравнении (3.93) позволяет существенно уменьшить неточность, возникающую в результате апроксимации распределения температуры в горючей системе параболой второго порядка.
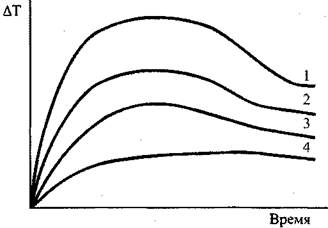
Рис. 3.12. Кинетические кривыеразогревов: 1-447 К; 2-450 К, 3-456; 4-458.
Для расчета критических значений температуры (T) и характерного размера (r) в уравнении (3.93) необходимы значения величин кинетических параметров: Е, Ко и v. (определение этих параметров осуществляется графоаналитическим способом по методу термического анализа из экспериментальных кривых "  - время" (Рис. 3.12).
- время" (Рис. 3.12).
Разработанная математическая модель позволяет рассчитывать условия самовозгорания и выполнить прогноз поведения насыпей дисперсной горючей массы любого размера и любой формы.
Результаты расчетов для широкого круга продуктов растительного происхождения представлены в табл. 3.2.
|
|
Данные табл. 3.2 показывают, что благодаря предложенной схеме расчета условие теплового самовозгорания можно не только установить ряд потенциальной опасности различных видов горючего дисперсного материала, но и прогнозировать критические условия их хранения (время индукции, размеры насыпи).
Необходимость обработки большого числа термических кривых делает описанный метод достаточно трудоемким и затрудняет его использование для быстрого получения необходимой информации. В связи с этим
Корольченко А.Я. Процессы горения и взрыва ______________________
разрабоганы алгоритмы и программа для расчета критических параметров на персональной ЭВМ. Это позволяет оперативно рассчитывать критические параметры процесса самовозгорания дисперсных горючих материалов и осуществлять прогноз их поведения в процессе переработки, транспортировки и хранения.
Таблица 3.3. Сравнение расчетных и экспериментальных значений температуры
Самовозгорания.
| Наименование материала | Размер образца, м | Температура, °С | 
| |
| расчет, tp | эксперимент, tэ | |||
| Торф шатурский | 0,05 | 128,0 | 139,0 | 11,0 |
| Шрот хлопковый | 0,05 | 147,0 | 150,0 | 2,5 |
| Опилки древесные сосновые | 0,05 | 166,0 | 170,0 | 3,4 |
| Мука пшеничная (сорт высший) | 0,05 | 173,4 | 178,0 | 4,6 |
| Шрот соевый | 0,8 | 57,1 | 59,0 | 1,9 |
Проверка точности выбранной расчетной модели условий теплового самовозгорания дисперсных горючих материалов осуществлялась на лабораторной и полигонной установке.
В лабораторных условиях исследовался разогрев материала с целью получения зависимости T=f(t) и определения кинетических характеристик. На полигонной установке изучался процесс самовозгорания в условиях, приближенных к реальному хранению материалов.
|
|
Результаты сопоставления расчета с экспериментом представлены в табл. 3.3, из которых следует возможность прогноза условий теплового самовозгорания по рассмотренной выше методике с достаточной для практических целей точностью.
Глава 4.
РАЗВИТИЕ ГОРЕНИЯ
4.1. Распространение пламени по газам
| Д |
ефлаграционное горение. Состав горючих смесей может быть различным. В общем случае содержание горючего компонента может колебаться от нуля до ста процентов. Опыт показывает, что не все смеси горючего и окислителя способны распространять пламя. Распространение возможно лишь в определенном интервале концентраций. При зажигании смесей, состав которых выходит за эти пределы, реакция горения, инициированная зажигающим импульсом, затухает на небольшом расстоянии от места зажигания.
Для смесей горючего и окислителя, находящихся в газообразном состоянии, существуют минимальная и максимальная концентрации горючего, которые ограничивают область горючих смесей. Эти концентрации называются соответственно нижним и верхним концентрационными пределами распространения пламени. Вне пределов распространение пламени по данной смеси невозможно.
Значения концентрационных пределов распространения пламени наиболее распространенных горючих газов приведены в табл. 5.2.
Рассмотрим причины, обуславливающие наличие предельных условий распространения пламени по газовым смесям.
|
|
В начальный момент инициирования горения (искрой, накаленным телом или открытым пламенем) в горючей смеси возникает зона высокой температуры, из которой тепловой поток будет направлен в окружающее пространство. Часть тепла поступает в свежую (еще не сгоревшую) смесь, другая часть - в продукты горения. Если поток тепла в свежую смесь недостаточен для возбуждения в ней реакции горения, первоначальный очаг пламени затухает.
Для количественной оценки этого явления рассмотрим ситуацию, когда смесь горючего и окислителя движутся навстречу фронту пламени со скоростью, равной скорости распространения пламени. Тогда пламя будет неподвижным, а распределение температуры в зоне горения схематически
Корольченко А.Я. Процессы горения и взрыва
изобразится кривой, показанной на рис 4.1. Обозначим температуру газовой смеси вдали от пламени Т0 а температуру продуктов горения - Тпл.

|
Рис. 4.1. Распределение температуры в зоне горения газовой смеси
Кривую Т (Z) заменим ломаной, состоящей из прямых Т = Т0 и Т -Тпл и касательной к кривой Т(Z) в точке перегиба.
При возникновении горения к свежей смеси по механизму теплопроводности от единицы поверхности пламени в единицу времени подводится количество тепла q, определяемое соотношением:
 (4.1)
(4.1)
где  - коэффициент теплопроводности,
- коэффициент теплопроводности,  - толщина фронта пламени.
- толщина фронта пламени.
Подведенное тепло расходуется на нагрев свежей смеси от температуры Т0 до температуры Тпл:
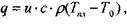 (4.2)
(4.2)
где и - скорость потока газа, равная скорости распространения пламени, С - удельная теплоемкость,  - плотность смеси.
- плотность смеси.
Из соотношений (4.1) и (4.2) может быть найдена величина и:

|
(4.3.)
Глава 4. Развитие горения
где  - среднее значение коэффициента температуропроводности.
- среднее значение коэффициента температуропроводности.
Поскольку скорость реакции с ростом температуры увеличивается по экспоненциальному закону, то сгорание основной массы смеси будет происходить в области, температура которой близка к максимальной Тпл. При этом зона реакции  будет несколько меньше
будет несколько меньше 
Без существенной погрешности можно принять, что ширина зоны реакции 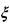 равна произведению скорости и на время пребывания смеси в зоне горения
равна произведению скорости и на время пребывания смеси в зоне горения 
 (4.4)
(4.4)
а время т протекания реакции обратно пропорционально скорости реак-

|
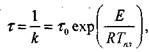
|
то есть
(4.5)
где Е - энергия активации реакции; R - универсальная газовая постоянная.
Учтем, что
 (4.6)
(4.6)
где в - безразмерный множитель, меньше единицы. Численное значение этой величины определяется видом кинетики реакции горения. Из соотношений (4.4), (4.5) и (4.6) получаем

|
(4.7)
где в0- величина, зависящая от свойств смеси.
Отвод тепла от зоны горения понижает температуру пламени. При этом замедляются химические процессы в пламени, и соответственно, скорость его распространения. При достаточной величине теплопотерь возникшее пламя потухает, его распространение по смеси прекращается. Определение предельных условий распространения пламени основано на
Корольченко А.Я. Процессы горения и взрыва _________________________
учете влияния тепловых потерь на температуру пламени и скорость его распространения. На этих положениях основана теория пределов распространения пламени, предложенная академиком Я. Б. Зельдовичем.
Согласно этой теории понижение максимальной температуры пламени Тпл по отношению к теоретической температуре горения Ттеор обратно пропорционально квадрату скорости распространения пламени:
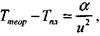 (4.8)
(4.8)
где  - коэффициент, характеризующий теплоотдачу.
- коэффициент, характеризующий теплоотдачу.

|
| Рис. 4.2. Пояснения к оценке критических условий распространения пламени |
Совместное решение уравнений (4.7) и (4.8) позволяет оценить скорость распространения пламени с учетом принятых допущений. Это можно сделать графическим способом в прямоугольной системе координат, отложив по оси абсцисс величину Тпл, а по оси ординат - скорость распространения пламени. Если далее на основании уравнений (4.7) и (4.8) построить соответствующие кривые, то координаты точек пересечения дадут критические значения и и Тпл.
Глава 4. Развитие горения
На рис. 4.2 кривые 1, 2 и 3 построены в соответствии с уравнением (4.8). При построении величина Ттеор принималась постоянной, а величины коэффициента теплоотдачи - различными:  Прямая 4 характеризует взаимосвязь между скоростью распространения и температурой пламени, которая задана уравнением (4.7). Как следует из графика, кривые 3 и 4 пересекаются в точках а и б. Координаты этих точек соответствуют значениям и и Тпл, удовлетворяющим уравнениям (4.7) и (4.8). Точке а соответствует неустойчивый режим горения, а точке б - устойчивый, при котором Тпл близка к Ттеор. При увеличении теплоотвода из зоны реакции, что отражено увеличением коэффициента
Прямая 4 характеризует взаимосвязь между скоростью распространения и температурой пламени, которая задана уравнением (4.7). Как следует из графика, кривые 3 и 4 пересекаются в точках а и б. Координаты этих точек соответствуют значениям и и Тпл, удовлетворяющим уравнениям (4.7) и (4.8). Точке а соответствует неустойчивый режим горения, а точке б - устойчивый, при котором Тпл близка к Ттеор. При увеличении теплоотвода из зоны реакции, что отражено увеличением коэффициента 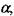 точки пересечения кривых будут сближаться, а значения температуры Тпл и скорости распространения пламени и, соответствующие устойчивому режиму горения, будут уменьшаться. При величине коэффициента
точки пересечения кривых будут сближаться, а значения температуры Тпл и скорости распространения пламени и, соответствующие устойчивому режиму горения, будут уменьшаться. При величине коэффициента  отвечающем кривой 2, кривые, описывающие уравнения (4.7) и (4.8) будут иметь единственную общую точку б. При дальнейшем увеличении а кривые пересекаться не будут. Это соответствует условию прекращения распространения пламени по смеси.
отвечающем кривой 2, кривые, описывающие уравнения (4.7) и (4.8) будут иметь единственную общую точку б. При дальнейшем увеличении а кривые пересекаться не будут. Это соответствует условию прекращения распространения пламени по смеси.
Оценим значения Тпл и и отвечающие этому условию.

|
В точке б производные
(4.7) и (4.8), получаем:
должны быть равны. Дифференцируя

|

Приравнивая правые части полученных уравнений, и решая полученное соотношение относительно Тш, получаем:

|
(4.9)
или приближенно

|
(4.10)
Формула (4.10) свидетельствует о том, что пламя может распространяться по газовой смеси, если температура пламени не будет ниже теоретической
Корольченко А.Я. Процессы горения и взрыва
(т.е. температуры пламени в отсутствии теплопотерь) на величину, превы-

|

|
| шаюшую |
. При понижении температуры пламени на величин}'
Е ' " ' Е
оно затухает.
Решение уравнения (4.7) позволяет оценить предельную скорость распространения пламени. После преобразований получено:
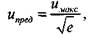
(4.11)
где ипред - предельная скорость распространения пламени, имакс - максимальная, соответствующая теоретической температуре горения.
Изложенная теория объясняет наличие пределов распространения пламени по газовым смесям теплопотерями из зоны реакции. Выводы теории соответствуют экспериментально наблюдаемым фактам.
Детонация. Детонацией называется процесс превращения горючей смеси или взрывчатого вещества ВВ, сопровождающийся выделением теплоты и распространяющийся с постоянной скоростью, превышающей скорость распространения звука в данной смеси или веществе.
В отличие от дефлаграционного горения, где распространение пламени обусловлено относительно медленными процессами диффузии и теплопроводности, детонация представляет собой комплекс мощной ударной волны и следующей за ее фронтом зоны химического превращения. Благодаря резкому повышению температуры и давления за фронтом ударной волны химическое превращение исходных веществ в продукты горения протекает чрезвычайно быстро в очень тонком слое, непосредственно прилегающем к фронту ударной волны (рис. 4.3)

Рис. 4.3. Схема детонационной волны
Глава 4. Развитие горения
Ударная волна сжимает и нагревает горючую смесь (или взрывчатое вещество), вызывая химическую реакцию, продукты которой сильно расширяются - происходит взрыв. Энергия, выделяющаяся в результате химического превращения, поддерживает существование ударной волны, не давая ей затухать. Скорость перемещения детонационной волны постоянна для каждой горючей смеси и взрывчатого вещества и достигает 1000-3000 м/с в газовых смесях и 8000-9000 м/с - в конденсированных взрывчатых веществах (табл. 4.1).
Таблица 4.1 Скорость детонации некоторых горючих смесей и взрывчатых веществ
| Смесь или вещество | Агрегатное состояние | Плотность, г/см | Скорость детонации, м/с |
| 2Н2+02 | газ | — | |
| СН4+202 | газ | — | |
| CS2+302 | газ | - | |
| Нитроглицерин С3Н5(ОN02)з | жидкость | 1,60 | |
| Тринитротолуол (тротил) C7H5(N02)3 СНз | ТВ. В-ВО | 1,62 | |
| Пентаэритритетранитрат С5Н8 (ON02)4 | ТВ. В-ВО | 1,77 | |
| Циклотриметилентринитроа-мин (гексоген) СзН60бМ6 | ТВ. B-BO | 1,80 |
Давление во фронте ударной волны при детонации газовых смесей достигает 1-5 МПа (10-50 атм), конденсированных веществ - 10 ГПа (103 атм).
Детонация взрывчатых веществ может инициироваться интенсивным механическим или тепловым воздействием (удар, искровой разряд, взрыв металлической проволочки под действием электрического тока и т.п.). Сила воздействия, необходимая для возбуждения детонации зависит от химической природы взрывчатого вещества или состояния горючей газовой смеси. К механическому воздействию чувствительны, так называемые инициирующие взрывчатые вещества (гремучая ртуть, азид свинца и др.), которые обычно входят в состав капсюлей-
Корольченко А.Я. Процессы горения и взрыва ______________________
детонаторов, используемых для возбуждения детонации вторичных (менее чувствительных) взрывчатых веществ.
В конденсированном взрывчатом веществе детонация распространяется с постоянной скоростью, которая среди возможных для этого вещества скоростей распространения детонационной волны является минимальной. При этом зона химического превращения перемещается относительно исходного вещества со сверхзвуковой скоростью. Вследствие этого волны разрежения, возникающие при расширении газообразных продуктов химической реакции, не могут проникнуть в зону реакции и ослабить распространяющуюся впереди ударную волну. Детонация, отвечающая описанным выше условиям, называется процессом Чепмена-Жуге. Соответствующая ей минимальная скорость распространения детонационной волны принимается в качестве характеристики взрывчатого вещества или горючей смеси.
|
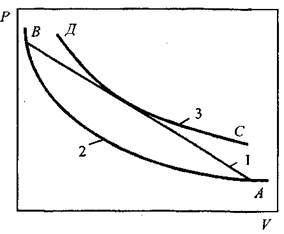
Современная теория детонации позволяет рассчитывать значения ее скорости и распределение давления, плотности и температуры в детонационной волне относительно продуктов реакции и скорости звука в них. Взаимосвязь давления и объема в распространяющейся ударной детонационной волне показана на рис. 4.4, на котором адиабата АВ соответствует ударной волне, распространяющейся в газовой смеси (р - давление, V - объем) и не вызывающей химической реакции. СД - адиабата, построенная в предположении, что химическая реакция завершилась. При детонации вначале происходит ударный переход 1-2 (адабатический процесс), затем химическая реакция переводит вещество из состояния 2 в состояние 3 по прямой, касающейся адиабаты СД. Дальнейшее расширение вещества идет по адиабате СД. Скорость газовой де- Рис. 4.4. Взаимосвязь давления и объема тонации Vдет рассчитывав ударной волне, распространяющейся в газе ется по формуле:
 (4.12)
(4.12)
Глава 4. Развитие горения
где q - тепловой эффект реакции, 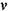 - показатель диабаты.
- показатель диабаты.
При определенных условиях в горючей смеси может быть возбуждена детонация, скорость распространения которой превышает минимальную скорость детонации. Например, взрыв заряда твердого взрывчатого вещества, помещенного в горючую газовую смесь, вызывает в ней ударную волну, интенсивность которой во много раз превосходит интенсивность волны, соответствующей режиму с минимальной скоростью. В результате в газовой смеси распространяется детонационная волна с повышенной скоростью.
В газообразных горючих смесях распространение детонации возможно только при условиях, когда концентрация горючего газа (или паров горючей жидкости) находится в определенных пределах, зависящих от химической природы горючей смеси, давления и температуры. Например, в смеси водорода с кислородом при комнатной температуре и атмосферном давлении детонационная волна способна распространяться, если концентрация водорода находится в пределах от 20 до 90% об.
Переход дефлаграционного горения в детонацию. Переход де-флаграционного горения в детонацию в газовоздушных смесях возможен в следующих случаях:
• при обогащении горючей смеси кислородом;
• при очень больших размерах газовых облаков;
• при наличии турбулизаторов горения.
Согласно теории гидродинамической неустойчивости и автотурбу-лизации фронта нормального горения в горючих облаках достаточно больших размеров неизбежен переход от дефлаграционного горения к детонации. Экстраполяционные оценки приводят к следующим критическим размерам облаков, при которых вероятность возникновения детонации высока: для водородовоздушных смесей - 70 м, для пропановоздуш-ных - 3500 м, для метановоздушных - 5000 м.
Турбулизация процесса горения газовых смесей с помощью различных препятствий по пути распространяющегося пламени приводит к существенному сокращению критических размеров газовых облаков, и возникающая в этом случае детонационная волна становится источником возбуждения детонации в неограниченном пространстве.
Проф. В. И. Макеевым экспериментально изучена возможность перехода дефлаграции в детонацию при горении смесей СН4 + 2(02 +  N2) и
N2) и
2Н2 + 02 +  N2 при значениях
N2 при значениях 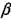 ' в интервале от 0 до 3,76 в объеме 6 м3 с
' в интервале от 0 до 3,76 в объеме 6 м3 с
Корольченко А.Я. Процессы горения и взрыва
частично загроможденным пространством. Для загромождения использовались в различных комбинациях три тонкостенные металлические концентрически расположенные сферы-турбулизатора с большим количеством отверстий. Коэффициент проницаемости сфер составлял от 0,1 до 0,4, соотношение диаметров 1:2:4. Отношение объема, занятого турбулизатором к объему горючей смеси составляло от 0,01 до 0,48%. Горение инициировалось в центре сфер пережигаемой нихромовой проволочкой. Переход от дефлаграции к детонации наблюдался в смесяхСН4 +2(02 +  N2) при
N2) при  и в смесях 2Н2 + 02+N2
и в смесях 2Н2 + 02+N2  при
при  < 3,2. С учетом полученных данных можно полагать, что для воздушных смесей (
< 3,2. С учетом полученных данных можно полагать, что для воздушных смесей (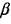 = 3,76) водорода и метана критический размер загроможденного пространства, при котором возможен переход к детонации, составляет примерно 1 и 10 м соответственно.
= 3,76) водорода и метана критический размер загроможденного пространства, при котором возможен переход к детонации, составляет примерно 1 и 10 м соответственно.
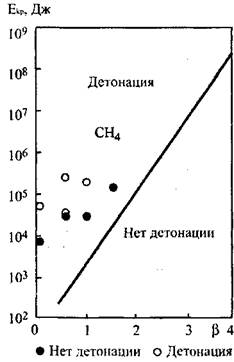
Зависимости критической энергии возбуждения детонации в загро
можденном пространстве для исследованных смесей от состава смеси по
казаны на рис. 4.5 и 4.6. "
|

|
Рис. 4.5. Зависимость критической Рис. 4.6. Зависимость критической
энергии возбуждения детонации энергии возбуждения детонации
от состава смеси СН4+2(02+  N2) от состава смеси 2Н2+02+
N2) от состава смеси 2Н2+02+  N2
N2
Глава 4. Развитие горения
Расчет параметров детонационных волн в смесях водород-кислород-инертный газ.* Детонационные волны, образующиеся прк сгорании газовых смесей, характеризуются следующими параметрами: скоростью детонации, температурой и давлением в детонационной волне.
Для определения этих параметров проф. Ю. Н. Шебеко с сотр. предложен метод расчета, основанный на рассмотрении химической реакции вида:
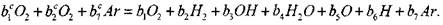
|
В диапазоне температур примерно до 5500 К другие компоненты в продуктах реакции не образуются в существенных количествах. Введем константу и, равную числу всех атомов, участвующих в химической реакции; в ходе реакции эта величина остается неизменной. Для п имеем соотношение

|

|
Обозначим общее число молей вещества, участвующего в химиче-
| начальное число молей |
ской реакции в точке равновесия, через

* При рассмотрении параметров детонационных волн приняты следующие обозначения:
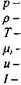
|
давление;
плотность;
температура;
- молярная масса г-ого компонента;
скорость газа в системе скачка;
| молярные теплоемкости при постоянном давлении и ооъеме соответ- |

|
| ственно; |
| константы, определяемые исходным составом по формулам |

|

|
полная удельная энтальпия;
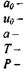
|
скорость звука в исходной смеси;
| расчетное значение давления в детонационной волне; рассчитанное значение температуры в детонационной волне; - экспериментально измеренное значение скорости детонации; - рассчитанное значение скорости детонации. |

|
скорость детонации; скорость звука в продуктах реакции; температура в детонационной волне; давление в детонационной волне;
Корольченко А.Я. Процессы горения и взрыва
Введем мольную долю каждого компонента  , и «мольные
, и «мольные
доли» всех атомов 
Полная система уравнений для расчета детонационных адиабат содержит четыре уравнения материального баланса по атомам (4.13)-(4.16); четыре уравнения химического равновесия (4.17)-(4.21); уравнение состояния (4.22); и три уравнения газодинамики: уравнение непрерывности (4.23); и два уравнения, являющиеся следствием закона сохранения плотности потока импульса (4.24) и энергии (4.25).
Уравнения материального баланса по атомам
(кислород) 2y1 +уз+ у4 + У5 = С1у0; (4.13)
(водород) 2у2 + уз + 2у4 + у6 = с2у0; (4.14)
(аргон) у7=с3у0;
у1+ у2 + уз + У4 + У5 + У6+С3У0= 1 (4.16)
Уравнения химического равновесия
| Уравнение состояния: Уравнение неразрывности: |

|
| (4.21) |
(4.17) (4.18) (4.19)  (4.20)
(4.20)
 (4.22) Уравнение сохранения потока импульса:
(4.22) Уравнение сохранения потока импульса:
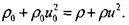 (4.23) Уравнение сохранения энергии:
(4.23) Уравнение сохранения энергии:
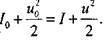
Глава 4. Развитие горения
Таким образом, система содержит 12 уравнений при 13 неизвестных (у0-у7) Р,р, Т,  и. Чтобы замкнуть систему, необходимо дополнительное уравнение, называемое условием Чемпена-Жуге: равенство скорости газа и в системе волны и местной скорости звука
и. Чтобы замкнуть систему, необходимо дополнительное уравнение, называемое условием Чемпена-Жуге: равенство скорости газа и в системе волны и местной скорости звука 
(4.25)
где уf определяется равенством 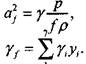
Система уравнений (4.13-4.24) позволяет сократить число переменных, выразив у1-y4 через у0 и у3-у7, а остальные переменные представив в безразмерном виде.
Состояния Чепмена-Жуге рассматриваются для начальной температуры 298,15 К при начальных давлениях до 0,25 МПа. В табл. 4.1. представлены результаты расчетов: параметры состояния Чепмена-Жуге для двенадцати составов исходной смеси, при стандартных начальных условиях (начальное давление равно 1 атм, температура 298,15 К). В табл. 4.2. представлены рассчитанные значения температуры, давления и скорости детонации для некоторых смесей. В третьей колонке этой таблицы даны экспериментально измеренные значения скорости детонации. Рис. 4.7 иллюстрирует хорошее согласие расчетных значений с экспериментом для водородокислородной смеси в широком диапазоне концентраций водорода, а рис. 4.8 - для гремучей смеси, разбавленной аргоном. Существенное возрастание скорости детонации, при превышении процентного содержания водорода в смеси стехиометрической отметки (67 %) объясняется уменьшением средней молярной массы смеси. Скорость фронта детонации зависит от удельного энерговыделения по закону 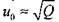 где Q удельная эн-
где Q удельная эн-
тальпия сгорания смеси, и, кроме того, от скорости звука в исходной смеси. Поэтому, даже когда молярное энерговыделение падает, скорость детонации растет за счет уменьшения молярной массы и увеличения скорости звука. Согласие экспериментальных и расчетных значений для смесей, содержащих инертный разбавитель (аргон), несколько хуже. График зависимости скорости детонации от содержания аргона в смеси, состоящей из двух молей водорода и одного моля кислорода представлен на рис. 4.9. Там же отмечены точки, соответствующие экспериментально измеренной скорости детонации.
Корольченко А.Я. Процессы горения и взрыва ______________________
Таблица 4.1. Результаты расчета для различных смесей водород-кислород-инертный разбавитель
| Смеси | а0, м/с | u0 м/с | а, м/с | Т, °К | Р, атм |
| Но+407 | 10,17 | ||||
| Н2+302 | 12,18 | ||||
| Н2+1,502 | 15 72 | ||||
| Н2+02 | 16,98 | ||||
| 1,5Н2+02 | 17,76 | ||||
| 2Н2+02 | 18,14 | ||||
| зн2+о2 | 17,99 | ||||
| 4Н2+02 | 17,44 | ||||
| 2Н2+О2+0,1 Аr | 17,91 | ||||
| 2Н2+02+1 Аr | 16,80 | ||||
| 2Н2+02+ЗАr | 15,10 | ||||
| 2Н2+02+5 Аr | 13,59 |
Таблица 4.2. Результаты расчета для некоторых смесей кислород-водород-инертный разбавитель в сравнении с экспериментальными данными
| Смеси | Р расч, атм | Tрасч, К- | U0 изм, М/С | Uо расч,/С |
| 2Н2+02 | 18,14 | |||
| зн2+о2 | 17,99 | |||
| 4Н2+02 | 17,44 | |||
| Н2+02 | 16,98 | |||
| Н2+202 | 14,47 | |||
| н2+зо2 | 12,18 | |||
| 2Н2+02+5 Аr | 13,50 | |||
| 2Н2+02+3 Аr | 15,10 | |||
| 2Н2+02+1,5 Аr | 16,32 | |||
| 2Н2+02+5 Не | 13,59 | |||
| 2Н2-O2+3 Не | 15,11 | |||
| 2Н2+02+1,5Не | 16,32 | ЗОЮ |
Глава 4. Развитие горения

|

|
Рис. 4.7. Зависимость скорости
детонации от содержания
водорода вкислородоводородной
смеси,
* - экспериментальные
значения
Рис. 4.8. Зависимость скорости
детонации от содержания аргона
в стехиаметрической смеси
водород-кислород-аргон:
* - экспериментально
измеренные значения

|

|
Рис. 4.9. Зависимость температуры
в точке ЧЖот содержания водорода
в кислородоводородной смеси
Рис. 4.10. Зависимость давления
в точке ЧЖ от содержания водорода
в кислородоводородиой смеси
Корольченко А.Я. Процессы горения и взрыва
Графики зависимости температуры и давления в точке ЧЖ от содержания водорода в кислородоводородной смеси {рис. 4.9 и 4.10) имеют максимум при 67% Н2 (гремучая смесь). Эта точка отвечает максимальному молярному энерговыделению. Зависимость температуры от давления {рис.4.11) почти линейна, что, согласно уравнению состояния (4.21), говорит о постоянстве молярного объема в точке ЧЖ для рассмотренных концентраций водорода в смесях при одинаковых начальных условиях.
Параметр  , равный отношению теплоемкостей существенно меняется при изменении состава исходной смеси. На рис. 4.12 изображен график зависимости
, равный отношению теплоемкостей существенно меняется при изменении состава исходной смеси. На рис. 4.12 изображен график зависимости 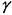 от процентного содержания водорода в исходной смеси с кислородом. Резкое уменьшение значения
от процентного содержания водорода в исходной смеси с кислородом. Резкое уменьшение значения  в диапазоне начальных концентраций от 6 до 38 процентов объясняется существенным увеличением в сгоревшей смеси содержания паров воды, но при дальнейшем увеличении доли водорода в исходной смеси, из-за возрастания температуры продуктов сгорания, начинает сказываться диссоциация, молекул и, в результате этого, увеличивается содержание атомарного кислорода и водорода. Это приводит к тому, что
в диапазоне начальных концентраций от 6 до 38 процентов объясняется существенным увеличением в сгоревшей смеси содержания паров воды, но при дальнейшем увеличении доли водорода в исходной смеси, из-за возрастания температуры продуктов сгорания, начинает сказываться диссоциация, молекул и, в результате этого, увеличивается содержание атомарного кислорода и водорода. Это приводит к тому, что  сгоревшей смеси перестает уменьшаться, и график, изображающий зависимость
сгоревшей смеси перестает уменьшаться, и график, изображающий зависимость  от содержания водорода в исходной смеси {рис. 4.12), имеет небольшой максимум. Зависимость
от содержания водорода в исходной смеси {рис. 4.12), имеет небольшой максимум. Зависимость