Лекционное занятие
Тема: Основные понятия и законы химии
Количество часов 4
Цель: Актуализация знаний обучающихся про основные законы и понятия химии.
Вещество. Атом. Молекула. Химический элемент. Аллотропия.
Химия – наука о веществах, их свойствах, превращениях и явлениях, сопровождающих эти превращения.
Вещества – это то, из чего состоят предметы (физические тела) окружающего мира, а именно вид материи, который имеет массу покоя и характеризуется постоянными физическими и химическими свойствами, позволяющими отличить его от других веществ. Для сравнения: другой вид материи – поле – не имеет массы покоя.
Каждое вещество обладает строго определёнными свойствами, т.е. признаками, позволяющими отличить одно вещество от других.
Физические свойства вещества – совокупность сведений о свойствах вещества, которые можно измерить физическими методами. К ним относятся агрегатное состояние, плотность, растворимость, температуры плавления, кипения, цвет, вкус, запах и т.д.
Химические свойства вещества – совокупность сведений о том, с какими другими веществами и при каких именно условиях реагирует данное вещество.
Агрегатное состояние вещества – это физическое состояние, в котором находится вещество при определенных давлении и температуре. В настоящее время выделяют четыре основных агрегатных состояния – твердое, жидкое, газообразное и плазму.
· Газ характеризуется хаотическим движением слабо взаимодействующих молекул, не имеет постоянной структуры, собственной формы и объема.
· Жидкость обычно состоит из молекул, находящихся в постоянном тепловом движении, имеет объем, но не имеет формы.
· Твердое вещество отличается упругостью, имеет определенные объем и форму, может иметь как упорядоченную, так и неупорядоченную структуру, моно- или поликристаллическую.
· Плазма – полностью или почти полностью ионизированный газ.
Явления – различные изменения, которые происходят с веществами.
Физические явления – явления, при которых изменяется форма или агрегатное состояние вещества или же образуются новые атомы (например, при ядерных реакциях).
Химические явления – явления, при которых одни вещества превращаются в другие, имеющие новый состав и свойства; состав ядер при этом не меняется. Характерными признаками, по которым можно судить о том, что имеет место химические явление (реакция), являются изменение цвета и запаха, образование или растворение осадка, выделение газа, теплоты или света.
Вещества, существующие в природе, постоянно претерпевают различные изменения.
Основы атомно-молекулярного учения.
1. Все вещества, существующие в природе, представляют собой совокупность громадного числа частиц (атомов, молекул, ионов). В зависимости от типа частиц, все вещества условно подразделяют:
· Вещества молекулярного строения – вещества, основной структурной единицей которых является молекула. Молекула – наименьшая частица вещества, обладающая его химическими свойствами. (N2, H2O)
· Вещества немолекулярного строения – вещества, основными структурными единицами которых являются атомы или ионы. Ион – заряженная частица, состоящая из одного или нескольких элементов.
Пример: Ионы: Cl- , SO42-, NH4+, Al3+ (NH4Cl, Al2(SO4)3)
2. Частицы, из которых состоит данное вещество, взаимодействуют между собой посредством электромагнитных (кулоновских) сил и находятся в постоянном движении. Движение частиц ограничено силами взаимодействия между ними.
3. Каждое вещество, в зависимости от условий (температуры, давления) может находиться в определённом агрегатном состоянии, и при изменении внешних условий может переходить из одного агрегатного состояния в другое. (лед тает, превращаясь в воду, при нагревании воды до 1000С она переходит в газ).
Современное определение понятия вещество:
Вещество – совокупность большого числа частиц, находящаяся в определённом агрегатном состоянии.
Химический элемент – вид атомов, с определённым зарядом ядра. Каждому химическому элементу присвоен химический символ (знак), порядковый номер в таблице Д.И.Менделеева (порядковый номер равен заряду ядра атома), определенное название, а для некоторых химических элементов – особое прочтение символа в химической формуле.
Изучение простых веществ и их свойств чрезвычайно важно для неорганической химии и закладывает основу для ее изучения. Кардинальная особенность простых веществ заключается в том, что при рассмотрении их свойств не нужно учитывать изменения их состава, поскольку он всегда один и тот же. Но и у простых веществ необходимо уделить особое внимание явлению аллотропии. Это позволит выявлять зависимость свойств веществ от их химического строения.
Аллотропия (от греческого «tropos» — признак) — это процесс, при котором один химический элемент может трансформироваться в два или больше простых веществ. К примеру, атомы кислорода могут преобразоваться в два других различных вещества – кислород и озон, а сера – кристаллическую и пластическую серу. Вещества, которые образовались из атомов одно химического элемента, называют аллотропными модификациями этого элемента. Аллотропия вызвана разнящимся набором молекул в простом веществе или разным местонахождением частиц в кристаллической решётке этого вещества.
В 1841 году явление аллотропии стало известно науке благодаря ученому Йенсу Якобу Берцелиусу, позднее тщательные и долгие исследования этого явления были проделаны А. Шреттером. В 1860 году, вскоре после того как был открыт закон Авогадро, по которому в веществах одного объема, где установлены равные температуры и давление, существует равное количество молекул, ученые поняли, что элементы имеют возможность находиться в форме молекул со множеством атомов. К примеру, О2 — кислород и О3 — озон. В самом начале двадцатого века стало понятно, что отличия в кристаллической конструкции простых веществ — это еще одна причина аллотропии.
Аллотропные модификации
На сегодняшний день насчитывается больше четырехсот аллотропных модификаций простых веществ. К примеру, алмаз и графит – это аллотропные модификации углерода, хотя эти вещества внешне совершенно непохожи. У графита структура гексагональная слоистая, а у алмаза выглядит как правильно соединенная с друг другом сетка тетраэдрических образований.
Иногда это явление объединяют с полиморфизмом. Это возможность веществ твердого агрегатного состояния находится в двух или больше видоизменениях с различной кристаллическим построением и свойствами при одинаковом химическом составе. Но аллотропия имеет отношение лишь к простым веществам, вне зависимости от их агрегатного состояния, а полиморфизм — к любому твердому вещество, без указания на то, простое оно или сложное.Несмотря на количество аллотропных модификаций у химического элемента, самым стойким и не разрушающимся оказывается, в большинстве, только одно. Вот примеры одних из самых распространенных примеров аллотропии веществ: углеродможет образовать множество аллотропных модификаций — алмаз, графит, карбин и т.д. Кремний образует два аллотропных видоизменения: аморфный и кристаллический кремний.

Аллотропные формы углерода: a) лонсдейлит; б) алмаз;
в) графит; г) аморфный углерод; д) C60 (фуллерен); е) графен;
ж) однослойная нанотрубка
2. Простые и сложные вещества. Качественный и количественный состав веществ.
В природе, как правило, встречаются не чистые вещества, а смеси – системы, возникающие в результате смешивания двух и более компонентов, сохраняющих свои свойства. Состав смеси не является постоянным. В отличие от сложного вещества состав смеси нельзя выразить химической формулой. С помощью физических методов смесь можно разделить на исходные вещества. (Фильтрация, отстаивание, выпаривание, перегонка, возгонка, декантация, центрифугирование, флотация, разделение смеси при помощи магнита и т.д.). Различают гомогенные (однородные) и гетерогенные (неоднородные) смеси.
Гомогенной называется смесь, в которой между компонентами нет поверхности раздела (воздух, истинные растворы).
Гетерогенной называется смесь, в которой между компонентами есть поверхность раздела (песок и соль, вода и масло, вода и мел).
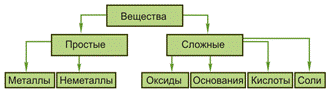
Индивидуальные (чистые) вещества делят на простые и сложные.
Простые вещества – состоят из атомов одного химического элемента Са, Сl2, О3, S8 и т. д.
Сложные вещества – состоят из атомов двух и более химических элементов. Сложные вещества – H2O, NO, H3PO4, C12H22O11 и т. д.
Простые вещества делят на металлы и неметаллы.
Металлы – обладают металлическим блеском, электропроводностью, теплопроводностью, ковкостью, пластичностью. В обычных условиях находятся в твердом агрегатном состоянии, кроме металла ртути, которых при обычных условиях находится в жидком агрегатном состоянии.
Неметаллы – очень разнообразны по физическим свойствам. Среди них есть газы (кислород O2, озон О3, азот N2, водород H2, фтор F2, хлор Cl2), жидкости (Br2), твердые вещества (йод I2, сера S, фосфор Р, углерод С, кремний Si и т.д.)
Различают в качественный и количественный состав веществ.
Качественный состав – это совокупность химических элементов и (или) атомных группировок, составляющих данное химическое вещество.
Количественный состав – это показатели, характеризующие количество или число атомов того или иного химического элемента и (или) атомных группировок, образующих данное химическое вещество.
3. Химические знаки и формулы.
Состав веществ отображают посредством химической символики.
По предложению Й. Я. Берцелиуса элементы принято обозначать первой или первой и одной из последующих букв латинских названий элементов.
Химический знак (символ) – несет значительную информацию. Он обозначает название элемента, один его атом, один моль атомов этого элемента. По символу химического элемента можно определить его атомный номер и относительную атомную массу.
Состав индивидуального вещества может быть выражен химической формулой.
Химическая формула – условная запись состава вещества при помощи химических символов и индексов.
Индексы – подстрочные цифры, показывающие числа атомов элементов в составе молекулы.
а) Простейшая формула (эмпирическая) – показывает состав вещества, и отношение числа атомов одного элемента к числу атомов другого элемента
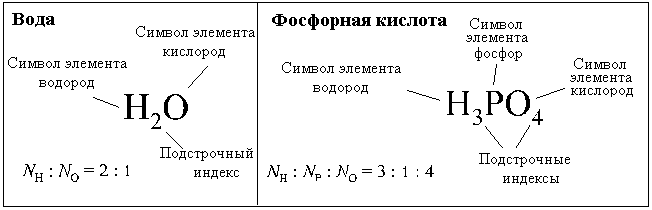
б) Молекулярная формула – показывает состав и реальное число атомов элементов в молекуле вещества (для веществ с молекулярным строением). Может совпадать с эмпирической.
| Вода H2O В молекуле воды: 2 атома водорода; 1 атом кислорода. | Фосфорная кислота H3PO4 В молекуле фосфорной кислоты: 3 атома водорода; 1 атом фосфора; 4 атома кислорода. | Бутан C4H10 В молекуле бутана: 4 атома углерода; 10 атомов водорода. |
Для немолекулярных веществ – введено понятие формульная единица (вместо молекулярной формулы) – это група атомов, входящих в состав немолекулярного вещества, соответствует простейшей формуле, т.е. показывает качественный состав и количественные соотношения чисел атомов элементов.(NaCl)
в) Структурная формула – показывает состав, порядок и способ соединения атомов в молекуле, кроме расположения в пространстве.
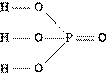
г) Пространственная формула – показывает состав, строение и взаимное расположение атомов в пространстве.
Объемная модель молекулы метана пространственная формула структурная формула молекулярная формула

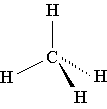
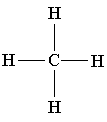 СН4
СН4
| Тип формулы | Информация, передаваемая формулой. | |
| Простейшая Молекулярная Структурная Пространственная | 
|
|
Задание 1.1. Укажите число атомов элементов в молекулах сложных веществ H2O, NO, H3PO4, C12H22O11, Сr2(SO4)3, AgNO3, Na[Al(OH)4] назовите эти атомы.
Возникает вопрос: почему для воды всегда записывается формула Н2О, а не НО или НО2? Опыт доказывает, что состав воды, полученной любым способом или взятой из любого источника, всегда соответствует формуле Н2О (речь идет о чистой воде).
Дело в том, что атомы в молекуле воды и в молекуле любого другого вещества соединены при помощи химических связей. Химическая связь соединяет как минимум два атома. Поэтому, если молекула состоит из двух атомов и один из них образует три химические связи, то другой также образует три химические связи.
Число химических связей, образуемых атомом, называют его валентностью.
Если обозначить каждую химическую связь черточкой, то для молекулы из двух атомов АБ получим А  Б, где тремя черточками показаны три связи, образуемые элементами А и Б между собой.
Б, где тремя черточками показаны три связи, образуемые элементами А и Б между собой.
В данной молекуле атомы А и Б трехвалентны.
Известно, что атом кислорода двухвалентен, атом водорода одновалентен.
В о п р о с. Сколько атомов водорода может присоединиться к одному атому кислорода?
О т в е т. Два атома. Состав воды описывают формулой Н–О–Н, или Н2О.
П о м н и т е! В устойчивой молекуле не может быть «свободных», «лишних» валентностей. Поэтому для двухэлементной молекулы число химических связей (валентностей) атомов одного элемента равно общему числу химических связей атомов другого элемента. Валентность атомов некоторых химических элементов постоянна.
Значение постоянных валентностей атомов некоторых элементов
| Валентность | Символы элементов |
| I | H, F, Ag, Na, K, Li, Cs, Rb |
| II | O, Ca, Мg, Ba, Zn, Be |
| III | Аl, B |
Другие атомов могут проявлять переменную валентность:
Fe – II, III; Cu – I, II, Cr – II, III, VI; Mn – II, IV, VII и т.д.
Максимальная валентность (высшая) как правило не бывает больше номера группы (исключения – Cu, Au)
Валентность можно определить (вычислить) из химической формулы вещества. В устойчивых молекулах нет свободных валентностей. Например, определим валентность x марганца Mn по формуле вещества MnO2:
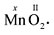
Общее число химических связей, образуемых одним и другим элементом (Mn и О), одинаково:
x · 1 = 4; II · 2 = 4. Отсюда х = 4, т.е. в этой химической формуле марганец четырехвалентен.