Лекция №9
Ионная и металлическая химическая связь. Типы кристаллических решеток
Ионная химическая связь
Химическая связь между ионами, осуществляемая электростатическим притяжением, называется ионной связью. Соединения, которые образовались путем притяжения ионов, называются ионными.
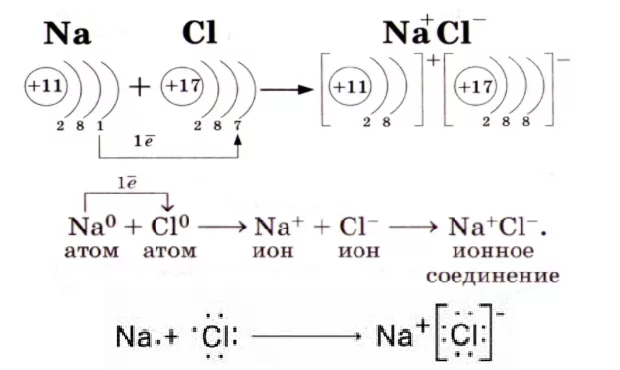
Возникновение ионной связи рассмотрим на примере образования хлорида натрия NaCl. Атомы натрия и хлора резко отличаются по электроотрицательности: для атома натрия она равна 1,01, для атома хлора 2,83. Как видно из электронных формул Na 1s22s22p63s1 и хлора 1s22s22p63s23р5, это атомы с незавершенными внешними электронными уровнями. Для завершения внешнего уровня атому натрия легче отдать один электрон, чем присоединить 7, а атому хлора легче присоединить один электрон, чем отдать 7. Как показывает опыт, при химических реакциях атом натрия отдает один электрон, а атом хлора принимает его.
Таким образом электронная оболочка атома натрия превратилась в устойчивую оболочку атома благородного газа Ne – 1s22s22p6 (это ион натрия Na+), а оболочка атома хлора Cl – в оболочку атома благородного газа Ar – 1s22s22p63s23p6 (это хлорид - ион Cl-). Между ионами натрия и хлора возникают силы электростатического притяжения, в результате чего образуется соединение NaCl.
Молекулы хлорида натрия существуют только в парообразном состоянии. В твердом (кристаллическом) состоянии ионные соединения состоят из закономерно расположенных положительных и заряженных ионов. Молекулы в этом случае отсутствуют. При ионной связи, общая электронная пара, смещена в сторону более электроотрицательного элемента.
Металлическая химическая связь
Металлическая связь – это особы вид химической связи, возникающий между атомами и ионами металла, за счет общих электронов.
Образование металлической связи можно представить следующей схемой:
Me⁰ - nē ⟶ Men+ ē
Атомы большинства металлов на внешнем энергетическом уровне содержат небольшое число электронов (большинство металлов от 1 до 3 электронов).
Металлическая связь характерна для металлов в твердом и жидком состоянии. Однако в парообразном состоянии атомы металлов, как и всех веществ, связаны между собой ковалентной связью. Пары металлов состоят из отдельных молекул (одноатомных и двухатомных). Прочность связи в кристалле больше, чем в молекуле металла, а потому процесс образования металлического кристалла протекает с выделением энергии.
Металлическая связь имеет некоторое сходство с ковалентной, поскольку в ее основе лежит обобщение валентных электронов. Однако электроны, которые осуществляют ковалентную связь, находятся в близи соединенных атомов и прочно с ними связаны. Электроны же, осуществляющие металлическую связь, свободно перемещаются по всему металлу и принадлежат всем его атомам. Именно поэтому кристаллы с ковалентной связью хрупки, ас металлической пластичны, т. е. они изменяют форму при ударе, прокатываются в тонкие листы и вытягиваются в проволоку. Металлической связью объясняются физические свойства металла (за счет свободных электронов): тепло- и электропроводность, металлический блеск, пластичность, ковкость и др.
Типы кристаллических решеток
Твердые вещества, как правило, имеют кристаллическое строение. Оно характеризуется правильным расположением частиц в строго определенных точках пространства. При мысленном соединении этих точек пересекающимися прямыми линиями образуется пространственный каркас, который называют кристаллической решеткой. Точки, в которых размещены частицы, называются узлами кристаллической решетки. В узлах воображаемой решетки могут находиться ионы, атомы или молекулы. Они совершают колебательные движения. С повышением температуры амплитуда колебаний возрастает, что проявляется в тепловом расширением тел.
В зависимости от вида частиц и характера связи между ними различают четыре типа кристаллических решеток: ионные, атомные, молекулярные и металлические.
Кристаллические решетки, состоящие из ионов, называются ионными. Их образуют вещества с ионной связью. Примером может служить кристалл хлорида натрия, в котором каждый ион натрия окружен шестью хлорид ионами, а каждый хлорид ион окружен – шестью ионами натрия. 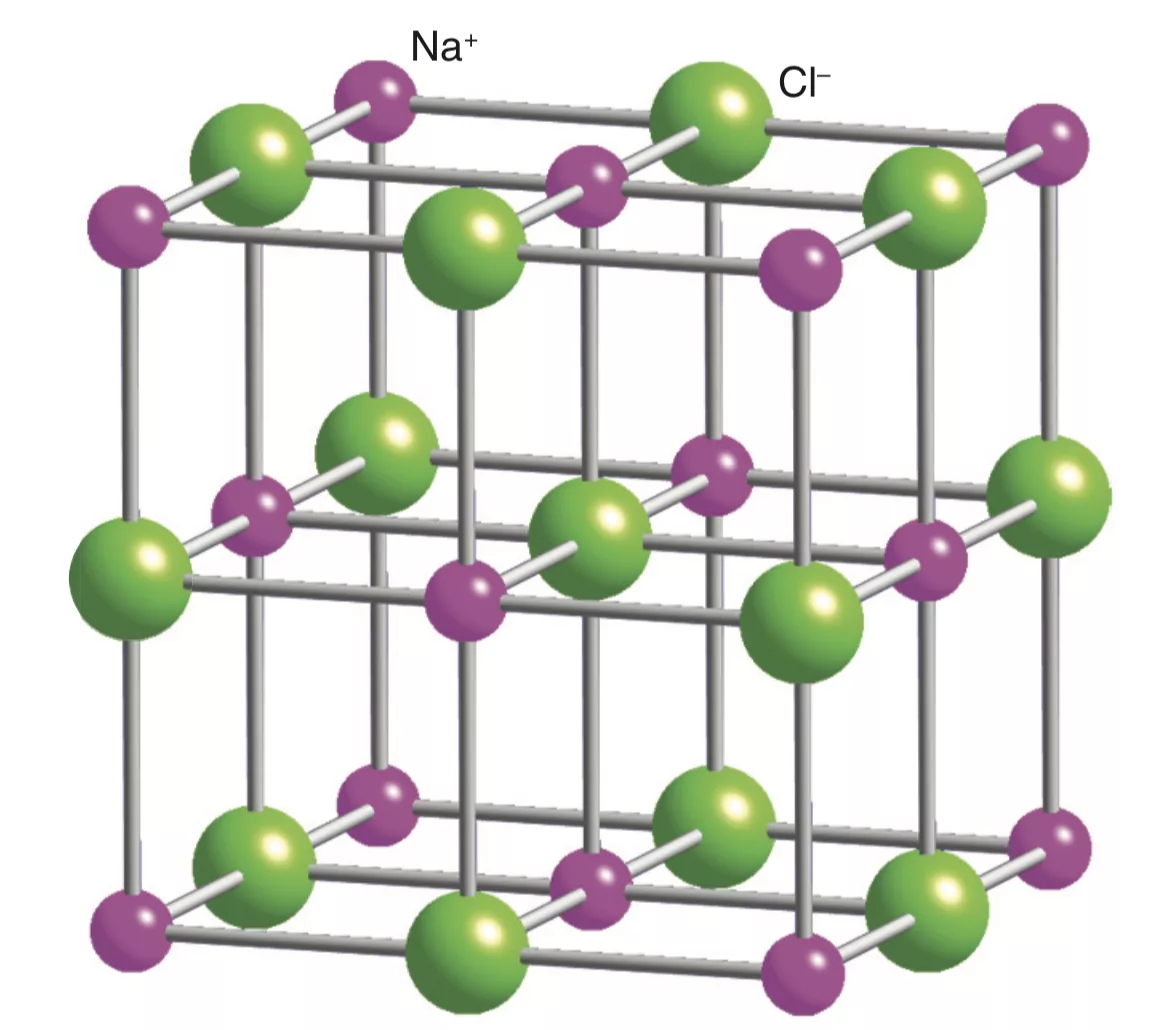
Связи между ионами в таком кристалле весьма прочны. Поэтому вещества с ионной кристаллической решеткой обладают сравнительно высокой твердостью. Они тугоплавки и мало летучи. Плавление ионных кристаллов приводит к нарушению геометрически правильной ориентации ионов относительно друг друга и уменьшению прочности связи между ними. Поэтому расплавы их проводят электрический ток. Ионные соединения, как правильно, легко растворяются в жидкостях, состоящих из полярных молекул, например в воде.
Кристаллические решетки, в узлах которых находятся отдельные атомы, называются атомными. Атомы в таких решетках соединены между собой прочными ковалентным связями. Примерами может служить алмаз и графит. Алмаз состоит из атомов углерода, каждый из которых связан с четырьмя соседними атомами. В решетке алмаза, как и в решетке хлорида натрия, молекулы отсутствуют. Весь кристалл следует рассматривать как гигантскую молекулу.
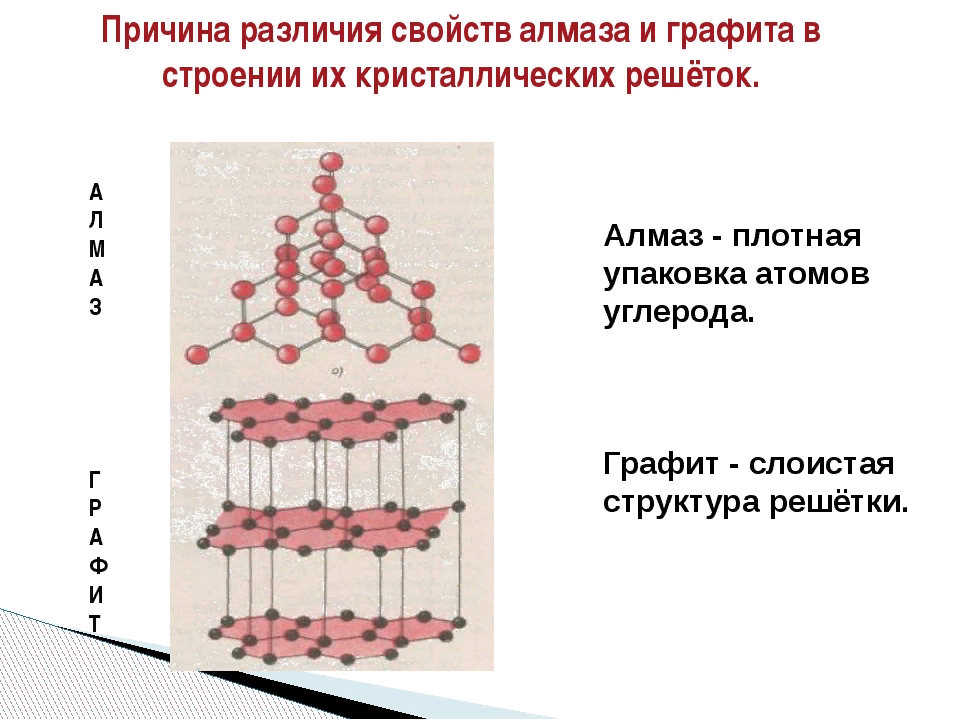
В неорганической химии известно большое число веществ с атомной кристаллической решеткой. Они имеют высокие температуры плавления (у алмаза свыше 3500⁰С), прочны и тверды, практически не растворимы в жидкостях. Атомная кристаллическая решетка характерна для твердого бора, кремния, германия и соединений некоторых элементов с углеродом и кремнием.
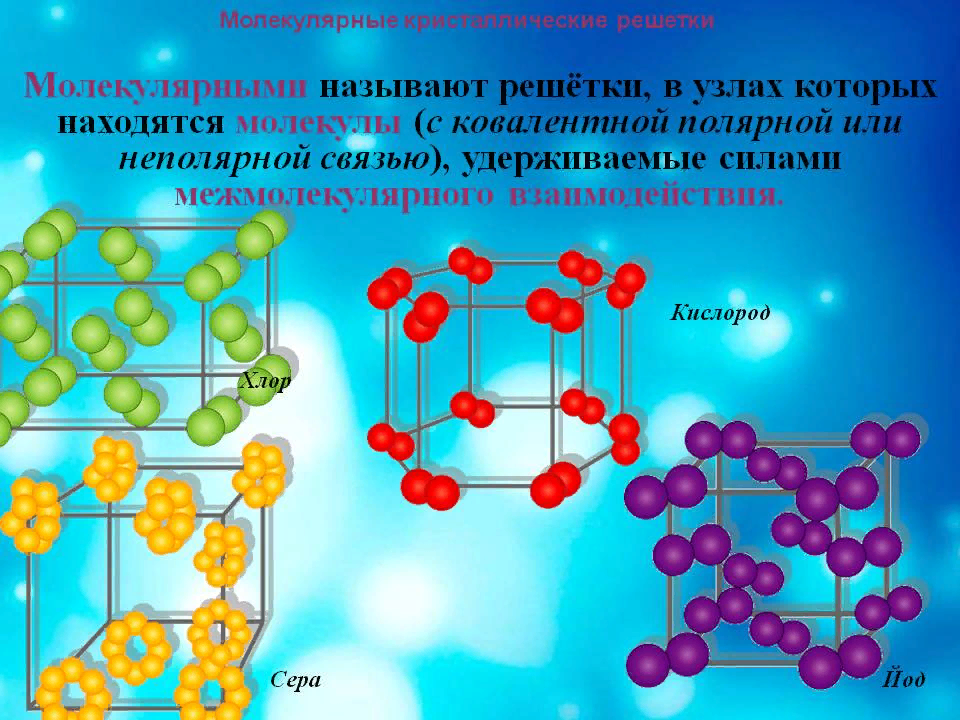
Кристаллические решетки, состоящие из молекул (полярных и неполярных), называются молекулярными. Молекулы в таких решетках соединены между собой сравнительно слабыми межмолекулярными силами. Поэтому вещества с молекулярной решеткой имеют малую твердость и низкие температуры плавления, нерастворимы или мало растворимы в воде, их растворы почти не проводят электрический ток. Примерами их являются лед, твердый оксид углерода (IV) – «сухой лед», твердые галогеноводороды, твердые простые вещества, образованные одно- (благородные газы), двух- (F₂, Cl₂, Br₂, I₂, H₂, O₂, N₂), четырех- (Р4), восьми- (S8) атомными молекулами. Большинство кристаллических органических соединений имеют молекулярную решетку.
В твердом состоянии металлы образуют металлические кристаллические решетки, которые представляют собой сочетание катионов металла, связанных воедино валентными электронами, т. е. отрицательно заряженным «электронным газом». Электроны электростатически притягивают катионы, обеспечивая стабильность решетка.
