Таблица №1
| Задание состава смеси | Перевод из одного состава в другой | Кажущаяся молекулярная масса смеси | Газовая постоянная смеси |
| массовые доли mi=Mi/Mсм | 
| 
| 
|
| объемные доли ri=Vi/Vсм | 
| 
| 
|
Теплоемкость - это количество тепла, необходимое для изменения температуры единицы количества вещества на один градус. Различают массовую С (Дж/кг·К), объемную С' (Дж/м3·К) и молярную  (Дж/кмоль·К) теплоемкости. Теплоемкость газа зависит от температуры. По этому признаку различают среднюю Ст и истинную С теплоемкости. Если q - количество тепла, подведенного (отведенного) к единице количества вещества при изменении его температуры от t1 до t2, то величина
(Дж/кмоль·К) теплоемкости. Теплоемкость газа зависит от температуры. По этому признаку различают среднюю Ст и истинную С теплоемкости. Если q - количество тепла, подведенного (отведенного) к единице количества вещества при изменении его температуры от t1 до t2, то величина
Cm = q/(t1-t2) представляет собой среднюю теплоемкость в пределах температур от t1 до t2. Предел этого отношения, когда разность температур стремится к нулю, называют истинной теплоемкостью С =  q/dt. Для газов важное значение имеют теплоемкости в процессах изохорическом (Cvm) и изобарическом (Срт) которые связаны между собой законом Майера Срт- Cvm=R.
q/dt. Для газов важное значение имеют теплоемкости в процессах изохорическом (Cvm) и изобарическом (Срт) которые связаны между собой законом Майера Срт- Cvm=R.
Для вычисления средних теплоемкостей в диапазоне температур от t1 до t2 пользуются формулой:
 (2)
(2)
где  - средняя теплоемкость газа в интервале температур от 0°С до t°C, она может быть мольной, объемной или массовой как при постоянном давлении так и при постоянном объеме. Средняя массовая теплоемкость смеси определяется:
- средняя теплоемкость газа в интервале температур от 0°С до t°C, она может быть мольной, объемной или массовой как при постоянном давлении так и при постоянном объеме. Средняя массовая теплоемкость смеси определяется:
 (3)
(3)
где 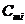 - средняя массовая теплоемкость i -ro компонента (табл.8, 9), п - число компонентов в смеси.
- средняя массовая теплоемкость i -ro компонента (табл.8, 9), п - число компонентов в смеси.
Таблица №2
Соотношения между параметрами состояния, расчетные и проверочные зависимости
термодинамических величин в процессах
| Наимено-вание процесса | Уравнение процесса | Показатель политропы | Связь между параметрами | Термодина-мическая работа | Потенциальная работа | Теплоем-кость процесса | Количество тепла | Изменение энтропии |
 Политроп-ный Политроп-ный
| PVn = idem | 
| 


| 

| 

| 
| 



| 
 

|
| Изобарный | P = idem | n = 0 | 

|  
| 
| Сpm | 

| 
|
| Изохорный | V = idem | n =±∞ | V1=V2

| 
| 

| Cvm | 

| 
|
| Изотерми-ческий | PV=idem | n=1 | T1=T2

| 

| 
| ∞ | 
| 

|
| Адиабатный | PVk=idem | n=k= 
| 


| 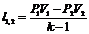

| 

| 0 | 
| 
|
ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ. Выражение 1-го начала термодинамики для конечного изменения состояния 1 кг газа имеет вид:

 (4)
(4)
Количество тепла  , термодинамическая работа
, термодинамическая работа  , потенциальная работа
, потенциальная работа  являются функциямипроцесса, формулы для расчета этих величин представлены в табл.2.
являются функциямипроцесса, формулы для расчета этих величин представлены в табл.2.
Внутренняя энергия u, энтальпия h являются функциями состояния, т.е. изменение этих величин не зависит от пути процесса и определяется по формулам:

 (5)
(5)
ТЕРМОДИНАМИЧЕСКИЕ ПРОЦЕССЫ. Основными процессами, которые изучаются в термодинамике, являются изохорический (V= idem), изобарический (Р=idem), изотермический (Т=idem) и адиабатный (PVk=idem). Перечисленные процессы - частный случаи обобщающего процесса, который называется политропным и описывается уравнением PVn=idem, где п- показатель политропы, который может иметь любые значения от - ∞ до + ∞. Зависимость между параметрами состояния в политропном процессе и его частных случаях, а также расчетные и проверочные зависимости термодинамических величин приведены в табл. 2.
ВТОРОЕ НАЧАЛО ТЕРМОДИНАМИКИ определяет направление, в котором протекают процессы, устанавливает условия преобразования тепловой энергии в другие виды, и для обратимых процессов имеет вид:
dS =  q/T или
q/T или  q = T·dS (6)
q = T·dS (6)
В технической термодинамике приходится иметь дело не с абсолютным значением энтропии, а с её изменением  .
.
Изменение энтропии  S между двумя произвольными точками политропного процесса и его частных случаев определяется по формулам табл. 2.
S между двумя произвольными точками политропного процесса и его частных случаев определяется по формулам табл. 2.
КРУГОВОЙ ПРОЦЕСС или цикл - это совокупность термодинамических процессов, в результате осуществления которых рабочее тело возвращается в исходное состояние. Степень совершенства цикла характеризуется термическими КПД:
 (7)
(7)
Первый закон термодинамики для цикла:
 (8)
(8)
Внутренняя энергия, энтальпия, энтропия являются функциями состояния, поэтому в круговых процессах изменение этих величин равно нулю.


Следовательно, выражение (8) примет вид


где  - работа цикла, Дж/кг; qi, li, wi,
- работа цикла, Дж/кг; qi, li, wi,  ,
,  - соответственно количество подведенного (отведенного) тепла, термодинамическая работа, потенциальная работа, изменение внутренней энергии, изменение энтальпии в процессах, составляющих цикл, Дж/кг; q1, q2 – количество подводимого и отводимого тепла в цикле, Дж/кг.
- соответственно количество подведенного (отведенного) тепла, термодинамическая работа, потенциальная работа, изменение внутренней энергии, изменение энтальпии в процессах, составляющих цикл, Дж/кг; q1, q2 – количество подводимого и отводимого тепла в цикле, Дж/кг.
Пример расчета: 1 кг рабочей смеси объемного состава  =0,23,
=0,23,  =0,55,
=0,55,  =0,22 совершает цикл (рис.1). Известны параметры: Р1 =2·105 Па, Р4 =8·105 Па, t1 =100 °С, t2 =300 °C,
=0,22 совершает цикл (рис.1). Известны параметры: Р1 =2·105 Па, Р4 =8·105 Па, t1 =100 °С, t2 =300 °C,  =0,27 м3/кг, n =1,5.
=0,27 м3/кг, n =1,5.
Определить:
1. Параметры в характерных точках цикла Р,υ, T.
2. Средние массовые теплоемкости в процессах цикла.
3. Термодинамическую l и потенциальную работу w, теплоту q, изменение внутренней энергии  , энтальпии
, энтальпии  и энтропии
и энтропии  в процессах цикла, работу цикла
в процессах цикла, работу цикла  ,термический к.п.д. цикла
,термический к.п.д. цикла  .
.

4. Построить цикл в координатах Р-V и Т -S.
Расчет газовой смеси (табл.1)
а) определение массового состава смеси
 ;
;

 .
.
Проверка:  0,227+0,475+0,298=1.
0,227+0,475+0,298=1.
б) определение кажущейся молярной массы смеси
 см =
см =  =
=  =32,45 кг/К.моль.
=32,45 кг/К.моль.
Проверка: через объемные доли
 см =
см =  = 0,23
= 0,23  кг/К.моль.
кг/К.моль.
в) определение газовой постоянной смеси
 Дж/кг·К,
Дж/кг·К,
Ri = 8314/  , - газовая постоянная компонента.
, - газовая постоянная компонента.
Проверка: через объемные доли
 Дж/кг·К = 0,256 кДж/кг·К.
Дж/кг·К = 0,256 кДж/кг·К.
РАСЧЕТ ПАРАМЕТРОВ
Параметры состояния определяют по уравнению процесса, по соотношению между параметрами в процессах (табл.2), если в одной точке процесса известно три параметра, а в другой - один. Уравнение состояния – Клайперона применяют, если в точке известны два параметра из трех и для проверки.
1.  определяется из уравнения Клайперона
определяется из уравнения Клайперона
υ1=  м3/кг.
м3/кг.
2.  - из соотношения в адиабатном процессе
- из соотношения в адиабатном процессе
 /
/  =
=  , отсюда
, отсюда  =
= 
 ,
,
где k =  - показатель адиабаты.
- показатель адиабаты.
Для определения  и
и  необходимо найти теплоемкости компонентов смеси (табл.8, 9) в интервале от 0°С до t°C.
необходимо найти теплоемкости компонентов смеси (табл.8, 9) в интервале от 0°С до t°C.
| Диапазон температур | Теплоемкости, кДж/кг·К | |||||
 
| 
| 
| 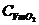
| 
| 
| |
| 0 - 100 | 0,923 | 1,04 | 0,866 | 0,663 | 0,743 | 0,677 |
| 0 - 300 | 0,95 | 1,049 | 0,949 | 0,69 | 0,752 | 0,76 |
По формуле (З) определяются средние массовые теплоемкости смеси в диапазоне температур от 0°С до 100°С и от 0°С до 300°С, ло формуле (2) - в диапазоне температур от 100°С до 300°С.


 кДж/кг·К;
кДж/кг·К;

 кДж/кг·К.
кДж/кг·К.
Проверка по закону Майера: 
 ;
;
Rсм = 0,256 КДж/кг·К; 0,996 - 0,740 = 0,256.
 = 0,227·0,923 + 0,475·1,040 + 0,298·0,866 = 0,961 кДж/кг·К;
= 0,227·0,923 + 0,475·1,040 + 0,298·0,866 = 0,961 кДж/кг·К;
 = 0,227·0,663 + 0,475·0,743 + 0,298·0,667 = 0,705 кДж/кг·К.
= 0,227·0,663 + 0,475·0,743 + 0,298·0,667 = 0,705 кДж/кг·К.
Проверка: 
 =
=  ; 0,961-0,705 =0,256 кДж/кг·К;
; 0,961-0,705 =0,256 кДж/кг·К;

 кДж/кг·К;
кДж/кг·К;
 кДж/кг·К.
кДж/кг·К.
Проверка: 1,013 - 0,757 = 0,256.
Показатель адиабаты К = 1,013/0,757 = 1,337  1,34;
1,34;

 м3/кг.
м3/кг.
3. p2 - из соотношений адиабатического процесса 1 – 2
 10,86·105Па.
10,86·105Па.
Проверка по уравнению Клайперона:  = 0,86·105 Па.
= 0,86·105 Па.
4. p3 - по уравнению изобарного процесса 2-3, т.е.
р = idem; р3 = р 2=10,86 Па.
5. T3 - из соотношения параметров в изобарном процессе
 , отсюда T3 =
, отсюда T3 =  = 573·0,27/0,135 = 1146 К.
= 573·0,27/0,135 = 1146 К.
Проверка:  =10,86·105·0,27/256=1146 К.
=10,86·105·0,27/256=1146 К.
6. По уравнению изотермического процесса T4 = T3 = 1146 К.
7. 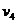 – из соотношения параметров в изотермическом процессе:
– из соотношения параметров в изотермическом процессе:
P3/P4=  ;
;
 =10,86·105·0,27/(8·105)=0,367 м3/кг.
=10,86·105·0,27/(8·105)=0,367 м3/кг.
Проверка: 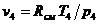 = 256 ·1146/(8·105)= 0,367 м3/кг.
= 256 ·1146/(8·105)= 0,367 м3/кг.
8. В изохорном процессе 5 - 1:  = 0,477 м3/кг.
= 0,477 м3/кг.
9. T5 - из соотношения параметров для политропного процесса 4-5:
 =1004 К.
=1004 К.
10. p5 - тоже из соотношения параметров:
 =8·105(0,367/0,477)1,5 =5,4ּ105 Па.
=8·105(0,367/0,477)1,5 =5,4ּ105 Па.
Проверка:  = 256·1004/0,477 =5,4·105 Па.
= 256·1004/0,477 =5,4·105 Па.
Результаты сводятся в табл. 3.Таблица №3
| № точек | p, Па |  , м3/кг , м3/кг
| T, К | t, 0С |
| 2·105 | 0,477 | |||
| 10,86·105 | 0,135 | |||
| 10,86·105 | 0,270 | |||
| 8,00·105 | 0,367 | |||
| 5,40·105 | 0,477 |
Средние массовые теплоемкости в процессах цикла
Расчет теплоемкостей в процессах цикла ведется аналогично расчету в адиабатном процессе 1-2. Сначала определяются средние массовые теплоемкости компонентов смеси  и
и  в диапазоне от 0°С до температуры точек цикла по табл.8, 9 методом линейной интерполяции, обязательно проверяя расчет по закону Майера, например, для кислорода – в интервале температур от 0°С до 873 °С:
в диапазоне от 0°С до температуры точек цикла по табл.8, 9 методом линейной интерполяции, обязательно проверяя расчет по закону Майера, например, для кислорода – в интервале температур от 0°С до 873 °С:

 кДж/кг·К
кДж/кг·К
1,023 – 0,763 = 0,260
После проверки результаты расчета сводятся в табл. 4
Таблица №4
| Диапазон температур | Теплоемкости, кДж/кг·К | |||||
 
| 
| 
| 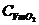
| 
| 
| |
| 0 - 873 | 1,023 | 1,105 | 1,099 | 0,763 | 0,808 | 0,910 |
| 0 - 731 | 1,008 | 1,090 | 1,070 | 0,748 | 0,793 | 0,881 |
Затем рассчитываются средние массовые теплоемкости смеси от 0°С до температур точек цикла по формуле (3) (расчет обязательно проверяется по закону Майера).
Таблица №5
| 0°C-t°C | 0-100 | 0-300 | 0-873 | 0-731 |
 , кДж/кг·К , кДж/кг·К
| 0,961 | 0,996 | 1,084 | 1,065 |
 , кДж/кг·К , кДж/кг·К
| 0,705 | 0,740 | 0,828 | 0,809 |
Средние массовые теплоемкости смеси в процессах цикла рассчитываются по формуле (2). Для изотермического процесса 3-4
 =
=  и
и  =
=  ,
,
т.к. изменение температуры равно нулю. Проверив расчет теплоемкости по закону Майера, результаты сводят в табл. 6.
Таблица №6
| Процесс | 1-2 | 2-3 | 4-5 | 5-1 |
| Диапазон температур | 100-300 | 300-873 | 873-731 | 731-100 |
 , кДж/кг·К , кДж/кг·К
| 1,013 | 1,130 | 1,182 | 1,081 |
 , кДж/кг·К , кДж/кг·К
| 0,757 | 0,874 | 0,926 | 0,825 |
Термодинамическая работа l, потенциальная работа w, изменение внутренней энергии 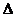 u, изменение энтальпии
u, изменение энтальпии 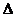 h, изменение энтропии
h, изменение энтропии 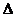 S, количество тепла q в процессах цикла
S, количество тепла q в процессах цикла
Процесс 1-2, адиабатный k = 1,34;  q = 0
q = 0
 =0,757(573-373)=151,4 кДж/кг
=0,757(573-373)=151,4 кДж/кг
 =l,013(573-373)=202,6 кДж/кг
=l,013(573-373)=202,6 кДж/кг
 кДж/кг
кДж/кг
w 12  кДж/кг
кДж/кг
q12 = 0, dS =  q/T = 0,
q/T = 0, 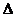 S12 = 0, следовательно, S1 = S2
S12 = 0, следовательно, S1 = S2
Остальные процессы цикла рассчитываются аналогично, используя формулы табл.2.
Результаты расчетов сведены в табл. 7
| Процесс | 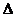 u
кДж/кг u
кДж/кг
| 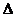 h
кДж/кг h
кДж/кг
| w кДж/кг | l кДж/кг | q кДж/кг | 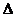 S
кДж/кг·К S
кДж/кг·К
|
| 1-2 | 151,4 | 202,6 | -201,8 | -150,6 | 0 | 0 |
| 2-3 | 500,8 | 647,5 | 0 | 146,6 | 647,4 | 0,783 |
| 3-4 | 0 | 0 | 90,0 | 90,0 | 90,0 | 0,079 |
| 4-5 | -131,5 | -167,8 | 109,0 | 72,7 | -58,8 | -0,055 |
| 5-1 | -520,6 | -682,0 | 162,0 | 0 | - 520,6 | -0,817 |
| Показатели цикла |  =0,1
=0,1
|  =
=0,3 =
=0,3
|  =159,2
=159,2
|  =158,7
=158,7
|  =158
=158
|  = – 0,01
= – 0,01
|
Термический к.п.д. цикла  ;
;
q2 = q45 + q51 = – 58,1–520,6= – 579,4 кДж/кг;
q1 = q34 + q23 =674,4 +90 = 737,4 кДж/кг;
lц=q1 –  = 737,4-579,4 = 158кДж/кг.
= 737,4-579,4 = 158кДж/кг.
Построение цикла в Р -V и Т -S координатах
При изображении цикла в координатах Р-V (рис.2) сначала строятся характерные точки цикла (1, 2, 3, 4, 5) по известным значениям давления и удельного объема. Затем - процессы, изображаемые прямыми линиями - изобарический процесс 2- 3 и изохорический процесс 5-1. Для построения криволинейных процессов - адиабатического 1-2, изотермического 3 - 4 и политропного 4 - 5 - необходимо определить две-три промежуточные точки между характерными точками по уравнению процесса (pVk = idem, pV = idem, pVn = idem).
При построении цикла в координатах Т -S (рис.3) также сначала строятся характерные точки цикла по значениям T и  . Так как абсолютное значение энтропии неизвестно ни для одной из точек, то энтропия
. Так как абсолютное значение энтропии неизвестно ни для одной из точек, то энтропия  выбирается произвольно, затем строятся процессы, изображаемые прямыми линиями - изотермический и адиабатный. При построении промежуточных точек криволинейных процессов температуры этих точек задаются, а изменение энтропии определяется по формулам (табл.2). Например, для процесса 4-5 задается промежуточная температура
выбирается произвольно, затем строятся процессы, изображаемые прямыми линиями - изотермический и адиабатный. При построении промежуточных точек криволинейных процессов температуры этих точек задаются, а изменение энтропии определяется по формулам (табл.2). Например, для процесса 4-5 задается промежуточная температура  = 1100 К, а изменение энтропии определяется:
= 1100 К, а изменение энтропии определяется:
 кДж/кг·К,
кДж/кг·К,
где  - средняя массовая изохорная теплоемкость смеси в процессе 4-5.
- средняя массовая изохорная теплоемкость смеси в процессе 4-5.
Таким образом, используя данные расчета характерных и промежуточных точек, термодинамический цикл изображается в масштабе в Р -V и Т -S координатах на миллиметровой бумаге (формат А4), (рис.2, 3)

(S1 выбираем произвольно) 




Рис. 2. Расчетный цикл в координатах T-S

Рис. 3. Расчетный цикл в координатах P-V
Средняя массовая теплоемкость при постоянном давлении
 в диапазоне температур от 0ºС до 1ºС, кДж/кг·К
в диапазоне температур от 0ºС до 1ºС, кДж/кг·К
Таблица №8
| O2 | N2 | CO | CO2 | H20 | воздух | |
| 0,915 | 1,039 | 1,040 | 0,815 | 1,860 | 1,003 | |
| 0,923 | 1,040 | 1,042 | 0,866 | 1,873 | 1,006 | |
| 0,935 | 1,043 | 1,046 | 0,910 | 1,894 | 1,011 | |
| 0,950 | 1,049 | 1,054 | 0,949 | 1,919 | 1,019 | |
| 0,965 | 1,057 | 1,063 | 0,983 | 1,948 | 1,028 | |
| 0,979 | 1,066 | 1,075 | 1,013 | 1,978 | 1,039 | |
| 0,993 | 1,076 | 1,086 | 1,040 | 2,009 | 1,049 | |
| 1,005 | 1,087 | 1,098 | 1,064 | 2,042 | 1,060 | |
| 1,016 | 1,097 | 1,109 | 1,085 | 2,076 | 1,071 | |
| 1,026 | 1,108 | 1,120 | 1,105 | 2,110 | 1,081 | |
| 1,035 | 1,118 | 1,130 | 1,122 | 2,144 | 1,091 | |
| 1,043 | 1,127 | 1,140 | 1,138 | 2,177 | 1,100 | |
| 1,051 | 1,136 | 1,149 | 1,153 | 2,211 | 1,108 | |
| 1,058 | 1,145 | 1,158 | 1,166 | 2,243 | 1,116 | |
| 1,065 | 1,153 | 1,166 | 1,178 | 2,275 | 1,124 | |
| 1,071 | 1,160 | 1,173 | 1,190 | 2,305 | 1,131 | |
| 1,077 | 1,167 | 1,180 | 1,200 | 2,335 | 1,138 | |
| 1,083 | 1,174 | 1,186 | 1,209 | 2,363 | 1,144 | |
| 1,089 | 1,180 | 1,192 | 1,218 | 2,391 | 1,150 | |
| 1,094 | 1,186 | 1,198 | 1,226 | 2,417 | 1,156 | |
| 1,099 | 1,191 | 1,203 | 1,233 | 2,442 | 1,161 | |
| 1,104 | 1,197 | 1,208 | 1,241 | 2,466 | 1,166 | |
| 1,109 | 1,202 | 1,213 | 1,247 | 2,490 | 1,171 | |
| 1,114 | 1,206 | 1,218 | 1,253 | 2,512 | 1,176 | |
| 1,118 | 1,210 | 1,222 | 1,259 | 2,534 | 1,180 | |
| 1,123 | 1,214 | 1,226 | 1,264 | 2,555 | 1,184 | |
| 1,127 | 1,220 | 1,233 | 1,272 | 2,575 | 1,188 | |
| 1,132 | 1,225 | 1,238 | 1,277 | 2,594 | 1,192 | |
| 1,137 | 1,230 | 1,243 | 1,283 | 2,612 | 1,197 | |
| 1,142 | 1,235 | 1,248 | 1,288 | 2,630 | 1,201 | |
| 1,147 | 1,240 | 1,253 | 1,294 | 2,647 | 1,206 |