Введение
Бионеорганическая химия - одно из самых новых направлений неорганической химии. Задачей бионеорганической химии являются выявление неорганических соединений, участвующих в различного рода биологических процессах, их изучение, математическое и химическое моделирование биологических систем с участием этих соединений и, наконец, управление этими системами и их оптимизация. В курсе неорганической химии при систематическом рассмотрении свойств элементов периодической системы необходимо наряду с другими аспектами останавливаться и на проблемах бионеорганической химии, в том числе отмечать биологическую роль тех или иных неорганических соединений.
Бионеметаллы и биометаллы
В биологических процессах участвует большое число химических соединений, образованных различными элементами периодической системы. Организмы животных и растений состоят из сложных веществ, включающих в свой состав как элементы-неметаллы, так и элементы с металлическими свойствами. Из неметаллов особенно важную роль играют углерод, водород, кислород, азот, фосфор, сера, галогены. Из металлов в состав животных и растительных организмов входят натрий, калий, кальций, магний, железо, цинк, кобальт, медь, марганец, молибден и некоторые другие.
Для того чтобы оценить соотношение количеств химических элементов, входящих в состав живых организмов, полезно рассмотреть содержание биоэлементов в организме «среднего» здорового человека (вес 70 кг). Установлено, что на 70 кг массы человека приходится 45,5 кг кислорода (т. е. больше половины массы), углерода-12,6, водорода - 7,0, азота - 2,1 кг, примерно столько же фосфора. Кальция в человеке 1,7 кг, калия - 0,25, натрия - 0,07 кг, магния - 42 г, железа - только 5 г (химики шутят, что железа в человеке хватит лишь на один гвоздь), цинка - 3 г. Остальных металлов в сумме меньше, чем 1 г. В частности, меди - 0,2 г, марганца - 0,02 г.
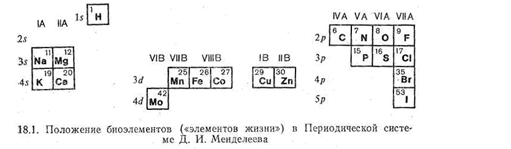
Интересно, что вхождение химических элементов в состав живых организмов не зависит каким-либо простым образом от их распространенности. Действительно, хотя наиболее распространенный на земле элемент - кислород - является важнейшей составной частью соединений, слагающих растительные и животные организмы, такие распространенные элементы, как кремний и алюминий, в их состав не входят, а относительно мало распространенные кобальт, медь и молибден выполняют важную биологическую роль. Следует отметить также, что среди биоэлементов, т. е. элементов, играющих важную роль в построении живого организма и в процессах поддержания его жизни (обмен веществ, метаболизм), находятся очень сильно различающиеся по своим химическим свойствам, размерам частиц и электронному строению металлы и неметаллы. Например, среди биометаллов (их часто называют «металлами жизни») есть элементы, образующие ионы с благородногазовой электронной «подкладкой», несклонные к проявлению переменной валентности (Na+, K+, Mg2+, Са2+). Наряду с этим есть среди биометаллов и элементы с 18-электронной (Zn2+) или недостроенной 18-электронной «подкладкой» (Cu2+, Co2+, Fe2+, Fe3+, Mo(V), Mo(VI)). Последние склонны изменять степень окисления в ходе обмена веществ.
Среди перечисленных биометаллов есть элементы, образующие преимущественно ионные (Na, К) и ковалентные связи (Mo, Zn); сильные комплексообразователи, такие, как Fe3+, Co2+, Cu2+, Zn2+. Однако и менее прочные комплексы, образованные, например, ионами Са2+, Mg2+, Mn2+, играют важную биологическую роль, и даже ионы щелочных металлов (Na+, К+) в метаболических процессах вовлекаются в образование комплексов (с участием макроциклических лигандов). Установлено, что большое значение имеют размеры ионов металлов, участвующих в процессах метаболизма.
Так, например, не очень большая разница в величинах ионных радиусов Na+ (0,98 А) и К+ (1,33 А) обусловливает очень большую разницу в радиусах гидратированных ионов. Это приводит к неодинаковой роли ионов Na+ и К+ в процессе метаболизма: Na+ - внеклеточный, а К+-внутриклеточный ионы. Именно размеры ионов, а также характерный для данного иона тип химической связи определяют, на какие ионы может замещаться тот или иной ион в процессе метаболизма. Установлено, что ионы К+ могут замещаться в живых тканях на крупные однозарядные катионы щелочных металлов (Rb+, Cs+), а также на сходные по размерам ионы NH4+ и Т1+. Напротив, относительно маленький ион Na+ может замещаться только на Li+. Интересно, что обмен на ионы Cu+ не происходит, видимо, из-за склонности Cu+ к образованию ковалентных связей, хотя размеры Cu+ и Na+ сходны.
Очень важно, что ионы Mg2+ и Са2+ в биосистемах не замещают друг друга. Это связано, как полагают, с большей ковалентностью связи Mg2+ с лигандами по сравнению с Са2+. Еще более ковалентные связи с лигандами образует Zn2+, он не замещается на Mg2+, хотя близок к нему по величине ионного радиуса.
Согласно. К. Б. Яцимирскому, оценку ионности и ковалентности связей ионов биометаллов с лигандами целесообразно проводить следующим образом. Ионность связи пропорциональна отношению квадрата заряда иона к величине ионного радиуса. Это отношение для большинства ионов находится в пределах от 1 до 5. Только для бериллия это отношение аномально велико и составляет 11,7. Именно с этим связывают высокую токсичность иона Ве2+.
Ковалентность связи металл-лиганд, по Яцимирскому, можно оценить как отношение
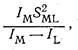
где I м и I l - потенциалы ионизации (валентных состояний) металла и лиганда соответственно; S ml - интеграл перекрывания орбиталей, взаимодействующих при образовании ковалентной связи. Ковалентность биометаллов, охарактеризованная таким способом, обычно изменяется в интервале 20-135. При малой ковалентности связи наиболее устойчивыми оказываются соединения ионов металлов с кислородом. По мере роста ковалентности все более устойчивыми оказываются соединения со связью металл-азот и, особенно, со связью металл-сера. Такую же корреляцию дает классификация Пирсона, согласно которой «жесткая» кислота соединяется с «жестким» основанием,, а «мягкая» кислота - с «мягким» основанием.
Бионеорганическая химия рассматривает не только те элементы и их соединения, которые присутствуют в нормально функционирующем живом организме, но и те элементы (и их соединения), которые, не являясь составной частью здорового организма, могут оказывать на него то или иное воздействие, попадая в организм извне. Речь идет о взаимодействии живого организма с ядовитыми веществами, попавшими в организм случайно или накопившимися в нем, например, в результате неправильной работы тех или иных органов (производные свинца, кадмия, ртути и др.).
Надо учитывать, что очень важной является дозировка различных элементов и их соединений в живом организме. Доказано, что один и тот же элемент может положительно влиять на организм в целом и одновременно быть сильным ядом в случае его передозировки. Уже упоминалось, что цинк принадлежит к числу важнейших биометаллов: ионы Zn2+ входят в состав нескольких десятков ферментов, катализирующих протекание жизненно важных процессов. В то же время установлено, что при слишком высоком содержании Zn2+ в тканях он оказывает канцерогенное действие.
Примером того же типа может быть селен, который, вообще говоря, не причисляют к биометаллам. Однако в последнее время установлено, что уменьшение содержания селена в пище, потребляемой человеком за день, с 0,3-0,5 мг (Япония) до 0,1-0,2 мг (США, ФРГ) приводит к резкому возрастанию числа раковых заболеваний грудной железы у женщин (более чем в 5 раз). Полагают, что низкое содержание селена в пищевых продуктах, вырабатываемых в странах с высокоразвитой химической промышленностью, связано с большим содержанием в атмосфере соединений серы, вытесняющих селен из природных объектов. В Японии нехватка селена в пище меньше, так как многие пищевые продукты, извлекаемые из моря, содержат большое количество селена.
В задачи бионеорганической химии входит изучение строения и биологической роли неорганических соединений. Эти исследования проводят различными физико-химическими методами, а также методами биологии и биохимии, включающими и математическое моделирование. Бионеорганические исследования имеют первостепенную важность для решения задач медицины, охраны окружающей среды, неорганической технологии. Далее мы кратко рассмотрим свойства и строение некоторых лигандов, играющих важнейшую роль в биологии, в частности соединения, закомплексовывающие биометаллы, а затем перейдем к характеристике свойств важнейших бионеорганических соединений и их роли в процессах жизнедеятельности животных и растений.
Важнейшие биолиганды
Биолиганды - это молекулы или ионы, взаимодействующие в организме с биометаллами. Многие из них называются «молекулами жизни». К числу биолигандов относятся главным образом органические соединения. Однако и неорганические лиганды, хотя их существенно меньше, играют в процессах метаболизма важную и незаменимую роль. Это неорганические анионы, такие, как галогенид-ионы (F-, С1-, I-), сульфат - и нитрат-ионы, а также гидроксил-, фосфат - и карбонат-ионы, образование и гидролиз которых вносят немалый вклад в энергетическую «копилку» живого организма. Это, наконец, нейтральные молекулы Н2О, О2, СО2, NH3. Без этих лигандов метаболизм, питание и сама жизнь организма невозможны.
Поэтому исследование взаимодействия с упомянутыми неорганическими веществами ионов биометаллов, а также других катионов, попадающих в организм извне, - важнейшая задача биохимии. Взаимодействия, реализующиеся в биосистемах, не являются специфическими и рассматриваются в рамках обычных курсов неорганической химии. Поэтому ниже будут представлены сведения лишь о лигандах, характерных именно для биосистем или моделирующих эти системы.
Комплексы с полидентатными и макроциклическими лигандами
Основной особенностью биолигандов является их принадлежность к числу полидентатных и (очень часто) макроциклических лигандов.
Как известно, особая устойчивость комплексных соединений, образованных ионами металла с полидентатными лигандами, объясняется образованием одной молекулой (или ионом) лиганда с данным центральным ионом (катионом металла) одного или нескольких хелатных циклов. Согласно правилу Чугаева, наиболее устойчивыми являются пятичленные хелатные циклы (для систем без кратных связей) и шестичленные циклы (для систем с сопряженными двойными связями). Напомним, что энергетическая выгодность замыкания хелатных циклов (хелатный эффект) определяется как энтропийным, так и эн-тальпийным факторами. Рассмотрим в качестве примера комплексообразование Ni2+ с аммиаком и этилендиамином еп:
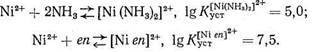
|
В обоих комплексах ион Ni2+ координирует два атома азота. Большая величина Kуст в случае этилендиаминового комплекса, несомненно, связана с хелатным эффектом: в комплексе [Niеn]2+ имеется пятичленный хелатный цикл, тогда как у комплекса [Ni (NH3)2]2+ - «открытое» строение:

|
Координационно насыщенные аммиакаты Ni2+ имеют состав [Ni(NH3)4]2+ или [Ni(NH3)6]2+.
Установлено, что разница в величинах констант устойчивости этих двух комплексов (A lgKуст = 2,5) определяется энтальпийным (∆H= - 1,9 ккал/моль) и энтропийным вкладом (∆S = 6,2 кал/град*моль). Разницу в величинах энтальпии образования этих соединений объясняют тем, что в случае [Nien]2+ двум атомам азота, входящим в координационную сферу Ni2+, не нужно преодолевать взаимного отталкиваия (в отличие от комплекса [Ni (NH3)2]2+). Атомы азота этилендиамина уже включены в состав одной молекулы («сближены» друг с другом). Кроме того, при образовании [Niеn]2+ меньше энергии требуется для дегидратации лиганда, чем в случае [Ni (NH3)2]2+: молекулы аммиака меньше по размеру, чем еп, они сильнее гидратируются.
Разница в величинах энтропийных факторов при образовании хелатного и «открытого» комплексов обусловлена увеличением числа частиц при протекании реакции тогда как при синтезе в водном

растворе диаммиаката никеля (II) в результате комплексообразования число частиц не меняется:

|
что связано с бидентатностью еп и монодентатностью NH3.
Как указывает Яцимирский, кроме хелатного эффекта в природных металлокомплексах, образованных биолигандами, часто осуществляется макроциклический эффект. В качестве примера рассматриваются термодинамические характеристики комплексов меди с лигандами L` и L" одинаковой дентатности и сходной природы, но только в L" цепь замкнута в макроцикл:
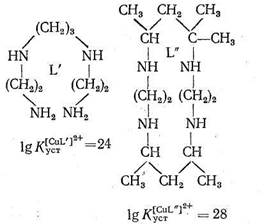
Как видно из приведенных данных, тетрадентатный лиганд L", представляющий собой макроцикл, при прочих равных условиях образует с Cu2+ комплекс, в 104 раз более устойчивый, чем такой же тетрадентатный лиганд L`, имеющий незамкнутое цепочечное строение. Природа макроциклического эффекта в полной мере еще не раскрыта, однако можно полагать, что вхождение центрального иона металла в готовую «полость» макроциклического лиганда приносит существенную энергетическую выгоду по сравнению с ситуацией, когда такой готовой полости нет и ее нужно создавать в процессе комплексообра-зования.
Одним из простейших среди природных макроциклических лигандов является энниатин - 18-членный гексадентатный лиганд, включающий кислотные остатки N-метил-валина и о -гидроксивалериата:
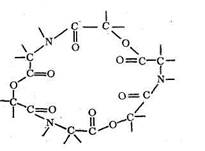
Энниатин и подобные ему макроциклические лиганды выполняют в живых организмах роль «ионофоров»: они включают в свою полость те или иные ионы металлов и в таком закомплексованном виде переносят их через биомембраны, регулируя, таким образом, содержание ионов металлов во внеклеточном пространстве и внутри клеток.
В последнее время выполнены важные работы по моделированию природных систем с металлокомплексами, образованными макроциклическими лигандами. В качестве «модельных» лигандов использовались так называемые «короны» (или краун-эфиры) и «криптаты».
Примером простейших корон, являющихся двухмерными (плоскостными) лигандами, могут служить следующие:

Дициклогексил-14-корона-4 Бензо-18-корона-6
Номенклатура краун-эфиров, как видно из приведенных названий и формул, указывает на общее число атомов в макроцикле и число гетероатомов, формирующих полость короны и выполняющих функции доноров.
Экспериментально установлено, что устойчивость комплексных соединений ионов металлов с коронами определяется соотношением размеров иона металла и полости короны. Наибольшая прочность макроциклических комплексов достигается, когда полость плотно «обхватывает» ион металла. Если полость слишком велика или мала, устойчивость комплексов уменьшается.
Те же закономерности были установлены для систем, в которых комплексообразование ионов металлов осуществляется с помощью макроциклических лигандов - криптатов, представляющих собой трехмерные лиганды с полостью, обрамленной тремя углеродными цепями, включающими гетероатомы. Общая формула криптатов имеет вид:

Таким образом, криптаты можно рассматривать как бициклические кислород-донорные лиганды с концевыми атомами, роль которых выполняют третичные атомы азота.
Полагают, что криптаты могут обладать большой избирательностью (селективностью) по отношению к биометаллам, например, природный макроциклический лиганд валиномицин селективен к ионам К+. Ниже приведены значения lgКуст комплексов криптатов и ионов щелочных металлов, образованных лигандами различной дентатности. Число донорных атомов в криптате влияет на размеры полости этого трехмерного макроциклического лиганда и, следовательно, на соотношение размеров комплексообразующего иона металла и полости, а значит и на устойчивость образующегося комплекса:
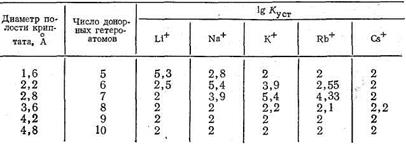
Интересно, что оптимальный лиганд для Li+ содержит в полости макроцикла пять донорных атомов. Увеличение числа донорных атомов и соответственно размеров полости приводит к уменьшению стабильности криптата лития. Для иона Na+ оптимальные размеры полости криптата отвечают 6-дентатному лиганду, для иона К+ - 7-дентатному. Для иона Rb+ устойчивость комплекса в оптимальных условиях ниже, чем для К+, и еще более она падает в случае иона цезия - самого большого по размерам среди ионов щелочных металлов. По-видимому, независимо от размеров полости для большого иона Cs+ прочность связи с лигандом мала из-за уменьшения энергии электростатического взаимодействия Cs+-лиганд.
Итак, исследование криптатов щелочных металлов показывает, что, регулируя состав и геометрию макроциклических лигандов, можно добиться их высокой селективности по отношению к ионам металлов, входящих в состав комплексов.
Состав и строение природных ионофоров, упрощенными моделями которых являются краун-эфиры и криптаты, сложны и многообразны.
Понятно поэтому, что в биосистемах может быть достигнута высокая селективность действия макроциклических лигандов, это и определяет их «узкую специализацию» в процессах метаболизма.
Биополимеры, на основе которых строится комплексообразование в биологических системах
Наиболее важными биополимерами, обеспечивающими процессы обмена веществ в животных и растительных организмах, в том числе процессы, протекающие с участием комплексных соединений металлов, являются полисахариды, белки и нуклеиновые кислоты.
Среди полисахаридов наибольшее значение имеют крахмал, гликоген и целлюлоза. Основным звеном в построении полимерных цепей полисахаридов являются остатки D-глюкозы. Нециклическая D-глюкоза легко циклизуется, образуя две равновесные формы:
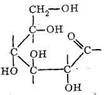

При полимеризации α - и β-формы D-глюкопиранозы соединяются в полимерную цепь через кислородные мостики:
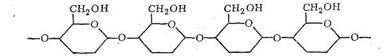
Если полимеризуется α-форма, то цепь полимера оказывается разветвленной - получается крахмал и гликоген. При полимеризации β-формы образуется цепочечный неразветвленный полимер - целлюлоза, которая, как известно, обладает волокнистым строением.
Полисахариды, как видно из приведенных формул, имеют в своем составе кислородные атомы, способные проявлять донорные функции. Таким образом, полисахариды, в виде которых организм запасает углеводы (крахмал, гликоген) и которые используются для построения оболочек растительных клеток (целлюлоза), являются полимерными лигандами.
 Другой тип биополимерных лигандов - белки (протеины). Белки представляют собой полимерные образования, в которых в том или ином порядке чередуются 23 α-аминокислоты. Строение всех аминокислот может быть описано формулой
Другой тип биополимерных лигандов - белки (протеины). Белки представляют собой полимерные образования, в которых в том или ином порядке чередуются 23 α-аминокислоты. Строение всех аминокислот может быть описано формулой
Различаются они только природой радикала R. α-Аминокислоты, вступая в реакцию полимеризации, образуют пептидную цепь:
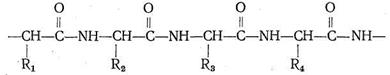
Подобно тому как из 32 букв алфавита путем их различного сочетания можно составить огромное количество слов, так из 23 α-аминокислот посредством их сочленения в том или ином порядке получается все многообразие белковых тел, существующих в природе, образуется так называемая первичная белковая структура. Кроме того, рассматривают вторичную, третичную и четвертичную структуру.
Вторичная структура (α - и β-конформации) возникает в результате взаимодействия полипептидных цепей друг с другом. α-Конформация имеет спиралеобразное строение, каждый виток спирали содержит от трех до семи аминокислотных фрагментов. Взаимодействие между соседними полипептидными цепями в такой спирали осуществляется посредством водородных связей, образованных карбонильным кислородом одной цепи с иминогруппой другой цепи:
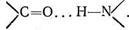
Редко встречающаяся β-конформация содержит вытянутые друг возле друга неспиральные полипептидные цепи.
Третичная структура белка - это глобулы, образованные α-вторичной структурой в результате свертывания полипептидных цепей в клубки. Свертывание α-спиралей в глобулы происходит в результате взаимодействия друг с другом гидрофобных участков спирали, электростатического взаимодействия заряженных участков цепи, образования сульфидных мостиков и водородных связей.
Четвертичная структура возникает в результате объединения глобул в еще более сложную структуру.
Свойства белков как биолигандов определяются содержанием в полипептидных цепях донорных атомов азота и кислорода, которые могут участвовать в образовании хелатных циклов и макроциклических комплексов. Кроме того, к полипептидным цепям через различные функциональные группы могут быть привязаны порфириновые кольца. Порфирин содержит четыре пиррольных ядра (с различными заместителями):
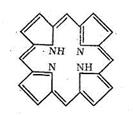
Как видно из схемы, порфирин представляет собой пример макро-циклического лиганда с четырьмя донорными атомами азота, которые координируются ионами металла, если создаются условия для вытеснения двух протонов порфирина и замещения их на ионы металла. Размер полости порфирина составляет около 2Ǻ (диаметр). Порфирин принадлежит к числу «жестких» лигандов, структура которых (и размер полости) мало зависит от природы координируемого иона металла. Порфириновые металлоциклы содержатся в хлорофилле и гемоглобине. Строение порфиринсодержащих комплексов биометаллов будет рассмотрено дальше.
Нуклеиновые кислоты - третий вид наиболее важных биополимерных лигандов. Роль нуклеиновых кислот в биосистемах состоит в хранении и передаче информации о строении синтезируемых организмом белков. Нуклеиновые кислоты состоят из мономеров - нуклеотидов. Каждый нуклеотид содержит фрагменты углевода, гетероциклического основания и остаток фосфорной кислоты. Нуклеотиды соединяются в нуклеиновые кислоты по следующей схеме:
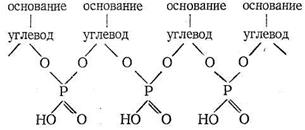
Примером гетероциклических оснований могут служить аденин и урацил:

В качестве углеводного компонента нуклеиновых кислот выступают рибоза и продукт ее восстановления - дезоксирибоза:

В зависимости от природы углеводного фрагмента нуклеиновые кислоты делятся на две группы: рибонуклеиновые (РНК) и дезоксирибонуклеиновые (ДНК) кислоты. ДНК в растворах имеют строение двойных спиралей. Внутрь спирали обращены гетероциклические основания, скрепленные друг с другом водородными связями, наружу обращены фосфатные группировки. Совершенно ясно, что ДНК и РНК обладают свойствами лигандов: донорные атомы имеются во всех фрагментах нуклеиновых кислот.
Кроме белков, полисахаридов и нуклеиновых кислот в биосистемах обычно присутствует большое число других химических соединений, проявляющих свойства лигандов и обладающих биологической активностью. Среди них особенно важную роль играют различные органические кислоты, как насыщенные, так и ненасыщенные, например аскорбиновая кислота:
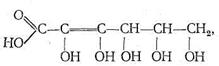
производные фосфорной кислоты (такие, как аденозинфосфаты, липиды) и др.