YOUJIAN YANG, BINGLIANG GAO, 12 ZHAOWEN WANG, ZHONGNING SHI, и XIANWEI HU '1-Школа материалов и металловедения, Северо-Восточный университет, Mail Box 117 Шэньян. Китай 2-e-mail: blgaomail.neu.edu.en
Исследована зависимость скорости растворения от спецификаций глинозема и химического состава ванны, включая состав электролита, рабочую температуру и перегрев. Основные физико-химические свойства образцов промышленного глинозема были испытаны с учетом содержания влаги, потерь при прокаливании, площади поверхности и фазового состава. Растворение этих образцов в нескольких композициях ванн наблюдали через кварцевый тигель, снабженный системой визуальной записи. Скорость растворения увеличивалась с увеличением потерь на прокаливание и площадь поверхности. Рабочие температуры и существующая концентрация оксида алюминия в электролите оказали большее влияние на скорость растворения оксида алюминия, чем незначительное изменение состава ванны и перегрева. Те же тенденции были получены и для образцов лабораторно-кальцинированного оксида алюминия.
ВСТУПЛЕНИЕ.
Промышленные алюминиевые заводы используют глинозем в качестве сырья для электролиза. Растворение глинозема в ванне с расплавленным эриолитом является долгой и сложной задачей, которая влияет на процесс Байера для производства глинозема. В течение последних десятилетий промышленное производство глинозема улучшилось за счет понижения температуры усвоения боксита в процессе Байера и разработки технологии мгновенного прокаливания гиббсита. Однако для достижения оптимальной эффективности энергопотребления концентрация глинозема в коммерческих ячейках поддерживалась на низком уровне 2-3 мас.%. Наряду с увеличением размера алюминиевых ячеек и появлением коммерческих ячеек на 400 кА, 500 кА и даже 600 кА эффективная дисперсия подаваемого оксида алюминия становится все более важной. Все это создает потребность в более высокой скорости растворения промышленного глинозема. Фазовые превращения глинозема сочетаются, так как многие параллельные реакции сосуществуют. «Для производства глинозема плавильного качества (SG глинозем) требуется продукт с максимальным процентным содержанием метастабильного y-Al2O3, и минимальным количеством альфа-Al2O3. Во время прокаливания гиббсита происходят фазовые переходы частиц оксида алюминия, и параметры обработки, включая скорость нагрева и рабочую температуру, контролируются для обеспечения возможности фазовых переходов в следующем порядке: AKOH), - AIOOH -y- Al, 0, - y - AlOs -8- AlO, -0- AlOs- AlOs1). Во время этого процесса фазового превращения гиббс-сайт от осаждения процесса Байера последовательно обезвоживается. Гидроксил отрывается от решетки оксида алюминия, что говорит о том, что происходит фазовый переход. Следовательно, характеристики получаемого глинозема тесно связаны с фазовыми переходами: • Влага при воспламенении (MOI, также называемая LOI 25-300) представляет собой содержание адсорбированной воды в глиноземе. Поскольку глинозем SG имеет очень большую площадь поверхности, он также может адсорбировать влагу из атмосферы. Hyland 'обнаружил, что количество влаги в этой форме изменяется с температурой окружающей среды и влажностью воздуха, и процесс адсорбции влаги при низких температурах полностью обратим. Большая часть адсорбированной воды испаряется перед контактом с высокотемпературными расплавленными солями. Вытесненная влага способствует выделению фтористого водорода (HF) из алюминиевого элемента, реагируя с горячим дымом, который содержит пары ванны (NAAIF AIF, NasAlFu) и увлеченную ванну. Потеря при прокаливании (LOI 300-1000) используется для представления содержания гидроксила в глиноземе. Поскольку прокаливание гиббсита можно рассматривать как процесс дегидроксилирования гиббсита, LOI также является общим признаком, показывающим степень фазовых переходов, показанных в (1). LOI оксида алюминия SG тесно связан с другими параметрами, которые также описывают степень фазовых переходов. Гидроксил в глиноземе может растворяться и существовать в алюминиевой ванне в течение относительно долгого времени, и при электролизе образуется значительное количество HF. «Металлургические заводы ожидают глинозема с более низким LOI с учетом факторов окружающей среды • Альфа-оксид алюминия является наиболее стабильной фазой оксида алюминия, который не содержит гидроксил с минимальной химической активностью. Чем тщательнее протекают фазовые переходы (1), тем больше образуется альфа-оксида алюминия. Как правило, плавильные заводы ожидают меньшего из-за низкой скорости растворения альфа-фазы оксида алюминия в алюминиевая ванна. Это противоречит, когда также ожидается более низкий LÔI. Однако кальцинирование глинозема SG находится в компромиссном положении. • Площадь поверхности Брунауэра-Эммета-Теллера (BET) физически отражает пористость частиц алюминия. Морфология частиц оксида алюминия изменяется по мере продолжения фазовых переходов. Площадь поверхности BET гамма-оксида алюминия больше, чем у альфа-оксида алюминия. Поскольку первичный оксид алюминия используется в качестве абсорбера Ожидается, что в случае сухих серубберов более высокая площадь поверхности улучшит адсорбционные характеристики. • Содержание мелких частиц (мелкое) описывает процент частиц с размером зерна менее 30 мкм. Фазовые переходы твердых частиц оксида алюминия, особенно AlO, a-AlO, могут вызывать растрескивание из-за изменения объема, что приводит к образованию мелких частиц. Снижение тонкой очистки может снизить потери пыли при транспортировке и кормлении, а также улучшить способность первичного глинозема течь, что обеспечивает технологию сверхплотной подачи. Sterten "и Gilbert" сообщили данные о активности NaF-AIF-CaF-MgFg-AlO, расплавляемого при соотношении 1 <эриолит <4 (CR, мольное отношение NaF к AIF3). Используя эти данные о деятельности в сочетании с данными о давлении пара, данными о растворимости и данными комбинационного рассеяния, реакции растворения оксида алюминия:

Роберт и др. предположили, что Al, OF, образуется при низкой концентрации глинозема с Al, O, F при более высоких концентрациях. Они также предположили, что кислород-обогащенный оксианион Al, 0, F. может образовываться при концентрациях закрытия до предела растворимости в KF-AIF, плавится. Все оксианионы, вероятно, существуют в расплаве, но результаты расчетов показали, что распространенные ионные частицы зависят от CR.
Вместо ионного равновесия Чжан «смоделировал растворимость оксида алюминия в NaF-AIF», термодинамически плавится от 1240 К (967 С) до 1300 К (1027 С), и аналогичные результаты показали, что молярные фракции трех первичных растворенных веществ NaAlOF (кислых растворенных веществ)), NagAlO, F (нейтральный раствор) и Na, A-10, Fe (основной раствор) варьируются в зависимости от CR. Welch и Kuschel. Исследовали скорость растворения почти 20 образцов промышленного глинозема в 86,27 мас.% Na AIF8,3 мас..% AIF-5 мас. CaF 0,43 мас.% Al, O, расплавленные соли. Представлено влияние различных характеристик глинозема на скорость растворения, но они не исследовали влияние изменения химического состава ванны. Skybakmoen и Solheim "дали эмпирическое выражение для растворимости оксида алюминия в расплавленном NasAIF, содержащем различные добавки, включая AIF3, CaFa. MgF и LiF от 1123 К (850 С) до 1323 К (1050 С). Это показывает, что более низкая температура и большее количество добавок в современной ванне уменьшит растворимость глинозема в ванне, что означает увеличение трудностей при растворении глинозема. Хаверкамп »сообщил, что скорость растворения зависит от сочетания теплообмена и контроля диффузии. На основе предыдущих исследований в этой статье были сделаны сравнения нескольких образцов промышленного глинозема и их скорости растворения в нескольких композициях ванн. Спецификации глинозема Были измерены значения g, и скорости растворения были определены количественно из видеозаписей поведения при растворении, наблюдаемого через прозрачный кварцевый тигель.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Химические вещества Образцы глинозема 1-11 представляли собой первичный / свежий глинозем, отобранный из нескольких промышленных металлургических заводов. Процесс прокаливания во вращающейся печи. Образцы 12-16 # были приготовлены нагреванием гиббсита Байера на промышленном оборудовании при 1073 К (800 ° С), 1123 К (850 ° С), 1173 К (900 С), 1273 К (1000 С) и 1373 К (1100 ° С), соответственно, в течение 1 ч. В лаборатории. Химические вещества, использованные в этом исследовании, включая соответствующие обработки, перечислены в таблице I.
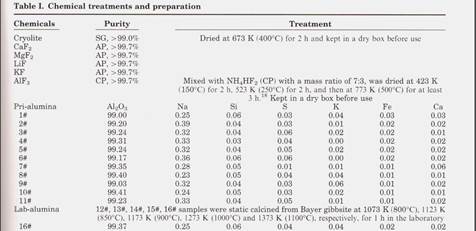
Было установлено, что основным источником примесей является натрий и кремний s в промышленном образце глинозема по данным рентгенофлуоресцентного анализа (XRF).
Аппарат для наблюдения Растворение глинозема
Экспериментальный аппарат для наблюдения за растворением был кварцевый тигель, как схематически показано на рис. 1.
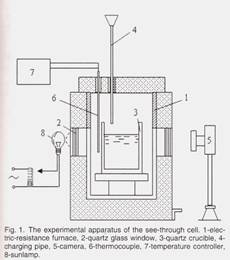
Твердый a-кварцевый тигель с размерами 55 мм x 55 мм x 80 мм с толщиной стенки 3 мм был помещен в центре печи. В фазовом тигле из х-кварца не было изменений объема, вызванных фазовым переходом при нагреве при экспериментальной температуре ниже 1273 К (1000 ° С), что позволило избежать повреждения тигля. Вес электролита в каждом цикле составлял 200 г при высоте ванны расплава 5,5 см Добавка оксида алюминия в ванну с расплавом была разделена на несколько частей. Каждая часть, соответствующая 1% ванны, доставлялась в электролит через корундовую трубку, расположенную на 2 см выше поверхности ванны. Стержень из нержавеющей стали был использован для выемки питающей трубки в случае засорения. Температура ванны поддерживалась стабильной при ожидаемой температуре перед каждым кормлением. Среднее время растворения начиналось, когда оксид алюминия достигал поверхности электролита, пока дно тигля не стало четко видимым. Не было электролиза для всего измерения процесса растворения. Как будет обсуждаться ниже на рис. 4,
емкость растворения различных образцов глинозема при различных рабочих условиях, таких как составы в ванне и температуры, была оценена путем сравнения зарегистрированных времен растворения для 1% (2 г) глинозема. образцы. Кажущуюся скорость растворения каждой добавки оксида алюминия рассчитывали путем деления количества подаваемого оксида алюминия (1%) на соответствующее время растворения. Метод Ритвельда для количественного анализа фазовых композиций оксида алюминия Уточнение Ритвельда с использованием программы FullProf Suite (2.05) было использовано для анализа фазового состава оксида алюминия с использованием рентгеновских дифрактограмм (XRD). Дифракционные данные собирали с помощью дифрактометра Cu-Ka PW3040 / 60 X'Pert Pro MPD (PAN-lytical; Almelo, Нидерланды). Общее время сканирования излучения ПАНалита на было около 1020 с с угловым диапазоном (20) от 5 ° до 90 °. Анализируемые фазы оксида алюминия включали альфа, гамму, гамма-прайм и тета-фазы. (= Rwp / Rexpected) представляет соответствие рассчитанной модели (представленной как Rwp, значение R взвешенного профиля) наблюдаемым данным (представленной как Rexpected, отражающее качество данных) и часто используется в качестве стандарта для оценки совершенство примерки. Если расчетная схема хорошо подогнана и данные дифракции рентгеновских лучей имеют высокое качество, значение должно приближаться к 1,19. При анализе Ритвельда глинозема SG стандартное отклонение <2 считалось приемлемым из-за неопределенности, вызванной массовым производством, например, дефектная кристаллизация и примеси, как также объяснялось в предыдущей публикации.
Измерения распределения частиц по размерам, MOI, LOI и BET.
Площадь поверхности. Распределение частиц алюминия по размерам измеряли с помощью лазерного дифракционного анализатора размера частиц (MASTERSIZER 2000; MALVERN Instruments, UK). Поглощенную воду (MOI или LOI 25-300) измеряли путем нагревания образцов при 573 К (300 ° С) в течение 2 часов. Содержание структурного гидроксила (LOI или LOI 300–1000) рассчитывали по разнице масс образца, прокаленного при 573 К (300 ° С) в течение 2 часов и 1373 К (1100 ° С) в течение 2 часов. Площадь поверхности BET измеряли методом статической адсорбции (рабочая станция PS2-0001A, технология, г. Пекин, Китай). Beishide Instrument РЕЗУЛЬТАТЫИ ОБСУЖДЕНИЕ
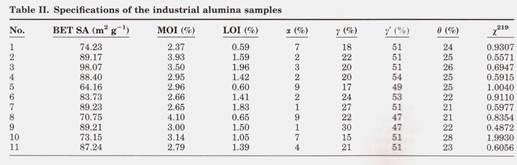
Спецификации глинозема Спецификации образцов глинозема были определены, и результаты приведены в таблице II.
Такие свойства, как площадь поверхности BET, LOI (300–1000), содержание альфа-фазы тесно связаны. На рисунке 2
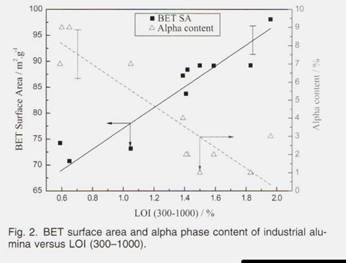 |
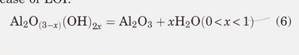
показана взаимосвязь между LOI (300–1000) и площадью поверхности BET / альфа-содержанием образцов 1 # -11 #. Площадь поверхности BET увеличивается с увеличением LOI (300–1000) и уменьшением содержания альфа, что аналогично выводу Kuschel. фазовый переход продолжается, гидроксил выходит из решетки в форме воды, что означает уменьшение LOI:
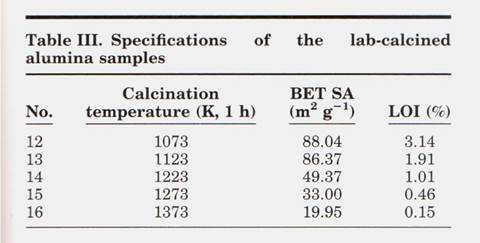 |
Чем тщательнее фазовый переход, тем больше глинозема альфа-фазы в конечном продукте. Поскольку гамма-глинозем имеет большую площадь поверхности, чем альфа-глинозем, увеличение альфа-глинозема соответствует потере BET Площадь поверхности. Как показано в Таблице III, образцы 12 # -16 # представляют собой лабораторный глинозем, который четко демонстрирует тенденции к снижению площади поверхности LOI и BET с температурой прокаливания. Изменения LOI (300– 1000) и площади поверхности BET с температурой прокаливания перечислены в Таблице III
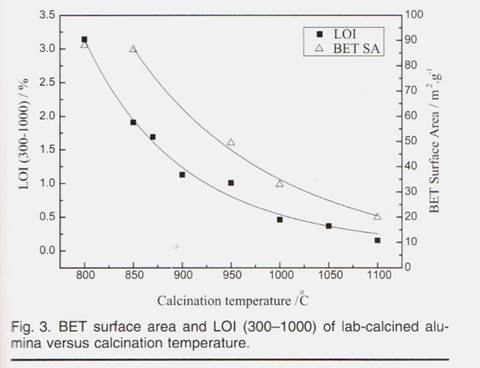 |
и показаны на Рис. 3,

на которой также нанесены LOI образцов, прокаленных при 1143 К (870 ° С), 1173 К (900 ° С) и 1323 К (1050 ° С). Поскольку температура продолжала увеличиваться, гидроксил постепенно выходил из образцов, и также происходило изменение морфологии, что не следует уменьшения LOI и площади поверхности, соответственно. Образец 16 #, который приготовлен при 1373 К (1100 ° С) в течение 1 часа, имел минимальный LOI и площадь поверхности 0,154% и 19,95 м 2 / г соответственно. Анализ Ритвельда спектра XRD показывает, что доля альфа-фазы составляла почти 50%. При низком уровне растворения оксида алюминия в криолитном электролите были проведены испытания, и соответствующие составы ванн перечислены в таблице IV.
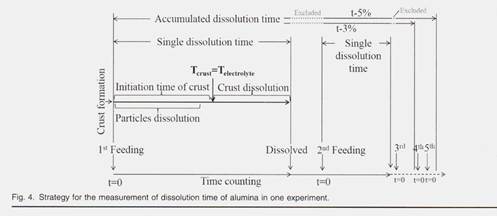
Химический состав ванны был выбран в отношении промышленной алюминиевой ванны. На рисунке 4
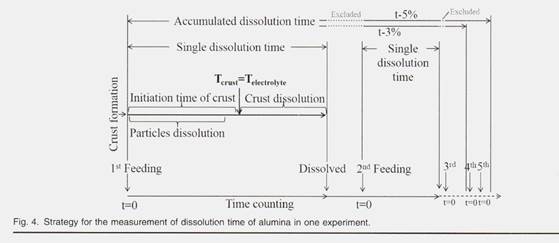
показана стратегия измерения времени растворения оксида алюминия в одном эксперименте. Время растворения для каждой отдельной подачи регистрировали для сравнения скорости растворения различных образцов оксида алюминия и зависимости от химического состава ванны. Введенное здесь суммарное время растворения представляет собой сумму единственного времени растворения первого добавления, второго добавления и так далее. Поскольку в экспериментах не использовались ни электролиз, ни физическое перемешивание, в электролите существует только конвекция, минимизирующая тепломассоперенос во время всего процесса растворения оксида алюминия. Как показано в нашем предыдущем исследовании, некоторые частицы глинозема диспергировались в электролите и быстро растворялись в течение 20 с после добавления глинозема. белая корка размером около 55 мм x 55 мм x 0,5 мм и всплывающая на поверхности электролита более 120 с. Затем кора опустилась на дно тигля. Криолитовые расплавы проникали в эту кору после того, как ванна замерзла при контакте с холодным глиноземом, который превращался в жидкость, которая не начиналась до тех пор, пока температура коры не достигла температуры электролита. Содержание глинозема в земной коре и время ее зарождения после добавления зависели от размеров частиц с земной корой а от теплопередачи, относящихся к рабочей температуре / перегреву. В промышленном производстве растворения, перемешивание выпускающего анодного газа. Тем не менее, корка / глинозем ускоряется за счет гломерата, по-прежнему наблюдается траст до экспериментов, разработанных с перемешиванием, различий при кормлении. Что касается затухающей скорости растворения в кварцевом тигле, то это способствовало различению крошечных растворимостей. Кроме того, поскольку каждое отдельное время растворения для 1% растворения глинозема содержит растворение корки, таким образом, сравнение единственного времени растворения для нескольких добавлений (1% каждый раз) может избежать влияния корки / агломерата на одно большое количество добавки.
Формация, контрастирующая с временем растворения одной однократной подачи (1%) образца оксида алюминия 4 # в ванне 1 и ванне 2 показаны на рис. 5
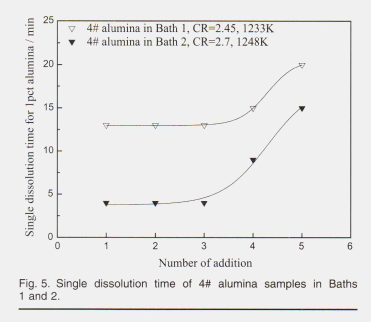
образце, плато для однократного времени растворения 1%, удерживайте химию ванны и глинозем для оксида алюминия появился для обеих кривых при концентрации оксида алюминия ниже 3%. При концентрациях глинозема выше 3% единичное время растворения увеличивается с увеличением концентрации глинозема в электролите. Hu2 и Johnson23 имеют аналогичные критические данные о содержании глинозема 4 %% In, при концентрации In была концентрация для их исследований, когда квасцы менее 4%, преобладающими оксианионами в электролите были Al2OFg * и Al »OF, что относится к растворению реакции вост. 2 и 3, Res. Al2O, F, наблюдались с большим коэффициентом рассеяния на КР 4%. Это подразумевает другую реакцию растворения для нового добавленного оксида алюминия после ионов оксида алюминия, образованных в соответствии с формулой 4 спектр от концентрации глинозема в электролите увеличился до 3% в настоящих экспериментах, где время однократного растворения линейно увеличивается с увеличением концентрации глинозема при увеличении концентрации при Al2O3> 3%. Это предполагает различные этапы контроля скорости при концентрациях сегментированного оксида алюминия. Для концентраций оксида алюминия ниже 3% скорость растворения не зависела от концентрации оксида алюминия, что указывает на то, что порядок реакции был нулевым, а стадия регулирования скорости процесса растворения была химической реакцией. При концентрациях оксида алюминия выше 3% структура существующего расплава стала эффективной, и скорость растворения контролировала скорость диффузии. Однако оксид алюминия в ванне 2 с CR 2,7 показывает более резкое увеличение времени растворения с 3-го добавления до 5-го добавления, чем в ванне 1 с более низким CR 2,45, что означает, что на долю оксианионов также влияет состав расплавов. Более ранние результаты Robert12 и Zhang3 показывают, что Al202F, ²- занимает большую долю в расплавах с более высоким CR, хотя разница между CR = 2,7 расплавов и CR = 2,45%расплавы могут быть недостаточно значительными, чтобы повлиять на критическую концентрацию около 3% в настоящей статье. Образцы оксида алюминия имели более короткое время растворения в ванне 2, чем в ванне 1, так как предыдущий расплав имел более высокую растворимость для оксида алюминия. Время однократного растворения 1% оксида алюминия, представленное на рис. 5, включает образование, нагрев и растворение коры. Температура и характеристики глинозема определяют содержание глинозема и плотность коры при подаче. Плотность коры, которая увеличивалась при проникновении расплавов, изменяла теплопроводность, а затем скорость теплопередачи дополнительно определяла время зарождения коры (рис. 4). Целостность и толщина коры определяют время плавания, а также контролируемое диффузией растворение коры. Следует отметить, что общее количество растворения в каждом эксперименте не соответствует растворимости оксида алюминия из-за ограничения срока службы кварцевого тигля. На рисунке 6 показано суммарное время растворения (описано на рис. 4) для нескольких кормлений.
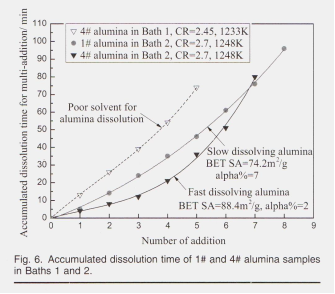
На рис. 6 сравнение графов глинозема с быстрым и медленным растворением, а также электролита с различной способностью растворения представлено графически. Образец 4 # занимал меньше времени растворения при том же количестве добавлений, что и образец 1 #. В отличие от оксида алюминия 1 #, оксид алюминия 4 #, который быстрее растворяется в электролите, обладает большей площадью поверхности по БЭТ и более низким содержанием альфа-фазы, что подразумевает высокую химическую активность. Глинозем растворяется быстрее в ванне 2 (CR = 2,7), чем в ванне 1 (CR = 2,45), потому что ванна 2 имеет более высокую растворимость в глиноземе, как следует из термодинамической оценки, определенной Zhang et al. 13 для NaF-AIF3-Al2O3 плавится при 1300 К (1027 ° С). В их расчетах растворимость оксида алюминия возрастает при увеличении CR от 1,5 до 3,0. Кроме того, Хаверкамп "пришел к выводу, что большие различия между исходной и насыщенной концентрациями глинозема, а также большая разница температур между холодным порошком глинозема и электролитом благоприятствуют процессу диффузии и теплообмена соответственно. A Хорошо принятая модель диффузии для растворения глинозема, предложенная Haverkamp и Welch ", может быть представлена как:
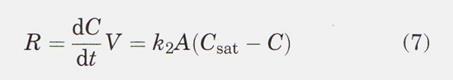
где R - скорость растворения, C - концентрация оксида алюминия в момент времени t, t - время после добавления, V - объем электролита, k2 ̴D/δ - константа скорости, D - коэффициент диффузии, δ - толщина в пограничном слое A - эффективная площадь поверхности оксида алюминия в момент времени t, а Csat - концентрация растворенного оксида алюминия на поверхности оксида алюминия, которая аналогично равна растворимости оксида алюминия для конкретного состава электролита. Как представлено в формуле 7, скорость растворения подаваемого глинозема (R) в значительной степени зависит от разницы между концентрацией глинозема насыщения и текущей концентрацией (Csat-C), так как компонент k2A / V в уравнении можно рассматривать как постоянный в течение короткого периода времени., Для двух составов ванны, показанных на рис. 6, ванна 2, которая имела CR, равный 2,7, в отличие от ванны 1 из 2,45, обладал более высокой растворимостью глинозема (конкретные данные приведены на рис. 9).
Большая мотивация для растворения глинозема проявляется в более коротком времени растворения при том же количестве добавок. Кроме того, увеличение времени растворения для 1% того же образца алюминия при высоких концентрациях (Al2O3> 3%) также может быть объяснено уравнением. 7. Влияние площади поверхности LOI и BET на растворение глинозема. В этой части обсуждаются эффекты влияния поверхности LOI (300–1000) и BET на скорость растворения глинозема.
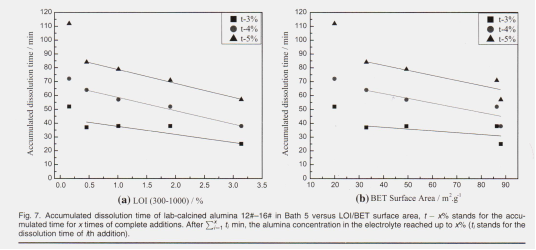
На рис. 7 показаны суммарные времена растворения 12 # –16 # лабораторно обожженных образцов глинозема в ванне 5 с зависимостью от соответствующих L000I (300–1000) и поверхности BET 4%, а t - 5% 0,154% con - погружение (16 #, 1100 ° С, 1 ч, высокая альфа-фаза). Это и происходит потому, что внезапно увеличивается содержание альфа-излучения в области. Как правило, показанная площадь поверхности по БЭТ за исключением LOI = 3%, t линейное уменьшение предварительного нагрева 1373 К (1100 ° C), что выше температуры криминала для альфа-фазы. "LOI (300-1000) SG глинозем интуитивно оценивает температуру гиббсита, что приводит к увеличению альфа-% и уменьшению на рис. 3, как промышленного глинозема, так и лабораторно кальцинированного изменения площади поверхности LOI и BÉT. Оксид алюминия с низким LOI показал низкую поверхность BET площадь у Bests более высокая площадь поверхности BET кальцинирования. Как показано ранее, образцы оксида алюминия показали то же самое обычно также то же самое время. Поскольку площадь поверхности BET отражает частицы оксида алюминия, влияние площади поверхности BET на морфологию скорости растворения оксида алюминия может быть площадью Для диффузионной антропогенной реакции глинозем, относящийся к эффективной / исходной поверхности (обозначен как A 'в уравнении 7), имеет больше оврагов и пор на поверхности, а также более быстрое проникновение и расплавление. более быстрое растворение темп.
Фазовый состав оксида алюминия SG, обычно оцениваемый по содержанию альфа-фазы, определял количество гидроксилов в кристаллах оксида алюминия. быстро превращает температуру поверхности расплавов с фторидом в виде гидроксильных форм в альфа-фазу на алюм-катализаторе с высоким содержанием носителя, гамма-фазе. Разрушение частиц оксида алюминия и выделения влаги (газообразного) во время фазового превращения ведут себя как перемешивание частиц оксида алюминия во время растворения. Таким образом, образцы глинозема с более низким содержанием альфа должны иметь более высокую скорость растворения. однако, флюенс от содержания фазы альфа-альфа может не привести к тому, что современная газовая суспензия и кальцинаторы с циркулирующим псевдоожиженным слоем сохраняют низкое содержание альфа. Методология, представленная в этой статье, сводит к минимуму теплопередачу между глиноземом и электролитом по сравнению с энергично перемешиваемым электролитом, ожидается, что меньше глинозема будет растворяться при подаче, и это будет значительным фактором. больше глинозема сформировало корку и затем превратилось в альфа-глинозем. Следовательно, влияние состава фазы оксида алюминия на скорость растворения не наблюдалось. Влияние химического состава ванны на растворение глинозема Влияние концентрации глинозема и перегрева на растворение глинозема Наряду с непрерывной подачей образцов глинозема в одном эксперименте увеличение концентрации глинозема в электролите приводило к увеличению перегрева. Каждый 1% растворения глинозема соответствует снижению температуры ликвидуса на 4-6 К (4-6 ° С). Перегрев электролита изменяется по мере растворения оксида алюминия. Время растворения для 1% l # -4 # оксида алюминия в ванне 2 при 1228 К (955 ° С) суммировано и показано с перегревом и концентрацией оксида алюминия на фиг. 8.
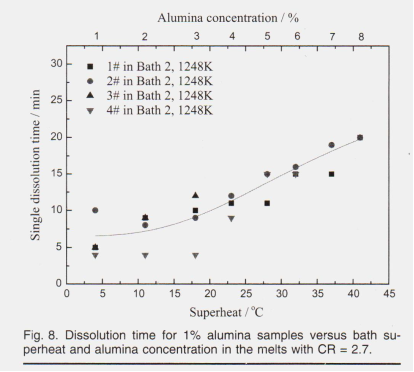
Как показано на фиг. 8, время растворения было относительно независимым концентрации глинозема при содержании глинозема ниже 3%, после чего время растворения линейно увеличивается с существующей концентрацией глинозема в электролите. Критические точки изменения скорости растворения также были описаны Hu22 и Johnson23 на уровне 4%. Это явление можно объяснить различными реакциями растворения при различной концентрации глинозема, как показано на рис. 5. Перегрев ванны - это разница между температурой ликвидуса ванны и рабочей температурой. Это различие важно для обеспечения движущей силы для стабильной теплопередачи алюминиевого восстановительного элемента. Перегрев также важен для процесса растворения глинозема, который предотвращает серьезное замедление, вызванное локальным охлаждением, и увеличивает теплообмен во время эндотермический процесс растворения. Лесс2 и Джонсон указывают на перегрев ванны. В их исследованиях, когда перегрев поднимается выше 10 К (10 ° C), влияние на скорость растворения незначительно. Графики на рис. 8 показали тот же принцип, положительное влияние перегрева на скорость растворения было полностью покрыто отрицательным влиянием увеличения концентрации глинозема, который подавляет растворение, и пришли к выводу, что существует также критическое значение для вновь добавленного глинозема.
Влияние температуры и растворимости глинозема на растворение глинозема.
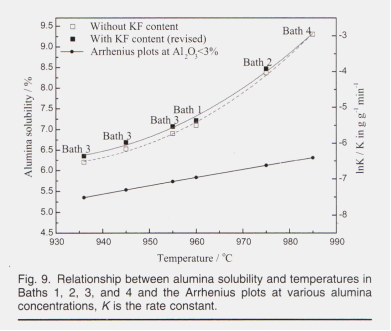
На растворимость глинозема в криолитовых расплавах сильно влияет рабочая температура. Растворимость была сначала рассчитана с использованием уравнения Скибакмуна », а затем пересмотрена с использованием данных измерений, установленных Робертом и др. 12, в связи с существованием содержания KF, которое не включено в уравнение Скибакмуна. Роберт и др. Измерили растворимость глинозема в системе KF-AIF3, растворимость глинозема при 1273 K (1000 ° C) составляет 16,5% и 23,3% при CR (nKF / NA1F3) = 2,0 и 3,0 соответственно, поскольку растворимость глинозема составляет всего 10,0% и 11,9% при тех же условиях в системе NaF-AIF3, эти результаты были затем экстраполированы на систему NaF-KF-AIF3, в которой каждый процент KF мог бы повысить растворимость оксида алюминия примерно на 0,82%. и соответствующая растворимость показана в Таблице V
и на Рис. 9.
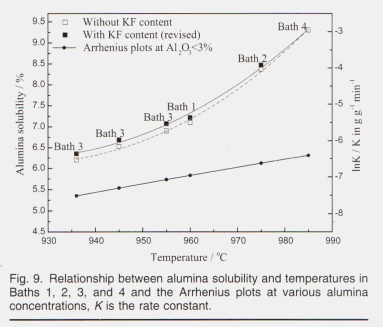
Растворимость демонстрирует доминирующую тенденцию к увеличению с ростом температуры, игнорируя изменение составов ванн, что предполагает, что небольшое количество добавок не может оказать существенного влияния на растворимость. по сравнению с инф влияние температуры. Как описано на рис. 9, влияние температуры на скорость растворения может быть объяснено уравнением Аррениуса, в котором энергия активации практически не изменяется с температурой или энтальпией растворения, тогда как число и тепловое движение активированных ионов 16% 3D при выше усилены Растворимость была сначала рассчитана с использованием уравнения Скибакмуна », а затем пересмотрена с использованием данных измерений, установленных Робертом и др. 12, в связи с существованием содержания KF, которое не включено в уравнение Скибакмуна. Роберт и др. Измерили растворимость глинозема в системе KF-AIF3, растворимость глинозема при 1273 K (1000 ° C) составляет 16,5% и 23,3% при CR (nKF / NA1F3) = 2,0 и 3,0 соответственно, поскольку растворимость глинозема составляет всего 10,0% и 11,9% при тех же условиях в системе NaF-AIF3, эти результаты были затем экстраполированы на систему NaF-KF-AIF3, в которой каждый процент KF мог бы повысить растворимость оксида алюминия примерно на 0,82%. и соответствующая растворимость показана в Таблице V и на Рис. 9. Растворимость демонстрирует доминирующую тенденцию к увеличению с ростом температуры, игнорируя изменение составов ванн, что предполагает, что небольшое количество добавок не может оказать существенного влияния на растворимость. по сравнению с инф влияние температуры. Как описано на рис. 9, влияние температуры на скорость растворения можно объяснить уравнением Аррениуса, в котором энергия активации практически не изменяется с температурой или энтальпией растворения, тогда как число и тепловое движение активированных ионов усиливаются при более высоких значениях. температуры. Следовательно, скорость растворения оксида алюминия находится в положительной корреляции с температурой электролита. Энергия активации процесса обычно определяется по наклону графика логарифма константы скорости (K) относительно обратной абсолютной температуры. Кажущаяся активация Аррениуса 287 кДж моль-1 (69 ккал моль-1) при Al, O3% ниже 3%. Опять же, поскольку эксперименты по растворению в этой работе проводились без физического перемешивания, кажущаяся энергия активации, рассчитанная здесь, была больше, чем сообщенная другими исследователями, 26 как 20–44 ккал моль при 1020–1120 ° C при физическом перемешивании. Относительно высокое значение энергии активации указывает на то, что контролирующая скорость стадия процесса растворения является химической реакцией. Хотя эксперименты по растворению образцов 1 # -9 # проводились в разных составах ванн, как указано в таблице IV, влияние рабочих температур должно быть намного больше, как показано на рис. 9. Значения t - 3% и t - 5% образцов 1 # - 9 # были нанесены на график с рабочими температурами, показанными на рис. 10,
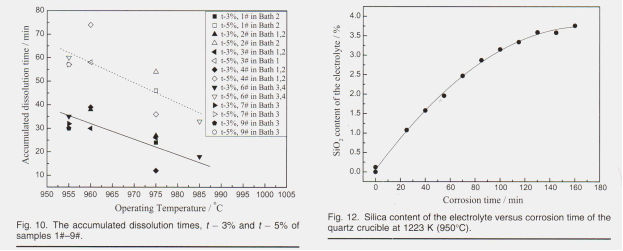 на которых приведены данные без указания конкретных составов ванны. Тем не менее, тенденция изменения времени растворения в зависимости от рабочей температуры все еще отчетливо видна, что свидетельствует о ведущей роли рабочей температуры в скорости растворения глинозема. энергии появились как приблизительно ступени, контролирующие скорость растворения глинозема в криолитовых расплавах. Как обсуждалось ранее, скорость растворения глинозема находится в тесной связи с концентрацией глинозема в расплавах.
на которых приведены данные без указания конкретных составов ванны. Тем не менее, тенденция изменения времени растворения в зависимости от рабочей температуры все еще отчетливо видна, что свидетельствует о ведущей роли рабочей температуры в скорости растворения глинозема. энергии появились как приблизительно ступени, контролирующие скорость растворения глинозема в криолитовых расплавах. Как обсуждалось ранее, скорость растворения глинозема находится в тесной связи с концентрацией глинозема в расплавах.
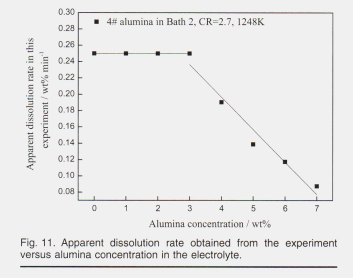
На рисунке 11 показана средняя скорость растворения, полученная из времени растворения. Сегментированные кривые показывают, что скорость растворения вначале была постоянной при Al203 <3%, а затем линейно уменьшалась с увеличением концентрации алюминия. Для расплавов с низкой концентрацией глинозема, вероятно, при Al203 <3%, скорость растворения не зависит от концентрации глинозема, что позволяет предположить, что контролирующая скорость стадия растворения глинозема является химической реакцией. Основные оксианионы, образующиеся при этом A12OF6¯, относятся к реакциям растворения формул. 2 и 3 соответственно. Для расплавов с высокими концентрациями глинозема, обычно при Al2O3> 3%, скорость растворения в значительной степени зависит от содержания глинозема в расплавах, что позволяет предположить, что процесс растворения глинозема контролируется диффузией. Сольватация оксида алюминия происходит быстро в расплавах, далеких от насыщения. До тех пор, пока подача свободного фторидного растворителя в изобилии, скорость реакции замедляется, и тогда будет вовлечена стадия диффузии, как ранее обсуждалось с формулой. 7. Это также соответствует изменению в реакциях растворения, обнаруженных Hu22 Al2O2F4² от Al203 = 4%, ионы начинают образовываться, ссылаясь на формулу. 4. Скорость растворения также сильно зависит от рабочей температуры и растворимости оксида алюминия. Графики Аррениуса показывают тенденцию к увеличению константы скорости (K) с температурой. Кроме того, рабочая температура увеличивает растворимость оксида алюминия, что может повысить скорость растворения в соответствии с уравнением диффузии, описанным в формуле. 7.
Заметка.
В конце, чтобы объяснить вклад кварца, реагирующего с расплавами криолита, и возможные эффекты в растворение частиц оксида алюминия, было проведено испытание на коррозию кварцевого тигля в расплавах с составом 85.8Na3AlF6-1.2 AIF3-3.0Al, O3-5.0LİF-5.0CaF2 (CR = 2,9) при 1223 K (950 ° C), что дает начальный перегрев 16,2 ° C. Отбор проб производился примерно каждые 15 мин. Прозрачные расплавы наблюдались. Содержание SiO2 анализировали с помощью ICP (Optima 4300 DV; PerkinElmer, США), и результаты показаны на фиг. 12.
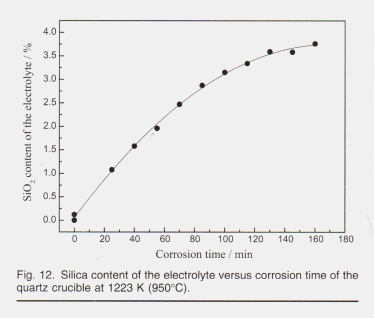
Как показано на фиг. 12, содержание кремнезема в электролите медленно увеличивалось со временем коррозии. Возможно, это было вызвано ограниченной эффективной площадью реакции компактного кварцевого тигля, что сводило к минимуму кинетику растворения кварца. Через 160 мин содержание кремнезема в расплавах достигало 3,76%. Однако в экспериментах по растворению глинозема максимальный период времени для одного эксперимента составлял около 100 минут, и концентрация глинозема, вероятно, достигала бы 8–12%, тогда как содержание кремнезема через 100 минут на рис. 12 составляло 3,15%. Введенный SiO2 может реагировать с Na3AlF6 и Al2O3 и генерировать NaAISi3Os / NAAISIO4 и AIF3, что в некоторой степени снизит CR. Но количество расплавов значительно избыточно по отношению к растворенному кремнезему, поэтому предполагается, что этот эффект будет слабым. Когда к расплавленному криолиту добавляют кислый оксид, подобный кремнезему, сложные оксианионы могут присутствовать в форме AlaSi¿O̟F7® Si.O, F. (4a-2b-c), который разделяет свободный фторидный растворитель с растворением частиц оксида алюминия. Следовательно, методология, использованная в этой работе, вероятно, дает более низкую критическую концентрацию оксида алюминия и более медленную скорость растворения оксида алюминия от момента (3a + 4b-2ć-d) и частиц.
Заметка.
В конце, чтобы объяснить вклад кварца, реагирующего с расплавами криолита, и возможные эффекты в растворение частиц оксида алюминия, было проведено испытание на коррозию кварцевого тигля в расплавах с составом 85.8Na3AlF6-1.2 AIF3-3.0Al, O3-5.0LİF-5.0CaF2 (CR = 2,9) при 1223 K (950 ° C), что дает начальный перегрев 16,2 ° C. Отбор проб производился примерно каждые 15 мин. Прозрачные расплавы наблюдались. Содержание SiO2 анализировали с помощью ICP (Optima 4300 DV; PerkinElmer, США), и результаты показаны на фиг. 12. Как показано на фиг. 12, содержание кремнезема в электролите медленно увеличивалось со временем коррозии. Возможно, это б