Solutio Formaldehydi seu Formalinum
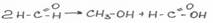 -реакция дисмутации(диспропорционирования)
-реакция дисмутации(диспропорционирования)
Для предотвращения разложения (реакция дисмутации- см.выше) формальдегида к раствору добавляют 1% метилового спирта. При хранении раствора при температуре меньше 90С образуется белый осадок параформа, который не обладает действием формальдегида – ОБРАТНАЯ РЕАКЦИЯ НЕВОЗМОЖНА!
Свойства. Прозрачная бесцветная жидкость со своеобразным резким запвахом. Смешивается с водой и спиртом.
Подлинность:
1)Реакция “серебряного зеркала”.
К AgNO3 добавляют раствор аммиака до растворения образовавшегося осадка к полученному раствору прибавляют препарат и нагревают. По стенкам пробирки образуется металлическое серебро.
2AgNO3+2NH4OH=>Ag2O↓+2NH4NO3
Ag2O↓+4NH4OH=>2[Ag(NH3)2]OH+3H2O
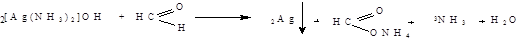
2)Получение ауринового красителя.
В выпарительную чашку помещают препарат, кристаллическую салициловую кислоту и концентрированную H2SO4.Постепенно появляется малиновое окрашивание.

Испытание на чистоту
- не должен быть превышен предел кислотности
- метилового м=спирта не более эталона.
Количественное определение:
Формальдегид может окисляться йодом.

Но реакция обратима, поэтому количественное определение- Метод йодометрии обратное титрование в щелочной среде.
ТНП помещают в банку с притертой пробкой (I2-летуч), добавляют избыток титрованного раствора йода и раствор щелочи и оставляют в темном месте на 10-15 мин.
I2+2NaOH=>NaI+NaIO+H2O

Затем раствор подкисляю серной кислотой, выделившийся йод оттитровывают Na2S2O3 до светло-желтой окраски, затем добавляют крахмал и продолжают титровать до обесцвечивания.
NaIO+NaI+H2SO4=>I2+Na2SO4+H2O
I2+2Na2S2O3=>Na2S4O6+2NaI
Применение.Наружно как антисептическое средство для дезинфекции рук, кожи, инструментов. используют для консервации биологических материалов.
Хранение. В хорошо закрытых банках при температуре не ниже 90С(образуется параформ) Для предохранения полимеризации и реакции дисмутации к раствору добавляют 1% метилового спирта.
Hexamethylentetraminum seu Urotropinum seu Methenaminum

Свойства
Белый кристаллический порошок, гигроскопичный. Запаха не имеет или со слабым запахом. Вкус жгучий, сначала сладкий, затем горьковатый. Хорошо растворим в воде и спирте, растворим в хлороформе, не растворим в эфире. Водные растворы имеют слабощелочную реакцию среды. При нагревании улетучивается, не плавясь. В водных растворах при нагревании гидролизуется с образованием аммиака и формальдегида, в щелочных растворах устоичив, в кислых - гидролизуется. обладает слабоосновными свойствами и может образовывать соли с кислотами, например (CH2)6N4*HCl. Препарат обладает способностью образовывать комплексные соединения со многими солями:
(CH2)6 N4 * 3AgNO3
(CH2)6 N4 * CaCI2
Способен образовывать достаточно прочное соединение с фосгеном(можно применять как средство защиты)
(CH2)6 N4 * HCI
Подлинность
1. Кислотный гидролиз и док-во выделяющихся продукт. реакции.
Препарат растворяют в воде добавляют H2SO4 и нагревают, ощущается характерный запах формальдегида, при добавления избытка щелочи ощущается запах аммиака.
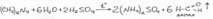

2. Получение ауринового красителя.
Препарат помещают в выпарительную чашку, прибавляют концент. H2SO4 и нагревают, ощущается запах формальдегида и постепенно появляется малиновое окрашивание.
а) 
б) 
Испытание на чистоту
- отсутствие солей аммония и органических примесей
- отсутствие параформа
- хлоридов, сульфатов и солей тяжелых металлов не более эталона.
Количественное определение
По ГФ.
1. Метод ацидиметрии обратное титрование
ТНП растворяют в воде и прибавляют избыток титрованного раствора H2SO4. Нагревают на водяной бане, затем раствор охлаждают и титруют раствором щелочи с 0,1 моль/л до желтого окрашивания. Индикатор метиловый красный
(CH2)6N4 + H2SO4 + 6H2O = 6HCOH + 2(NH4)2SO4
H2SO4 + 2NaOH = Na2SO4 + 2H2O
2. Внутриаптечный контроль
Метод алкалиметрии, прямое титрование. Менее точен, но используют в аптеке.
ТНП помещают в колбу для титрования, добавляют смешанный индикатор (метиловый оранжевый + метиленовый синий в соотношении 2:1) и титруют раствором кислоты хлористоводородной (HCI) с концентрацией 0,1 моль/л до перехода зеленой окраски раствора в фиолетовую.
(CH2)6 N4 + HCI = (CH2)6 N4 * HCI
3. Если анализируют растворы с концентрацией более5%, то определяют методом рефрактометрии.
Применение. Используют как дезинфицирующее средство. Его действие основано на образовании в кислой среде формальдегида, который и оказывает дезинфицирующее действие. Применяется при заболевании мочевых путей (учитывать реакцию среды!) Обладает и противоподагрическим действием, поэтому применяют и при ревматизме. Применяют как противогриппозное средство. Формы приема: порошки, таблетки и в/в инъекции в виде 40%растворов(застворы готовят асептически. Стерилизовать нельзя, т.к. при высокой температуре препарат разлагается с образованием большого количества формальдегида, который является клеточным ядом)
Хранение. В хорошо упоренных флаконах.
Глюкоза

Получение.
В результате гидролиза полимеров = полисахаридов - клетчатки или крахмала.
Свойства. Белый кристаллический порошок без запаха, сладкого вкуса. Легко растворим в воде.
Подлинность.
1.с реактивом Феллинга.
Препарат растворяют в воде, прибавляют раствор Феллинга и нагревают, образуется кирпично-красный осадок.
CuSO4 + 2NaOH = Cu(OH)2+ Na2 SO4

2. Реакция "серебряного зеркала" К раствору нитрата серебра прибавляют рпаствор аммиака до растворения образовавшегося осадка. К этому раствору прибавляют раствор глюкозы и нагревают. Выделяется металлическое серебро.
2AgNO3+ 2NH4OH = Ag2O↓ + 2NH4NO3 + H2O
Ag2O + 4 NH4OH = [Ag(NH3)2]OH + 3H2O
RCOH +2 [Ag(NH3)2]OH = RCOONH4 + 2Ag ↓+ 3NH3 + H2O
3. Реакция конденсации с тимолом
В выпарительную чашку помещают препарат (если раствор, то выпаривают) прибавляют концентр. H2 SO4 (водоотнимающее средство) и тимол, нагревают. Постепенно появляется красное окрашивание.
 тимол
тимол
Количественное определение
1. Метод йодометрии - обратное титрование в щелочной среде.
Точную навеску препарата растворяют в воде и прибавляют избыток I2 с концентрацией 0,1 моль/л и раствор щелочи.
I2 + 2NaOH=NaIO+H2O + NaI
R-COH + NaOI + NaOH = R-COONa + NaI +H2O чтобы прошла эта реакция раствор выдерживают 5-10 мин. в темном месте,
затем к раствору добавляют раствор H2 SO4. Выделевшийся йод оттитровывают раствором Na2S2O3 с концентрацией 0,1моль/л до соломенно-желтой окраски, затем добавляют крахмал раствор становится синего цвета. Продолжают титровать до обесцвечивания.
NaI + NaIO +H2SO4= I2 + Na2SO4 + H2O
I2 + Na2S2O3 = 2NaI + Na2S4O6.
-Если используют растворы глюкозы с концентрацией 5 % - рефрактометрия.
Применение. как питательное, общеукрепляющее вещество
Хранение. в плотно укупоренной таре при комнатной температуре.