1.Гидратация алкенов, т. е. присоединение воды к алкенам:
Н3Р04, 300°С
 Н2С=СН2 + Н20 СН3-СН2ОН
Н2С=СН2 + Н20 СН3-СН2ОН
Этилен Этанол
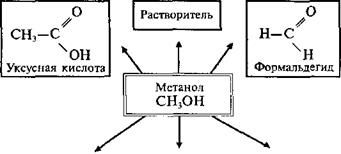
Специфические способы получения метанола и этанола
Р, t°, кат.
 СО2+2Н2 СН3ОН
СО2+2Н2 СН3ОН
Метанол
Этанол образуется при брожении (ферментации) углеводов — глюкозы или крахмала:
ферменты
 С6Н12ОН 2С2Н5ОН+2СО2
С6Н12ОН 2С2Н5ОН+2СО2
Глюкоза этанол
(раствор)
Применение важнейших спиртов:

 Пластмассы Горючее Хлористый метил СН3Cl
Пластмассы Горючее Хлористый метил СН3Cl
Обратите внимание: метанол чрезвычайно ядовит, прием внутрь 5—10 мл приводит к слепоте, 30 мл — к смерти.
 Растворитель
Растворитель
 | |||||
 | |||||
 | |||||
 Каучук Медицина
Каучук Медицина
 | |||
 | |||

 Пищевая Этанол Горючее
Пищевая Этанол Горючее


 промышленность С2Н5ОН
промышленность С2Н5ОН
 Пластмассы
Пластмассы
 | |||
 | |||
Красители Парфюмерия
В медицине С2Н5ОН применяется как дезинфицирующее средство и средство для компрессов, используется для приготовления экстрактов и настоек, как растворитель для многих лекарственных препаратов.
Предельные многоатомные спирты.
Свойства многоатомных спиртов рассмотрим на примере простейшего трехатомного спирта — глицерина, или про- пантриола-1,2,3:
СН2-СН-СН2
I I I
Он он он
Физические свойства.
Глицерин — вязкая, бесцветная, сладковатая на вкус нетоксичная жидкость с tкип = 290еС. Смешивается с водой во всех отношениях.
Химические свойства.
Замещение атомов водорода гидроксильных групп.
1.Как и одноатомные спирты, многоатомные спирты взаимодействуют со щелочными металлами', при этом могут образовываться моно-, ди- и тризамещенные продукты:
СН2─СН─СН2

 +Na │ │ │ +
+Na │ │ │ +  H2↑
H2↑
ОН ОН ОNa
Мононатрийглицерат
|
|
Н2С─О─Н +2Na СН2─СН─СН2
 │ │ │ │ +H2↑
│ │ │ │ +H2↑
 НС─О─Н ОН ОNa ОNa
НС─О─Н ОН ОNa ОNa
│ Динатрийглицерат
Н2С─О─Н
СН2─СН─СН2
 +3Na │ │ │ +
+3Na │ │ │ +  H2↑
H2↑
ОNa ОNa ОNa
Тринатрийглицерат
2.Наличие нескольких ОН-групп в молекулах многоатомных спиртов обусловливает увеличение подвижности и способности к замещению гидроксильных атомов водорода по сравнению с одноатомными спиртами. Поэтому, в отличие от алканолов, многоатомные спирты взаимодействуют с гидроксидами тяжелых металлов (например, с гидроксидом меди (II) Си(ОН)2). Продуктами этих реакций являются внутрикомплексные («хелатные») соединения, в молекулах которых атом тяжелого металла образует как обычные ковалентные связи Me—О за счет замещения атомов водорода ОН-групп, так и донорно-акцепторные связи Me←О за счет неподеленных электронных пар атомов кислорода других ОН-групп:
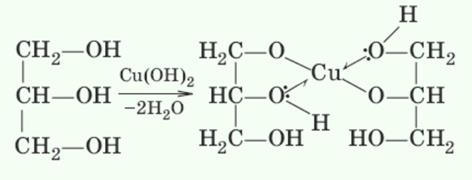
Нерастворимый в воде Си(ОН)2 голубого цвета растворяется в глицерине с образованием ярко-синего раствора глицерата меди (II). Эта реакция является качественной реакцией на все многоатомные спирты.
Применение глицерина.
Тринитроглицерин — взрывчатое вещество и одновременно лекарственный препарат; 1%-й спиртовый раствор нитроглицерина применяется в медицине в качестве средства, расширяющего сосуды сердца.
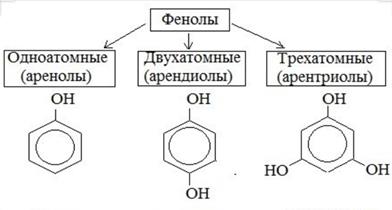
Фенолы.
Фенолы — это производные ароматических углеводородов, содержащие одну или несколько гидроксильных групп у атомов углерода бензольного кольца.
Физические свойства.
Большинство одноатомных фенолов при нормальных условиях представляют собой бесцветные кристаллические вещества с невысокой температурой плавления и характерным запахом. Фенолы малорастворимы в воде, хорошо растворяются в органических растворителях, токсичны, при хранении на воздухе постепенно темнеют в результате окисления.
|
|
Фенол С6Н5ОН (карболовая кислота) — бесцветное кристаллическое вещество, t°плавл = 43°С, t°кип = 182°С, на воздухе окисляется и становится розовым, при обычной температуре ограниченно растворим в воде, выше 66 СС смешивается с водой в любых соотношениях. Фенол — токсичное вещество, вызывает ожоги кожи, является антисептиком.
Химические свойства.
Химические свойства фенолов обусловлены наличием в их молекулах функциональной группы — ОН и бензольного кольца.
1) Взаимодействие со щелочами с образованием фенолятов (отличие от спиртов)
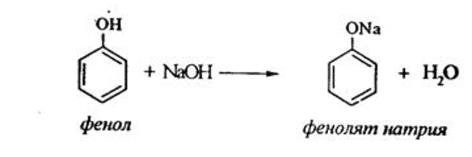
2) Нитрование
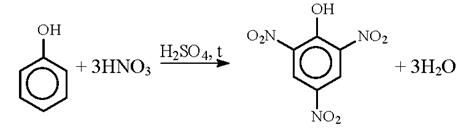
2,4,6-тринитрофенол